叠氮化合物还原成胺的研究进展
甘 兵,谢媛媛
(浙江工业大学长三角绿色制药协同创新中心,浙江 杭州 310014)
0 前言
在药物、染料、农用化学品等领域,胺类化合物都扮演着重要的角色,合成胺类化合物的方法很多,例如通过还原硝基、腈、叠氮、羟胺和偶氮化合物等,其中较佳方法之一是通过叠氮基的还原转化成氨基。从卤代物出发,通过无机叠氮化合物,如叠氮化钠等,可方便地把叠氮基引入到有机分子中,这种合成叠氮化合物的方法简便、快速。因此以叠氮化合物为底物合成胺的方法越来越受到有机化学家的密切关注。
早在2004年,王晓季等人[1]综述过叠氮化合物还原成胺的研究进展,其中主要包括硼氢化钠法[2]、催化加氢法[3]、三苯基膦参与的Staudinger反应[4]等。在过去十几年,该类反应有很多新的研究发现被报道,因此本文整理相关文献,着重介绍了近年来叠氮化合物还原成胺的最新研究进展。
1 还原方法
1.1 路易斯酸还原法
2006年,Luisa等[5]报道了叠氮化合物在温和的条件下可与三氯化铟反应生成胺(图1),图中R为芳基、脂肪基、磺酰基等。与以往报道过的其它类型的路易斯酸还原试剂相比,三氯化铟具有高度选择性,反应底物中氰基、卤素、羰基等易被还原基团不受影响,但当氰基与叠氮基位置相差三个亚甲基时,反应可环合生成五元的吡咯烷-2-亚胺类化合物(图1),收率在80%以上。文献报道,该类五元环化合物具有较好的一氧化氮合成酶(NOS)抑制作用,因此运用三氯化铟将叠氮化合物还原成胺在药物合成中具有潜在应用。
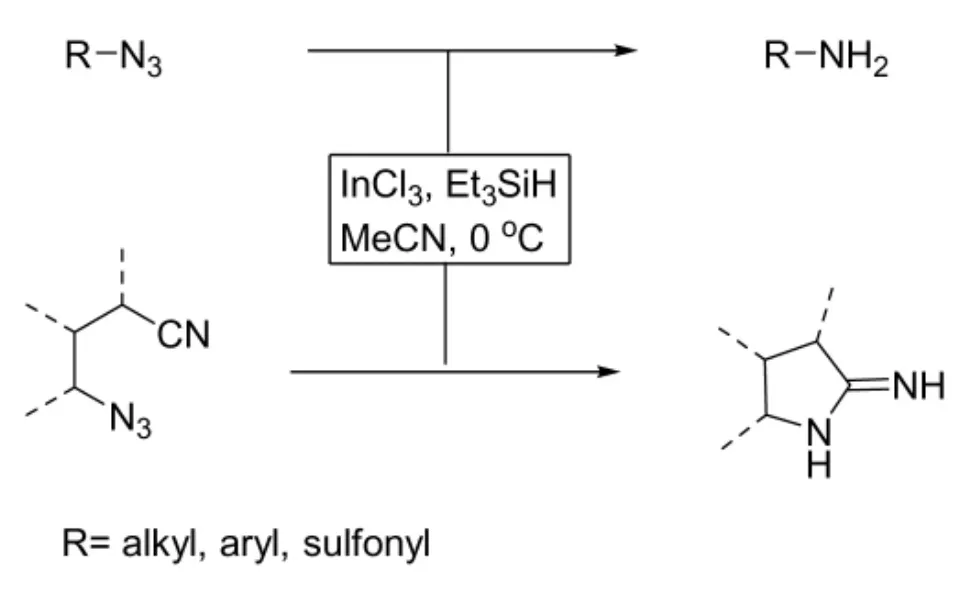
图1
2008 年,Saneyoshi等[6]报道了通 过 CeCl3·7H2O/NaI体系还原叠氮化合物成胺的方法 (图2),图中R为芳基、脂肪基等。采用路易斯酸/碘化物体系还原叠氮基的方法此前也曾被报道过,1990年,Balicki等人通过TiCl4/NaI体系实现了在温和的条件下还原叠氮化合物成胺[7];2002年,Kamal等报道了一种更加经济的路易斯酸FeCl3实现了叠氮基还原[8]。CeCl3·7H2O对NaI还原能力的促进作用明显,特别在微波辅助下可明显缩短反应时间,反应时间在20 min左右,收率86%以上。

图2
2017年,Kajitha等人[9]报道一种在酸性离子交换树脂存在下用碘化钠高效还原有机叠氮化物的方法 (图3),虽然文献报道的用碘化物还原叠氮化合物成胺的方法很多,但都需要有路易斯酸的参与才能完成,例如:BF3·OEt2[10]、FeCl3[8]、CeCl3[6]等,反应条件苛刻。 Kajitha 等人采用酸性离子交换树脂/碘化钠体系可高效还原叠氮化物,该反应在压力为2×104Pa旋转蒸发仪中40℃下反应15 min,原料就完全转化,后处理简单。
1.2 Staudinger法
2012年,Henri等[11]报道了一种新型有机磷催化的Staudinger反应来实现叠氮基的还原(图4),图中R为芳基、萘基、脂环基等。Staudinger反应是一类利用磷化物在水溶剂中将叠氮基转化为氨基的反应,通常反应过程中会形成中间体亚氨基正膦,随后水解成相应的胺和氧化膦。与传统Staudinger反应,该反应不需经过形成中间体再水解这一过程,因此体系不会产生氧化磷等有毒的水解产物,产物易纯化,且催化剂用量少,收率高,一般在80%左右,最高可达99%。

图3
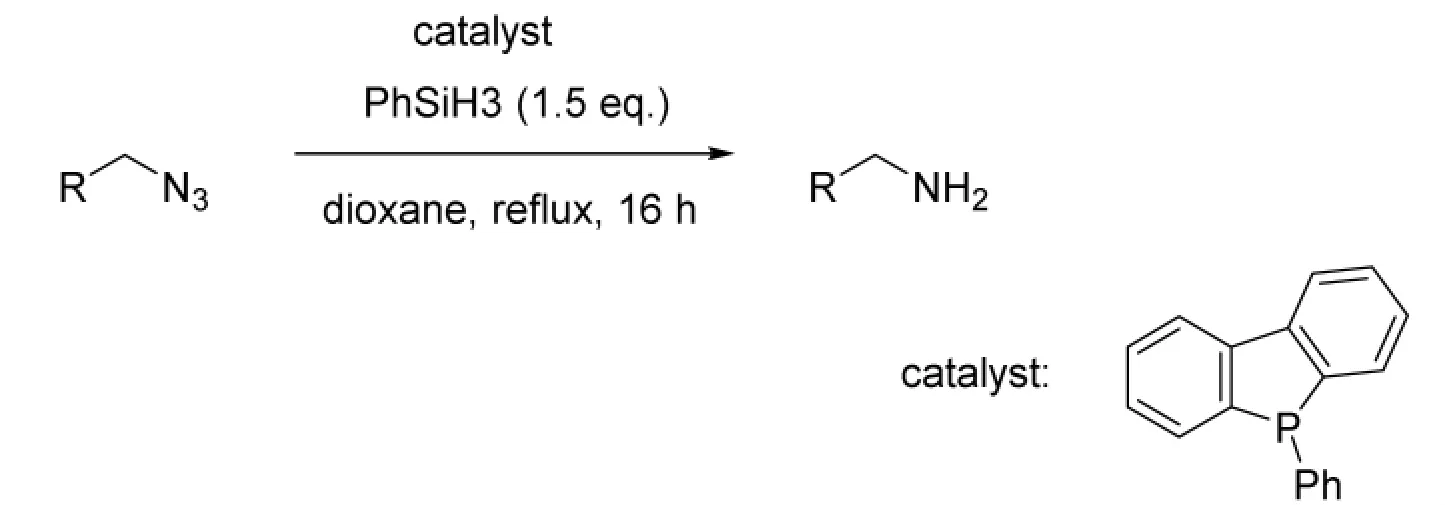
图4
2014年,Hisao等[12]人合成了一系列三苯基膦甲酰胺(TTPc)衍生物,发现该类化合物可替代三苯基膦促进Staudinger反应,可温和、高效地将叠氮基还原成氨基(图5),图中R为芳基、脂肪基等。同样,在反应过程中也不需要水解过程便可得到产物,产物收率81%以上。
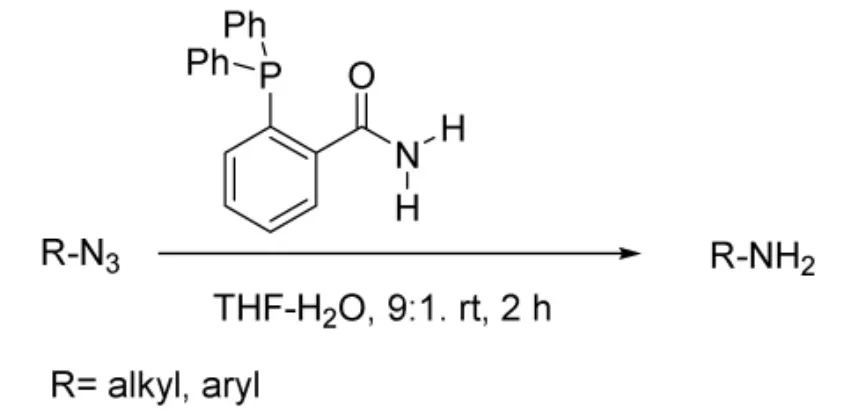
图5
2017年,Tomohiro等[13]报道了一种四氟硼酸三正丁基磷和三乙胺在含水四氢呋喃溶液中通过Staudinger反应将芳基叠氮化合物还原为苯胺的方法。作者研究发现在该反应体系中以3-叠氮基-5-(叠氮基甲基)苯类化合物为底物,只有芳基叠氮发生还原反应,对苄基叠氮没有影响(图6),图中R为卤素、氰基、烷基等。产物收率高,在89%以上。因此该反应对芳基叠氮具有很高的选择性。
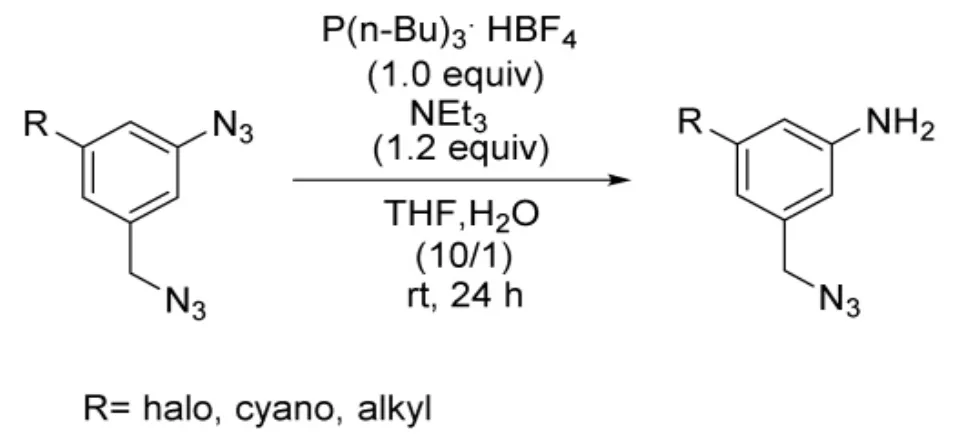
图6
1.3 Na3SPO3还原法
2011年,Jennifer等[14]意外发现化合物Na3SPO3也可将叠氮基还原成氨基,该研究小组初始目的为将含叠氮基的核苷化合物在Na3SPO3的作用下合成N-磷酸化的核苷,但通过结构鉴定发现并未得到目标产物,而是形成了带氨基的核苷(图7)。该方法同样适用于其它底物,例如:芳基叠氮、脂肪族叠氮等,反应条件温和,在室温下可进行,且对环境友好。

图7
1.4 纳米粒子材料还原法
2016年,Noriyoshi等[15]报道了一种具有高效选择性将叠氮催化加氢还原成胺的新型钯纳米粒子试剂(Pd NPs),以 Pd(OCOCH3)2和 4-辛炔为原料,在硼氢化钠的作用下可合成Pd NPs,合成方法如图8。

图8
该新型钯纳米粒子试剂对叠氮基催化加氢的选择性较高且收率高,当反应底物含酮羰基时,Pd NPs不会还原酮羰基,仅仅还原叠氮基(图9),虽然该试剂选择性好,但催化剂成本较高。

图9
2016年,Venkatareddy等[16]报道了另一种具有高效选择将叠氮化合物还原成胺的非均相纳米粒子材料,当底物含有双键等易被还原的基团时,该纳米粒子催化剂能选择性地催化还原叠氮基(图10),而双键不受影响。同时,当底物中含有多个叠氮基时,该催化剂可以选择性地还原位阻较小的叠氮基(图11)。除选择性好之外,该方法还有催化剂易回收、产物收率高等优点,产物收率在91%以上。

图10
1.5 D-葡萄糖还原法

图11
2017年,Nisha等[17]人报道了一种用D-葡萄糖和KOH作为绿色试剂,水作为溶剂将叠氮化合物还原成胺的快速且有效的方法(图12)。该方法底物适用性好,可还原芳香基叠氮、脂肪族叠氮、磺酰基叠氮等,且收率高,反应时间短(10~15 min),对环境友好。

图12
2 总结与展望
综上所述,近几年报道的叠氮化合物还原成胺的方法很多,每种方法都具有自己的特色。例如,有些方法的化学选择性好,在还原叠氮基的同时不影响分子中硝基、羰基、氰基、卤素等其他官能团;有些方法在底物含有多个叠氮基时可选择还原某一特定位点叠氮基;有些方法底物适用性强,可同时还原芳基叠氮、脂肪族叠氮、磺酰基叠氮等;还有些还原方法可用于合成亚胺的衍生物。从还原体系来看,有的方法所用试剂廉价、易得,反应条件温和;有的采用纳米粒子催化剂,催化剂高效、可循环使用;有的采用环境友好型试剂,对环境污染小。但同时有些方法具有一定局限性,如:一些试剂虽然绿色环保,但价格相对昂贵;一些试剂虽然比较廉价,但对环境污染较大,且选择性不好。随着研究的不断深入,相信在今后会有更多叠氮化合物还原成胺的方法和试剂被报道,并将其运用在更广泛的领域。

