初探Ste-20激酶在调控孢子丝菌双相生长过程中的作用
张振颖 胡媛媛 陈凯丽 侯彬彬
(1.香港大学深圳医院皮肤科,深圳 518053;2.辽宁大学生命科学院,沈阳 110031;3.大连医科大学附属第一医院皮肤科,大连 116023)
孢子丝菌病可引起皮肤、皮下组织以及附近淋巴管的慢性感染,导致化脓、溃烂及渗出,偶可累及肌肉、骨骼、中枢神经系统等脏器[1]。在我国,孢子丝菌病发病率是仅次于念珠菌病和曲霉病的深部真菌病。孢子丝菌具有双相性:室温 (25℃)为菌丝相,无致病性;37℃为酵母相,酵母相可在感染者体内增殖,具有致病性[2]。因此,孢子丝菌由菌丝相转化为酵母相对其致病性的形成是必需的[3]。在孢子丝菌酵母相形成过程中,不仅菌株形态和细胞壁的组成成分发生改变,其酵母相特异表达的毒力基因也被诱导表达。目前,在双相型病原真菌中鉴定出来的毒力基因主要有BAD1[4]、AGS1[5]、BYS1[6]和CBP1[7]等基因。与之比较,有关孢子丝菌酵母相形成过程的研究相对滞后,被鉴定出来的酵母相特异表达毒力基因数量很少,无法全面分析其双相转化的全过程。
MAPK通路在多种真菌中具有重要调控功能,酿酒酵母中MAPK级联反应至少参与五种信号转导途径:细胞壁的完整性通路、孢子壁的组装通路、菌丝的生长通路、信息素的反应通路、高渗透性甘油通路, 从而调控其生长、形态改变、繁殖和应激反应[7-8]。
Ste-20激酶被鉴定为MAPK信号通路的上游调控激酶,目前其在真菌中的功能,主要集中在酿酒酵母 (Saccharomycescerevisiae)中进行研究[9]。Ste-20通过依次激活MAPKKK-MAPKK-MAPK的级联反应来调控MAPK信号通路。Ste-20可以调控酿酒酵母的细胞壁形成、接合过程、渗透压调节和菌丝生长等功能[10]。Ste-20在病原真菌中的作用报道较少,有报道其可以调控植物致病真菌玉米黑粉菌 (Ustilagomaydis)的接合过程和致病性[11]。另一Ste-20同源激酶PakA激酶 (p21-Activated Kinase),被报道可以调控双相型真菌马尔尼非蓝状菌 (Penecillium,既往称马尔尼菲青霉Penecilliummarnefiii)的分生孢子萌发和酵母相细胞的形态[12-13]。
本实验拟采用实验室前期建立的根癌农杆菌介导的小分子双链RNA干扰技术构建Ste-20基因沉默[14],观察、分析Ste-20基因对孢子丝菌在双相转换过程的影响,从而进一步分析Ste-20激酶在孢子丝菌中调控双相转换过程中的作用。
1 材料和方法
1.1 观察菌丝相形态
观察接种于沙氏固体培养基平板上的菌株在25℃下的形态,研究Ste-20基因干扰后对株生长形态的影响。取标准株ATCC10268和干扰株 (Ste-20i)于沙氏固体培养基平板上25℃培养,待生长3~7 d后观察菌落形态。
1.2 观察酵母相和菌丝相的生长情况
分别挑取标准株和干扰株,置于培养箱中培养,镜检观察接种于两种培养基中的菌株在25℃和37℃温度下菌丝及孢子生长情况,研究Ste-20基因干扰对孢子丝菌菌丝相酵母相转化的影响。
1.3 菌丝相的处理
将干扰株和标准株接种于沙氏培养基的培养液中,25℃,150 r/min培养,每隔24 h取出200 mL待测培养液倒入离心管中,进行离心并用双蒸水洗涤3次,在105℃烘箱中烘干,分别称量不同菌株菌丝的干重。每一处理设置4次重复。
1.4 孢子生长情况的观察
①将一定数量的野生标准株和干扰株的孢子丝菌菌液于BHI液基上,37℃培养箱中培养7 d。②分别取相同OD值的野生标准株和干扰株菌液继续于37℃ BHI液体培养基中培养,每隔24 h测定37℃ BHI培养基中菌株孢子OD值,观察OD值变化。
1.5 透射电镜观察
进行取材,固定,漂洗,脱水 (30%乙醇或丙酮—50%乙醇或丙酮—70%乙醇或丙酮—90%乙醇或丙酮—100%乙醇或丙酮2次,每次每级10~30 min),浸透,包埋,修块,切片,染色,观察。
2 结 果
2.1 Ste-20基因沉默后孢子丝菌的表型变化
菌落形态观察 将孢子丝菌标准株、干扰株分别在沙氏固体培养基平板上25℃培养3 d和7 d后,标准株和干扰株的菌落形态明显变化,主要表现干扰株生长受到抑制,菌落直径较标准株变小,色素生产减少 (见图1)。
菌丝生长情况观察 将相同OD值的标准株和干扰株在沙氏液体培养及中25℃培养24 h后,按前述方法称种,标准株为0.299 7 g,干扰株为0.100 1 g;96 h后标准株为2.854 7 g,干扰株为0.812 7 g。即96 h后标准株增长了2.555 g,而干扰株只增长了0.712 6 g,提示干扰株菌丝生长缓慢 (见图2)。
孢子生长情况观察 相同OD值的标准株和干扰株菌悬液于37℃培养后,结果显示在24 h后干扰株为0.17,标准株为0.47;96 h后干扰株为0.29,标准株为0.62;168 h (1周)后干扰株为0.52,标准株为1.01。提示下调Ste-20基因的表达对孢子的生长有抑制作用,孢子萌发缓慢 (见图3)。
2.2 Ste-20基因干扰对孢子丝菌菌丝相酵母相转化的影响

图1比较Ste-20i干扰株,ATCC标准株在25℃生长时菌落的变化:A.Ste-20i干扰株25℃培养3 d;B.Ste-20i干扰株25℃培养7 d;C.ATCC标准株25℃培养3 d;D.ATCC标准株25℃培养7 d图2不同时间下的申克孢子丝菌干重曲线图
Fig.1Compared the colonies of Ste-20i and ATCC growing at 25℃:A. The Ste-20i cultured at 25℃ for 3 d; B. The Ste-20i cultured at 25℃ for 7 d; C. ATCC cultured at 25℃ for 3 d; D. ATCC cultured at 25℃ for 7 dFig.2Curve ofSporothrixschenckiidry weight at different times
Fig.3Curve of the OD value ofSporothrixschenckiiat different times
菌丝及孢子萌发的镜检观察 相同数量的标准株和干扰株的孢子分别放在25℃和37℃的SDA和BHI液体培养基中培养,结果显示在25℃培养24 h后,干扰株菌丝生长延缓;37℃培养24 h后,标准株可见出芽产孢,干扰株的孢子萌发缓慢,菌丝变短,未见出芽产孢 (见图4)。
2.3 Ste-20基因对孢子丝菌超微结构的影响
标准株和干扰株分别在SDA液体培养基上培养25℃,7 d,使用透射电镜观察,由图可见与标准株相比,干扰株细胞壁欠完整致密,变疏松,细胞质也变得疏松、杂乱,菌丝较标准株变短,孢子也较标准株欠圆整 (见图5)。
3 讨 论
本课题组前期利用比较蛋白组学的方法,鉴定出Ste-20激酶为孢子丝菌酵母相特异表达蛋白[15]。随后我们利用RACE方法从孢子丝菌中克隆了该基因,通过Real time RT-PCR方法进一步检测,发现Ste-20的mRNA表达水平在酵母相是菌丝相15倍[16]。尽管已经鉴定出很多Ste-20的功能,但对其在病原真菌,特别是双相型病原真菌中的功能和调控机制知之甚少。根据细胞内信号通路的网络化作用方式,Ste-20激酶作为MAPK信号通路的上游调控蛋白,很可能与多种膜受体等多种上游信号关联从而调控MAPK信号通路。结合文献和我们的前期数据,推测Ste-20在孢子丝菌的双相转换和致病性形成中可能具有重要作用。其机制可能为Ste-20参与双组份信号系统反应调控蛋白SSK1激活MAPK通路的过程或者其存在Ste-20独立的调控机制。我们采用实验室前期建立的根癌农杆菌介导的小分子双链RNA干扰技术构建Ste-20基因沉默菌株,观察、分析Ste-20基因下调对孢子丝菌在双相转换过程等方面的影响,初步确定了Ste-20激酶可能在调控孢子丝菌双相转换该过程中的作用,后期我们还将在致病性等方面继续展开研究,这或许进一步阐明孢子丝菌病的发病机制,并发现潜在的治疗靶点,提供新的治疗策略。
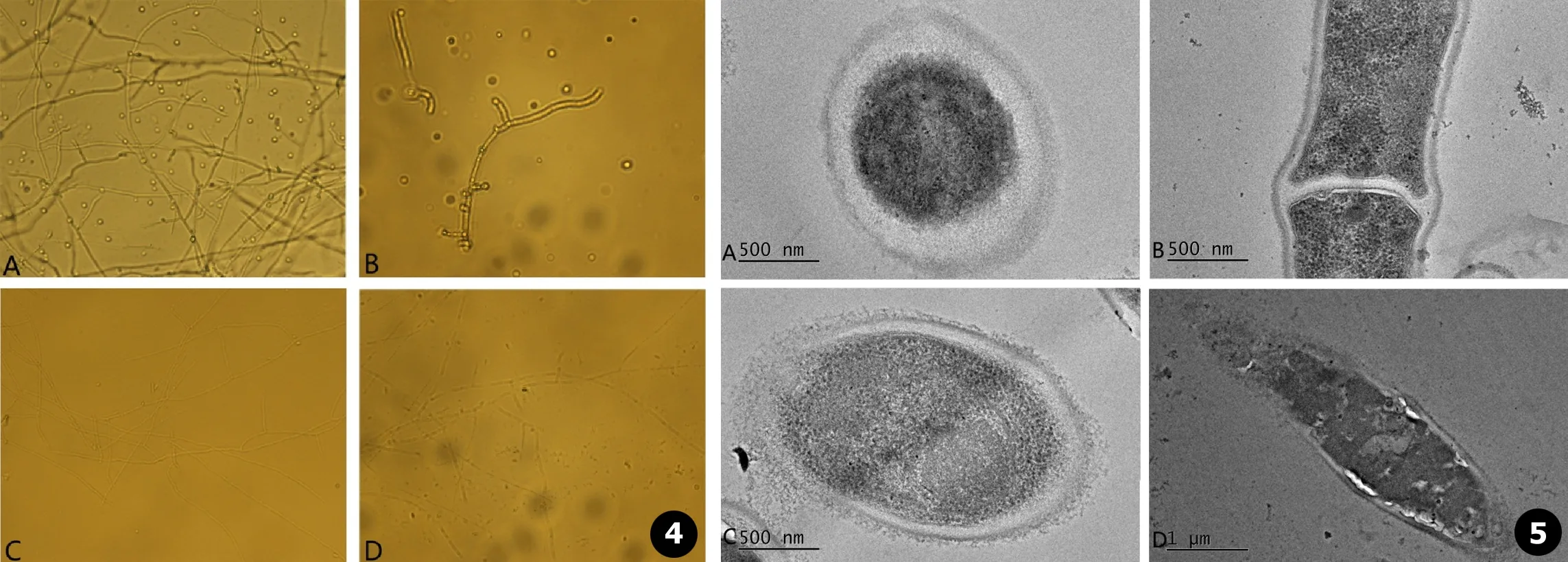
图4观察分析Ste-20基因沉默对孢子丝菌孢子生成数量、孢子显微形态等方面的影响:A.ATCC 25℃培养菌丝相;B.ATCC 37℃培养酵母相;C:Ste-20i 25℃培养;D.Ste-20i 37℃培养图5标准株与干扰株25℃培养透射电镜结:A.标准株 (ATCC10268)25℃培养下的孢子;B.标准株 (ATCC10268)25℃培养下的菌丝;C.干扰株Ste-20i 25℃培养下的孢子;D.干扰株Ste-20i 25℃培养下的菌丝
Fig.4Observe and analyze the effects of Ste-20 gene silencing on sporulation quantity and spore morphology of sporidium spore: A. ATCC mycelium cultured at 25℃; B. ATCC yeast phase cultured at 37℃; C. Ste-20i culture at 25℃; D. Ste-20i cultured at 37℃Fig.5Transmission electron microscope result of standard strain and interferred strain at 25℃: A. Standard strain (ATCC10268) spores cultured at 25℃; B. Standard strain (ATCC10268) mycelium cultured at 25℃; C. Linterferred strain Ste-20i spores cultured at 25℃; D. Linterferred strain Ste-20i mycelium cultured at 25℃

