美人鱼发光杆菌溶血素Hlych基因的原核表达及免疫血清制备
吴同垒,靳晓敏,王洪彬,陈 玥,张志强,高桂生,单晓枫,史秋梅*
(1.河北科技师范学院,河北秦皇岛 066004;2.吉林农业大学,吉林长春 130118)
美人鱼发光杆菌(Photobacteriumdamselae)是嗜盐病原菌中的重要成员,患病鱼临床以出血性败血症为典型特征,发病急,病程短,病死率高,造成了重大的经济损失[1-2]。美人鱼发光杆菌包括2个亚种,即美人鱼发光杆菌美人鱼亚种(Photobacteriumdamselaesubsp.damselae)和杀鱼亚种(Photobacteriumdamselaesubsp.piscicida)[3]。美人鱼发光杆菌毒力机制和基因研究不够深入,已知高致病力的美人鱼发光杆菌美人鱼亚种通常携带约150 kb的毒力质粒,编码2种关键性的毒力因子溶血素Dly和HlyApl,同时染色质中也携带溶血素Hlych基因,这3种溶血素都对细菌的毒力有不同程度的影响[4-5]。一般认为杀鱼亚种不具有溶血素,也不含有这种毒力质粒,但致病性与美人鱼亚种相比并不弱,且能引起机体多个部位的出血性病变[6-7]。
2015年11月,秦皇岛昌黎县某海水养殖场养殖的大菱鲆(turbot)大量发病,病鱼表现为体表溃疡,鳍部出血,尾部溃烂,严重腹水。本课题组从腹水中分离鉴定了美人鱼发光杆菌杀鱼亚种,并由中国海洋微生物保藏中心命名为MCCC 1K03226。本研究利用PCR方法检测发现其携带溶血素Hlych基因,原核表达和免疫原性分析结果显示,Hlych蛋白具有良好的免疫原性。分离的美人鱼发光杆菌杀鱼亚种获得了溶血素基因,其毒力可能会进一步增强,而Hlych蛋白可以用于建立ELISA诊断方法。
1 材料与方法
1.1 材料
1.1.1 菌株 美人鱼发光杆菌杀鱼亚种MCCC 1K03226,由河北科技师范学院预防兽医学重点实验室分离,中国海洋微生物保藏中心保藏;克隆菌株大肠埃希菌感受态DH5α、表达菌株BL21(DE3)和表达载体pET32a(+)由河北科技师范学院预防兽医学重点实验室保存。
1.1.2 实验动物 6周龄Balb/c小鼠,购自北京维通利华实验动物技术有限公司。
1.1.3 主要试剂 ExTaqDNA聚合酶、dNTP,宝生物工程(大连)有限公司产品;限制性内切酶BamHⅠ和SalⅠ、T4连接酶,D 2 000 plus DNA Maker、预染蛋白Maker,美国Thermo Scientific公司产品;透析袋和硝酸纤维素膜,Millipore公司产品;细菌基因组提取试剂盒、核酸凝胶回收试剂盒、质粒小提试剂盒,天根生化科技(北京)有限公司产品;His标签单克隆抗体、SDS-PAGE凝胶制备试剂盒、羊抗鼠IgG-HRP,北京康为世纪生物科技有限公司产品;其余试剂为国产分析纯。
1.2 方法
1.2.1 引物的设计与合成 从NCBI下载Photobacteriumdamselaesubsp.damselaeCIP 102761 (Phdd CIP 102761,基因登录号:NZ-ADBS00000000)全基因组序列,利用软件Vector NTI找到Dly、Hlypl和Hlych基因序列,利用primer premier 5.0设计引物,送生工生物公司北京分公司合成。引物序列如表1。

表1 引物信息
1.2.2 细菌溶血活性观察和溶血素基因扩增 制备血平板,挑取保存菌种MCCC 1K03226在平板上划线,30℃培养24 h,观察溶血活性。按照细菌基因组提取试剂盒说明书提取DNA。以基因组DNA为模板,用表1中引物,采用降落PCR进行扩增。
获得Hlych基因全长后与T载体按常规方法连接,获得重组载体pMD18-T-Hlych,并送生工生物公司北京分公司测序。
1.2.3 生物信息学分析 对测序结果应用NCBI的Blastn工作区进行同源性比对,应用在线软件ProtParam (http://www.expasy.org/cgi-bin/protparam) 分析其基本理化特性。应用在线软件PSORTb (http://www.psort.org/psortb/)进行蛋白质亚细胞定位分析。
1.2.4 重组表达载体pET32a-Hlych的构建 使用限制性内切酶BamHⅠ和SalⅠ对pMD18-T-Hlych和表达载体pET32a(+)进行双酶切,凝胶电泳回收酶切产物按照一定比例混合,22℃连接2 h,转化大肠埃希菌感受态DH5α,涂布含Amp的LB平板,37℃培养过夜。挑取单菌落摇菌,使用载体通用引物进行PCR鉴定。阳性菌落扩大培养,保存菌种并提取质粒,重组质粒记为pET32a-Hlych。用提取的重组质粒转化表达菌株BL21,涂布含Amp的LB固体平板,37℃培养过夜。
1.2.5 Hlych的原核表达 挑取Amp平板上的单菌落摇菌过夜,次日吸取1 mL菌液接种100 mL含Amp的液体LB培养基,220 r/min摇菌,至OD 600 nm值达到约0.6,加入IPTG诱导表达4 h。离心收集菌体,PBS洗涤3次后PBS重悬,加入Loading buffer煮沸裂解,进行SDS-PAGE,分离胶浓度为120 g/L。电泳结束后,凝胶染色脱色观察结果,同时使用His单克隆抗体进行Western blot验证目的蛋白的表达。
1.2.6 Hlych鼠源多抗血清的制备及效价测定 为获得Hlych鼠源的多抗血清,首先进行蛋白纯化。诱导表达后超声裂解菌体,离心,分别取上清和沉淀进行SDS-PAGE,确定蛋白表达形式; 用QIAGEN Ni-NTA柱进行蛋白纯化,用ND2000进行蛋白浓度测定。加入弗氏完全佐剂乳化后免疫6周龄~8周龄Balb/c小鼠,免疫剂量为100 μg/只;3周后加弗氏不完全佐剂乳化后二免,再过2周后加强免疫,二免和加强免疫剂量为50 μg/只。免疫结束后小鼠眼球取血,分离血清。培养至对数期的美人鱼发光杆菌MCCC 1K03226,用1 mL PBS洗涤重悬,加入Loading buffer煮样后,用稀释200倍的血清进行Western blot分析。
以100 ng/孔蛋白包被酶标板,血清倍比稀释为一抗,HRP-羊抗兔二抗为酶标抗体,测定血清抗体效价。
2 结果
2.1 细菌溶血活性观察
挑取美人鱼发光杆菌杀鱼亚种MCCC 1K03226单菌落在绵羊血和兔血平板上划线,观察其溶血活性。结果如图1所示,该菌在绵羊血(图1A)和兔血(图1B)平板上均呈β型溶血,显示该菌具有非常强的溶血活性。
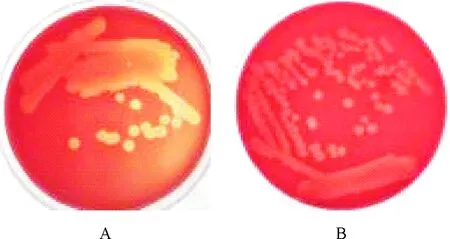
A.绵羊血琼脂;B.兔血琼脂
A.Sheep blood agar;B.Rabit blood agar
图1细菌溶血性观察
Fig.1 Observation of colonial hemolytic activity
2.2 溶血素基因检测及Hlych基因扩增
以提取的细菌基因组DNA为模板,采用设计合成的引物进行PCR扩增,反应结束后10 g/L琼脂糖凝胶电泳。如图2A所示,3种溶血素中,Hlych基因(约420 bp)检测为阳性,因此判断该菌携带Hlych基因。根据NCBI公布的Hlych序列,利用SignaIP进行信号肽预测,用引物Hlych-F和Hlych-R扩增去除信号肽编码序列的Hlych基因,结果如图2B,条带大小与预期符合(约1 716 bp)。

A.3种溶血素基因的检测;M.DNA标准DL 2 000;1.Hlych;2.Hlypl;3.Dly;B.Hlych基因扩增;M.DNA标准DL 2 000;1.Hlych
A.Detection of 3 hemolysin genes;M.DNA Marker DL 2 000; 1.Hlych; 2.Hlypl; 3.Dly; B.Ampllication of Hlychgene:M.DNA Marker DL 2 000; 1.Hlych
图2溶血素基因的检测
Fig.2 Detection of hemolysin genes
2.3 Hlych生物信息学分析
比对结果显示,Hlych基因与美人鱼发光杆菌溶血素HlyA基因同源性达到99%,因此确定成功获得了美人鱼发光杆菌杀鱼亚种MCCC 1K03226的Hlych基因全长。分析结果显示,该基因编码蛋白大小(去除信号肽)为64.7 ku;半衰期为20 h (体外哺乳动物细胞内),稳定系数为40.17,属易降解蛋白。蛋白质亚定位分析显示Hlych为胞外蛋白,这与其发挥的生物学功能相适应,蛋白能够被分泌出细菌细胞,从而引起溶血等一系列作用。
Chou-Aasman方法进行DNA Star分析显示,Hlych二级结构包括14个ɑ螺旋,22个β折叠和50个转角(图3)。
图3 Hlych二级结构预测
2.4 Hlych诱导表达及Western blot验证
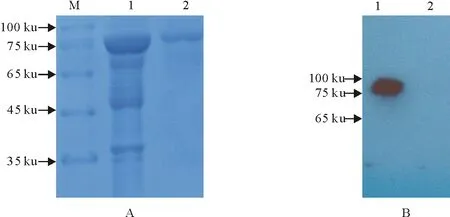
经过PCR鉴定,重组表达质粒pET32a-Hlych转化表达菌株BL21,IPTG诱导表达后进行SDS-PAGE分析,结果如图4A所示,目的蛋白符合预期大小(预期蛋白大小约为79 ku),而空载对照(empty vector)表达的蛋白约20 ku。利用His单克隆抗体进行Western blot分析,如图4B所示,在相应位置也出现预期印迹条带。SDS-PAGE和Western blot分析结果说明,Hlych蛋白获得了表达。
2.5 Hlych鼠源抗血清的制备及效价测定
为了获得纯化的Hlych蛋白,首先确定蛋白表达形式,诱导的菌体超声裂解后取上清和沉淀进行SDS-PAGE分析,显示目的蛋白为包涵体表达。利用Ni-柱进行蛋白纯化,如图5A所示,蛋白纯化效果良好。纯化的蛋白与弗氏佐剂乳化,免疫小鼠后眼球采血分离血清,1∶200稀释后进行Western blot分析,如图5B所示,在约79 ku处出现了明显的印迹条带,与预期蛋白大小一致,说明Hlych具有一定的免疫原性。 经过ELISA测定,在蛋白包被浓度为100 ng/孔时,确定该血清的抗体效价为1∶5 000。

A.SDS-PAGE;1.Hlych;2.空载对照; B.Western blot;1.Hlych;2.空载对照A.SDS-PAGE;1.Hlych; 2.Control; B.Western blot;1.Hlych; 2.Control
A.Hlych蛋白纯化;M.蛋白分子质量标准;1.蛋白纯化前;2.蛋白纯化后;B.血清Western blot验证;1.阳性血清;2.阴性对照
A.Protein purification of Hlych;M.Protein molecular weight Marker; 1.Before purification; 2.After purification; B.Western blot based on serum;1.Positive serum; 2.Negative serum
图5 Hlych蛋白纯化及血清Western blot验证
Fig.5 Protein purification of Hlychand Western blot based on serum
3 讨论
美人鱼发光杆菌(Photobacteriumdamselae)是嗜盐病原菌中的重要成员,感染该菌的患病鱼临床以出血性败血症为典型特征,发病迅速,病死率高,对海洋经济鱼类养殖业造成了重大经济损失[6,8-9]。课题组前期从发病的大菱鲆体内分离到美人鱼发光杆菌杀鱼亚种,该菌具有溶血活性,同时表现出对大菱鲆的较强致病性。目前研究认为,美人鱼发光杆菌美人鱼亚种共编码3种溶血素,其中Hlypl和Dly由质粒编码,Hlych由染色质编码[10-11]。本研究对分离得到的美人鱼发光杆菌杀鱼亚种进行这3种溶血素基因的PCR检测,结果显示,该菌株具有溶血素Hlych基因,不携带Hlypl和Dly基因。有研究表明携带溶血素基因的菌株,往往比不携带的菌株毒力强,由于携带溶血素Hlych基因,这也在一定程度上解释了本次分离的菌株具有较强的致病性的原因。溶血素基因往往由基因转移而来,我国国内美人鱼发光杆菌的毒力可能伴随多种毒力基因的转移而逐渐增强[11-13]。从国内近几年的报道,结合本课题组的调查研究,美人鱼发光杆菌已经具备了较强的毒力,可造成大菱鲆和舌鳎等海鱼大批死亡[14]。
溶血素是美人鱼发光杆菌重要的毒力因子之一,能够作用于红细胞的脂质双分子层,使细胞膜形成空洞,改变细胞膜的通透性,引起红细胞的破裂溶解,从而释放出更多的血红素,为其提供更多的Fe3+,最终导致海水养殖动物组织器官的坏死,甚至造成感染动物的死亡[15]。通过对该菌Hlych基因全长的生物信息学分析发现,该基因与美人鱼亚种溶血素基因同源性达到99%以上,因此判定该基因为溶血素编码基因。细胞定位预测为胞外蛋白,提示该蛋白能够被分泌出细菌细胞,从而发挥溶血等一系列生物学功能[16]。
美人鱼发光杆菌病目前没有有效的诊断方法,原核表达和免疫原性分析结果表明该菌的Hlych蛋白具有良好的免疫原性,可以用于建立ELISA诊断方法。目前本课题组正在利用该蛋白进行ELISA方法的开发,希望能够为高毒力美人鱼发光杆菌病提供快速诊断方法。同时,由于其具有良好的免疫原性,又是细菌重要的毒力因子,有潜在的作为亚单位疫苗开发的价值。
——和田盘羊

