内镜下经椎板间隙与经椎间孔治疗L5/S1腰椎间盘突出症的对比研究
周杰,吴小涛,2,蒋赞利,2,朱磊,2
(1.东南大学 医学院,江苏 南京 210009;2.东南大学附属中大医院 脊柱外科,江苏 南京 210009)
随着人们生活习惯的变化以及诊断水平的提高,腰椎间盘突出症的发病率逐年上升[1]。由于特殊的解剖学和生物力学特点,腰椎间盘突出症主要发生在L4/5间隙,其次是L5/S1间隙[2]。针对腰椎间盘突出症的微创治疗一直是脊柱科医师的研究热点,而内镜下经皮腰椎间盘切除术是迄今为止创伤最小同时具有明显效果的微创手术方式[3],其经典的手术路径为经椎间孔入路,适合所有节段,但在处理L5/S1间隙突出的髓核时,患者高大的髂嵴以及宽大的L5横突往往阻挡通道的置入[4],增大手术难度,延长手术时间,增加患者的痛苦,这时经椎板间隙入路成为合适的选择,其利用L5/S1宽大的椎板间隙进行置管,避免了与髂嵴、横突的冲突,方便术者操作[5- 6]。经椎板间隙治疗L5/S1腰椎间盘突出症虽已存在数年,针对其临床效果尚缺乏大样本量的临床研究,本研究将采用非随机对照的研究方法,前瞻性的纳入样本,探讨经椎板间隙与经椎间孔治疗L5/S1腰椎间盘突出症的手术过程和疗效的差异,为临床医生选择手术路径提供更多的支持。
1 资料与方法
1.1 一般资料
本研究病例纳入时间为2015年6月1日至2017年6月30日,最终共纳入99例,手术方式由患者本人自愿选择,手术由同一组医师完成,最终经椎板间隙组(IL- PELD组)共有46例,经椎间孔组(TF- PELD组)共有53例。IL- PELD组年龄最小19岁,最大64岁,平均(37.25±2.73)岁,男31例,女15例;TF- PELD组年龄最小23岁,最大67岁,平均(31.70±1.45)岁,男37例,女16例。两组患者的一般情况和术前病情相比差异无统计学意义,具有可比性,见表1。
1.2 纳入标准和排除标准
纳入标准:单侧腰腿痛符合S1神经根压迫症状;腰椎MRI检查示与症状相符合的L5/S1腰椎间盘突出症;保守治疗8周后症状未见缓解或未到8周原有症状加重;患者本人要求行微创治疗。
排除标准:双侧神经根压迫症状;非S1神经根压迫症状或伴有其他节段的神经根压迫症状;伴有明显钙化、腰椎滑脱、腰椎管狭窄、腰椎侧弯等不适合行微创治疗的并发疾病;极外侧型腰椎间盘突出症。
1.3 手术方法
IL- PELD组的手术示意图见图1A、B,TF- PELD组的手术示意图见图1C、D。
表1两组患者一般情况比较
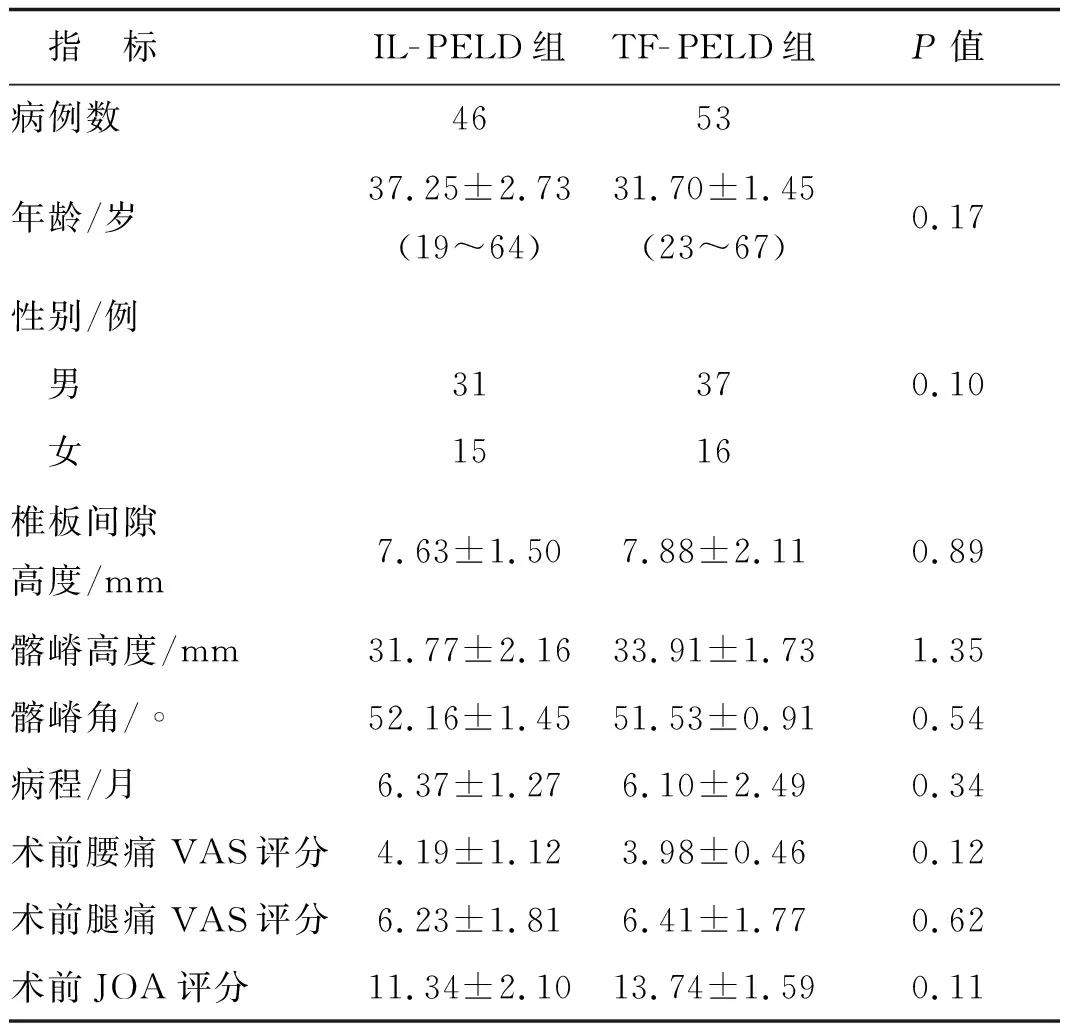
指 标IL-PELD组TF-PELD组P值病例数4653年龄/岁37.25±2.73(19~64)31.70±1.45(23~67)0.17性别/例 男31370.10 女1516椎板间隙高度/mm7.63±1.507.88±2.110.89髂嵴高度/mm31.77±2.1633.91±1.731.35髂嵴角/∘52.16±1.4551.53±0.910.54病程/月6.37±1.276.10±2.490.34术前腰痛VAS评分4.19±1.123.98±0.460.12术前腿痛VAS评分6.23±1.816.41±1.770.62术前JOA评分11.34±2.1013.74±1.590.11
VAS:视觉模拟评分;JOA:日本骨科协会评估治疗分数
IL- PELD组:硬膜外疼痛分离麻醉生效后,病人取俯卧位,调整手术床,使腰椎前屈,消毒铺巾,于L5/S1椎间隙症状侧旁开1 cm处以克氏针定位,C臂机透视位置无误后,于椎旁做0.8 cm切口,放置Joimax椎间孔镜工作套管及椎间孔镜工作通道,直至L5/S1椎板间隙,C臂机透视位置无误,内镜下找到并切除部分黄韧带,进入椎管,将S1神经根向内侧牵开,见后突的椎间盘,将其摘除,扩大神经根管,彻底松解神经根,等离子刀头止血、纤维环热凝成形,退出工作通道,皮下缝合,关闭切口。
TF- PELD组:病人取俯卧位,在透视下确定L5/S1间隙,取症状侧椎间隙旁开12 cm为进针点,常规消毒铺巾,用脊髓穿刺针向L5/S1椎间孔处水平向腹侧穿刺,C臂机正侧位确定导针近端穿刺到椎间孔和椎间隙内,插入导丝,自穿刺处切开0.8 cm皮肤,置入套管,环锯扩张椎间孔,放入工作套管,并在C臂机下确认位置,连接Joimax椎间孔镜成像系统和工作通道,在显示屏上显示椎间孔和椎间隙右后方,见蓝染的纤维环及髓核组织,用不同髓核钳钳取突出变性脱垂的髓核,等离子刀头射频消融止血、封闭破裂的纤维环,观察手术区域无活动性出血后退出工作通道,缝合皮肤。
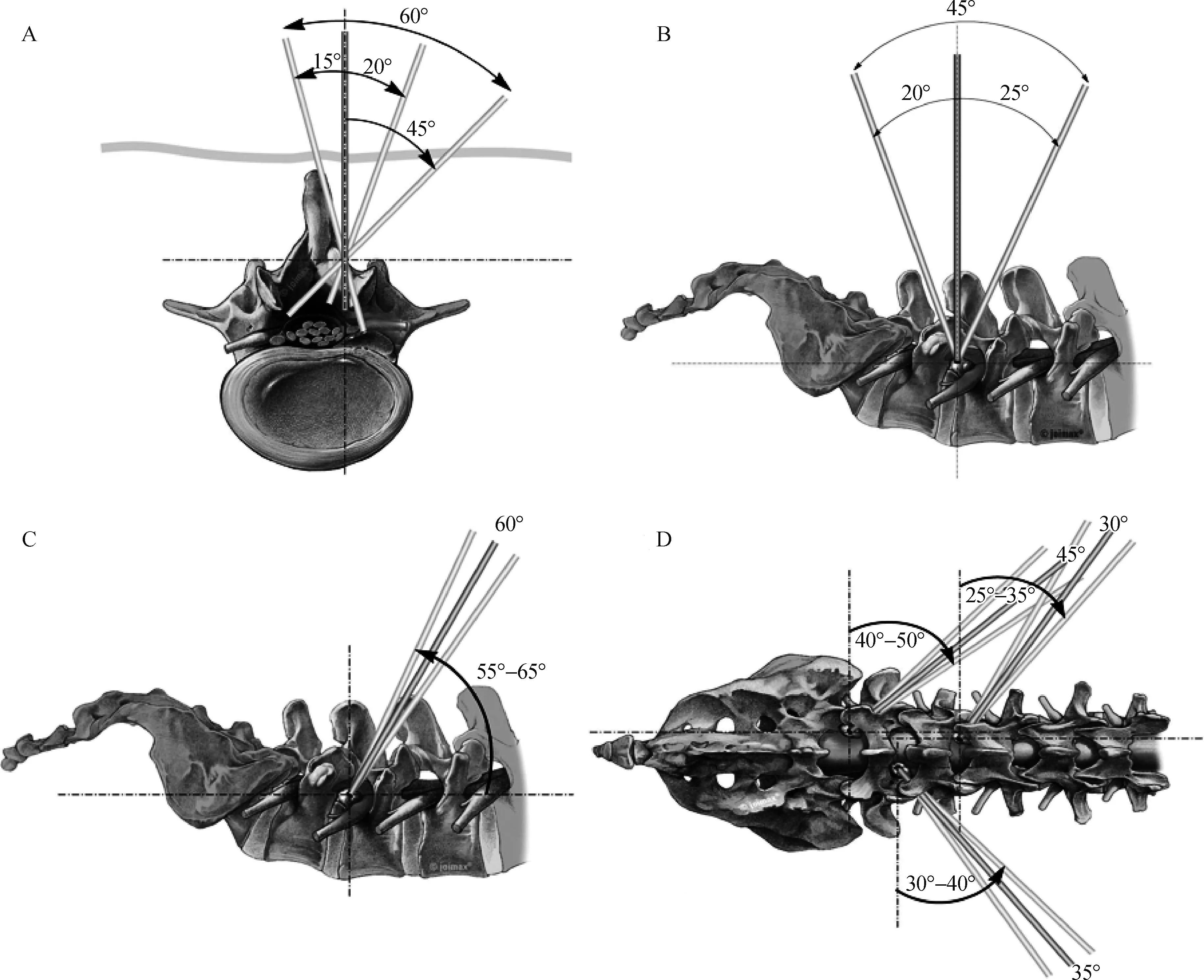
A.椎板间隙入路横断位;B.椎板间隙入路矢状位;C.椎间孔入路矢状位;D.椎间孔入路俯视位
图1椎板间隙入路和椎间孔入路示意图
1.4 术后处理
IL- PELD、TF- PELD组术后处理相同,均嘱多卧床休息,适当双下肢功能锻炼以防止神经根粘连,静脉予消炎止痛、消肿活血、营养神经等治疗,术后约2~3 d带药出院,院外随访。
1.5 观察指标
术中统计手术时长及术中C臂机透视次数;术后第1天、术后3个月分别对患者行腰、腿痛视觉模拟评分(Visual Analogue Scale/Score,VAS)及日本骨科协会评估治疗分数(Japanese Orthopaedic Association Scores,JOA)评分,并将JOA评分与术前相比以计算改善率。改善率=[(治疗后评分-治疗前评分)÷(29-治疗前评分)]×100%。改善率≥75%为优,50%~74%为良,25%~49%为中,0~24%为差。
1.6 统计学处理
2 结 果
2.1 手术情况
IL- PELD组的手术时长和术中透视次数均明显少于TF- PELD组,差异具有统计学意义(P<0.05),见表2。
表2两组患者手术时长和透视次数的比较
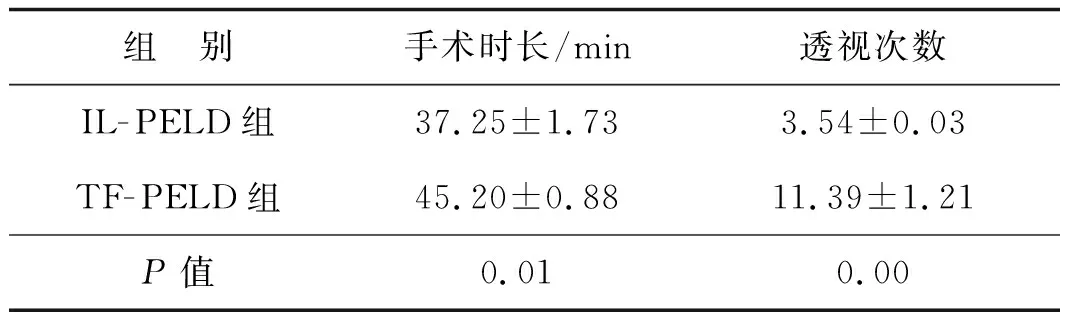
组 别手术时长/min透视次数IL-PELD组37.25±1.733.54±0.03TF-PELD组45.20±0.8811.39±1.21P值0.010.00
2.2 术后腰、腿痛VAS评分
术后IL- PELD组和TF- PELD组患者的腰、腿痛都较术前明显缓解,差异有统计学意义(P<0.05);术后第1天,IL- PELD组患者的腰痛VAS评分低于TF- PELD组,差异具有统计学意义(P<0.05),两组的腿痛VAS评分无明显差异;术后3个月,IL- PELD组患者的腰痛VAS评分仍低于TF- PELD组,差异具有统计学意义(P<0.05),两组的腿痛VAS评分仍无明显差异。见表3。
表3两组患者术后腰、腿痛VAS评分的比较

组 别腰痛VAS评分腿痛VAS评分术前术后第1天术后3个月术前术后第1天术后3个月IL-PELD组4.19±1.122.21±0.62ab0.94±0.97ab6.23±1.811.57±0.89a0.33±1.71aTF-PELD组3.98±0.462.49±0.07a1.21±1.32a6.41±1.771.35±1.49a0.45±1.12a
与术前比较,aP<0.05;与TF- PELD组比较,bP<0.05
2.3 术后JOA评分及改善率
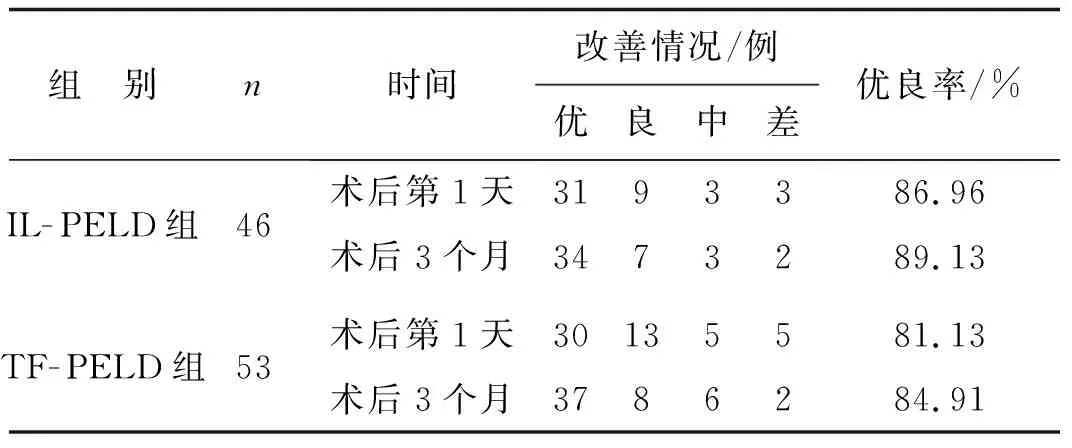
术后IL- PELD组和TF- PELD组患者的JOA评分较术前明显改善,差异具有统计学意义(P<0.05),但两组之间的差异无统计学意义(P>0.05);两种手术均具有较高的优良率,术后第1天和术后3个月两组的优良率比较差异均无统计学意义(P>0.05)。见表4、5。
表4两组患者术后JOA评分的比较
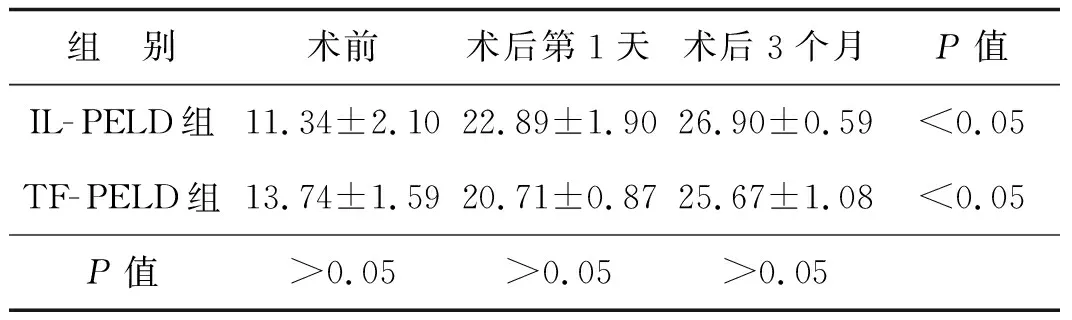
组 别术前术后第1天术后3个月P值IL-PELD组11.34±2.1022.89±1.9026.90±0.59<0.05TF-PELD组13.74±1.5920.71±0.8725.67±1.08<0.05P值>0.05>0.05>0.05
表5两组优良率的比较
组 别n时间改善情况/例优良中差优良率/%IL-PELD组46术后第1天3193386.96术后3个月3473289.13TF-PELD组53术后第1天30135581.13术后3个月3786284.91
注:在术后第1天与术后3个月时,两组的优良率差异均无统计学意义
2.4 两组并发症发生情况
IL- PELD组出现1例脑脊液漏,硬脊膜破口较小,无需修补,患者术后无特殊不适;TF- PELD组中1例患者术后出现踝背伸乏力,考虑为术中腰5神经根损伤引起,继续住院予营养神经、功能锻炼等治疗,出院时稍缓解。
3 讨 论
腰椎疾病的微创治疗一直是脊柱外科医生的热门研究课题,1998年美国Anthony Yeung医生首创YESS技术,2002年德国Hoogland教授在此基础上提出THESSYS技术,成为椎间孔镜发展的标志性事件[7]。近年来,椎间孔镜技术成为治疗腰椎间盘突出症的首选微创方法,其手术适应证不断丰富,手术入路也在多向拓展,逐渐发展出四大入路:椎间孔入路、远外侧或水平入路、后路或椎板间入路以及前入路[8],其中,椎间孔入路适用范围最广,使用次数最多。经椎板间隙入路也已有20余年历史,早在1997年Foley和Smith即已开展经椎板间隙入路显微内窥镜下腰椎间盘切除术(Microendoscopy Discectomy,MED)[9],一度成为治疗腰椎间盘突出症的重要微创技术。后来随着椎间孔镜技术的发展,椎间孔镜器械不断改进,相对于MED操作系统而言,管道更加精细,结构更加优化,操作更加方便[10]。2005年德国的Ruetten医生首次将椎间孔镜器械用于椎板间隙入路,取得满意效果[11],为经椎板间隙治疗腰椎间盘突出症提供了新的思路。
受到椎间盘及临近组织复杂解剖的影响,不同的腰椎节段所适合的手术入路也不尽相同,例如对于L5/S1间隙,患者常伴有肥大的横突或高髂棘,导致经椎间孔入路手术时穿刺置管困难[12],但此节段椎板间隙相对较宽,皮下组织较少,椎板间隙表面只有黄韧带覆盖,通道较易直达椎管[13];而且S1神经根纵行于椎管内,高度游离,穿刺时不易将其损伤[14]。这都为经椎板间隙行髓核摘除术提供了解剖上的可能性。腰椎的椎板间隙从高位至低位逐渐变宽,在俯卧位腰椎前屈的情况下,椎板间隙更加扩张,内窥镜及其套管可以轻易进入L5/S1椎板间隙,而在L4/5及其以上则需磨除部分椎板,造成出血及疼痛[15],因此,椎板间隙技术主要适用于L5/S1节段,与椎间孔入路一同,是内镜下治疗L5/S1腰椎间盘突出症最常用的两种手术入路。
经椎板间隙与经椎间孔这两种手术入路具有一定的相似性,两种入路均可直达神经根与椎管,摘除突出的椎间盘及游离的髓核,实现对神经根的有效减压,明显改善患者的腰、腿痛症状,并具有较满意的优良率。但椎板间隙技术类似MED技术,关键步骤为穿刺进入椎板间隙,打开黄韧带,牵开S1神经根,摘除突出的髓核[16],故只要有丰富的后路开放手术经验,尤其是MED手术经验,多能熟悉其解剖入路,较易入门。而椎间孔技术是经扩大成形的椎间孔直接进入椎管,直视下对神经根和硬膜囊进行充分减压,路径较长且陌生,涉及更多的肌肉、关节、增生的骨质及神经组织,要求更精细化操作,还要求术者拥有一定的空间成像思维。
本研究表明,与椎间孔入路相比,椎板间隙入路的手术时长更短,术中X线透视次数明显减少,避免了患者和手术医师接触过多的射线,这是由于椎板间隙入路操作简单,而经椎间孔入路手术操作相对复杂、步骤更多、准确性要求更高[17]的缘故。椎板间隙入路在缓解患者腰痛这一方面优于椎间孔入路,这主要与经椎板间隙入路路径定位简单、路径较短、损伤较小有关。经椎板间隙入路为后方垂直入路,相对于经椎间孔入路的侧方斜入路,经过的软组织较少,尤其对肌肉的损伤明显降低[18],并且由于定位简单、准确,基本无置管偏离,故无重复置管可能性[19],同样降低了对操作通道周围软组织的损伤,避免了医源性的腰痛;经椎板间隙入路无椎间小关节的阻挡,故无需磨去关节突,不破坏关节囊,避免了医源性的腰椎不稳[20],这也是患者术后腰痛明显低于经椎间孔路径组的原因。本研究中,对经椎板间隙入路组患者施行硬膜外疼痛分离麻醉,保留了患者的下肢运动能力以便监测S1功能,同时消除了局部操作引起的疼痛,降低手术不适感[21],避免患者紧张以致增加手术难度。
经椎板间隙入路行腰椎间盘切除术虽然操作简单、效果明显,但是其并非适用于所有的L5/S1腰椎间盘突出症。术者认为椎板间隙入路更适用于腋下型、游离型椎间盘突出症,尤其是伴有高髂嵴、肥大横突、关节突明显增生等情况而不适合行经椎间孔入路的患者[22],随着操作趋向熟练,可再将适应证拓展至更高难度的椎间盘突出症,如肩上型、腋下型、中央型及复发型[23]。术者发现,若患者的椎板间隙狭窄,术中需磨除部分椎板,虽未破坏关节突,但延长了手术时间,增加了患者的痛苦,也较易引起神经损伤等并发症。部分患者黄韧带肥厚,置管时需要花较长时间摘除黄韧带,同样增加了手术时间,且若黄韧带与前方硬脊膜粘连,容易撕破硬脊膜引起脑脊液漏。部分患者突出的椎间盘明显钙化,此时患者的S1神经根张力较高,强行牵开容易引起患者剧烈疼痛,影响手术进程,也较易引起神经损伤。因此,针对L5/S1椎板间隙狭窄、黄韧带肥厚及髓核明显钙化的患者,应慎重考虑,以免影响手术疗效,甚至增加并发症的发生率[24]。
没有一种入路能够完全解决所有类型的腰椎间盘突出症,椎板间隙技术和椎间孔技术并非完全相互补充或者相互排斥的关系,临床医师应该根据患者髓核的位置、大小及性质、局部解剖特点、患者的要求去选择适宜的手术入路,以提高其治疗的有效率,改善预后。
综上所述,内镜下经椎板间隙腰椎间盘切除术治疗L5/S1腰椎间盘突出症效果明显,可以明显改善患者的腰、腿痛症状,优良率高。

