口腔鳞癌组织LATS2基因启动子甲基化水平及其意义
韦存志,肖世强,王建洪,毛晓斌,陈雷
(宜宾市第一人民医院,四川宜宾644000)
近年研究发现,大肿瘤抑制因子2(LATS2)表达受抑可能与癌症的发生、发展密切相关[1,2]。口腔鳞状细胞癌(口腔鳞癌)组织中LATS2基因表达明显下调或基因失活,但其具体原因尚不清楚[3]。DNA甲基化是指在甲基转移酶的催化下,DNA C、G两个核苷酸的胞嘧啶被选择性地添加甲基,形成5-甲基胞嘧啶。DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,可导致肿瘤的发生及发展。LATS2基因启动子区高甲基化可导致LATS2基因失活,进而导致肿瘤发生[4]。本研究探讨LATS2基因启动子甲基化在口腔鳞癌发生、发展中的作用。现报告如下。
1 临床资料
选取2013年2月~2017年8月宜宾市第一人民医院收治的口腔鳞癌患者108例,男63例、女45例,年龄27~84(59.6±10.3)岁,均行手术切除肿瘤,术后病理检查证实诊断。肿瘤临床分期(2002年国际抗癌联盟TNM分期标准):Ⅰ、Ⅱ期59例,Ⅲ、Ⅳ期49例;组织分级:Ⅰ级51例,Ⅱ级33例,Ⅲ级24例;有淋巴结转移45例,无淋巴结转移63例。所有患者术前未行放疗或化疗,相关临床病理资料完整。本研究经宜宾市第一人民医院医学伦理委员会批准,患者或其家属均知情同意。
2 方法与结果

2.2 口腔鳞癌组织及癌旁正常组织LATS2 mRNA表达检测 采用RT-PCR法。取108例患者手术切除的口腔鳞癌组织及其中45例患者癌旁正常组织。采用TRIzol法提取组织总RNA,逆转录为cDNA,采用ABI Fast7500荧光定量PCR仪进行PCR扩增。引物序列:LATS2上游引物5′-GCTTCATCCACCGAGACATCAA-3′,下游引物5′-CGACAGTTAGACACATCATCCCAGA-3′;GAPDH上游引物5′-CCCCTTCATTGACCTCAACTACAT-3′,下游引物5′-CGCTCCTGGAAGATGGTGA-3′。根据PCR扩增试剂盒说明配制反应体系。反应条件:50 ℃ 2 min,95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。采用2-ΔΔCt法计算LATS2 mRNA相对表达量。PCR扩增产物进行琼脂糖凝胶电泳观察,出现LATS2条带判定为LATS2 mRNA阳性表达,未出现此条带即为LATS2 mRNA表达缺失。结果显示,口腔鳞癌组织及癌旁正常组织LATS2 mRNA阳性表达率分别为47.22%(45/108)、100%(45/45),LATS2 mRNA相对表达量分别为0.32±0.04、1.01±0.08,二者比较P均<0.05。
2.3 口腔鳞癌组织LATS2基因启动子甲基化检测 采用特异性PCR(MSP)法。参照文献[5]方法进行模板DNA提取及硫化修饰。MSP亚硫酸氢盐修饰DNA分别经甲基化与非甲基化引物扩增。引物序列:甲基化上游引物5′-TTTAAAGATCGAAACGAGGGAGCG-3′,下游引物5′-CCCAACGAAAAAACCCGACTAACG-3′;非甲基化上游引物5′-TTTTTTAAAGATTGAAATGAGGGAGTG-3′,下游引物5′-AAACCCAACAAAAAAACCCAACTAACA-3′。根据PCR扩增试剂盒说明配制反应体系。反应条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,共30个循环;最后72 ℃延伸7 min。PCR产物于2%琼脂糖凝胶电泳观察。结果判断标准[6]:仅扩增出甲基化产物特异性条带,判定为完全甲基化;仅扩增出非甲基化特异性条带,判定为完全非甲基化;同时扩增出甲基化和非甲基化特异性条带,判定为部分甲基化。完全甲基化和部分甲基化均判定为甲基化。结果显示,口腔鳞癌组织LATS2基因启动子完全甲基化率高于癌旁正常组织,完全非甲基化率低于癌旁正常组织,二者比较P均<0.05。见表1。

表1 口腔鳞癌组织及其癌旁正常组织LATS2基因启动子甲基化情况比较[例(%)]
注:与癌旁正常组织比较,*P<0.05。
2.4 口腔鳞癌组织LATS2基因启动子甲基化与患者临床病理参数的关系 见表2。
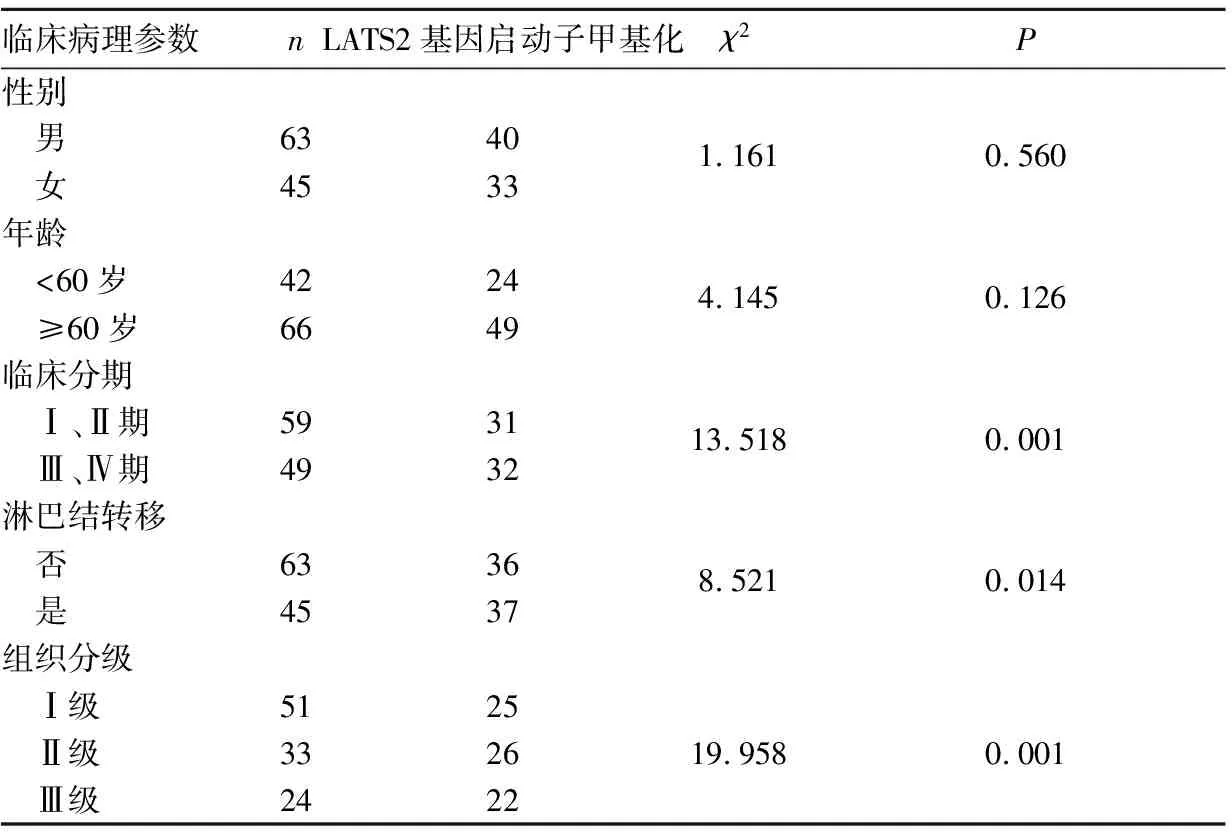
表2 口腔鳞癌组织LATS2基因启动子甲基化与患者临床病理参数的关系(例)
2.5 口腔鳞癌组织LATS2基因启动子甲基化与其mRNA表达的关系 57例LATS2基因表达缺失的口腔鳞癌组织中,51例出现LATS2基因启动子甲基化;51例有LATS2基因表达的口腔鳞癌组织中,22例出现LATS2基因启动子甲基化。相关分析显示,口腔鳞癌组织LATS2基因启动子甲基化与LATS2 mRNA表达呈负相关关系(r=-0.734,P<0.01)。
3 讨论
LATS2定位于13q11-12,参与细胞微管蛋白和纺锤体形成,调控细胞周期,可通过多条信号通路参与抑制恶性肿瘤细胞增殖及凋亡[7,8]。在多种肿瘤中发现LATS2基因转录和翻译异常,且其表达与肿瘤的恶性程度呈负相关关系[9,10]。陶峰等[11]研究发现,宫颈鳞癌组织LATS2表达显著低于癌旁正常组织,LATS2表达降低与肿瘤大小及有无淋巴结转移明显相关。雷静等[12]研究发现,LATS2基因在上皮性卵巢癌组织中的表达量显著低于良性卵巢肿瘤组织和正常卵巢组织,且与组织分化程度及有无淋巴转移相关。本研究结果显示,口腔鳞癌组织LATS2 mRNA表达显著低于癌旁正常组织,与上述文献报道一致,说明LATS2基因表达受到抑制与口腔鳞癌的发生、发展有关。
在肿瘤表观遗传学研究中,以对DNA甲基化的研究最为深入。抑癌基因启动子高甲基化将导致抑癌基因沉默及转录抑制,进而促进肿瘤的发生[13]。抑癌基因DNA甲基化作为某些恶性肿瘤的分子诊断标志物,其敏感性和可操作性均优于目前的分子生物标志物。近年研究发现,口腔鳞癌患者存在某些抑癌基因异常甲基化现象[14]。Jiang等[15]对星形胶质细胞瘤研究发现,LATS2基因启动子甲基化可导致LATS2基因表达下调。本研究结果显示,口腔鳞癌组织LATS2基因启动子区甲基化发生率明显高于癌旁正常组织,且LATS2基因启动子甲基化与LATS2 mRNA表达呈负相关关系。提示LATS2基因启动子甲基化致其基因表达受到抑制在口腔鳞癌患者中是一个高发现象,可能是口腔鳞癌的发病机制之一。本研究结果显示,临床分期高、组织分级低、有淋巴转移的口腔鳞癌患者LATS2基因启动子甲基化发生率更高;说明LATS2基因甲基化频率越高,肿瘤恶性程度越高,发生侵袭和转移的概率越大。有研究表明,LATS2基因可下调抗凋亡蛋白Bcl-2和Bcl-x从而激活凋亡蛋白酶9,促进细胞凋亡[16];LATS2基因可直接或间接抑制细胞周期蛋白依赖性激酶2,促使细胞周期停滞在G1/S期,抑制细胞增殖[17]。LATS2基因发生启动子高度甲基化可能通过以上相关分子机制促进口腔鳞癌的发生、发展,这有待于进一步研究证实。
综上所述,LATS2基因启动子甲基化可通过下调LATS基因表达促进口腔鳞癌的发生、发展。

