肝细胞癌组织核因子E2相关因子3表达变化及意义
王振伟,陶佳,郝帅,晏亭,杨玉菡,刘虹邑,任勇刚
(1 川北医学院,四川南充637000;2 川北医学院附属医院)
肝细胞癌是起源于肝细胞的恶性肿瘤,其发生、发展是一个漫长的过程,涉及转录调控、遗传学及肿瘤免疫学等[1,2]。与肝细胞癌发生最相关的遗传学因素包括宿主细胞p53、Ras、Rb等基因突变,但与肝细胞癌发生相关的特异性基因尚未明确[3,4]。核因子E2相关因子3(NFE2L3)属于CNC碱性亮氨酸拉链蛋白家族,又称Nrf3,定位于染色体7p15.2,编码694个氨基酸,其生物学功能尚未阐明[5~7]。目前鲜见关于NFE2L3与肝细胞癌有关的报道。本研究探讨肝细胞癌组织NFE2L3表达变化及意义。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选取2016年10月~2017年9月川北医学院附属医院收治的肝细胞癌患者44例,男34例、女10例,年龄43~70(55.24±8.03)岁;组织分化程度:低分化23例,中分化12例,高分化9例;合并肝硬化27例,乙肝36例;TNM分期:Ⅰ、Ⅱ期31例,Ⅲ、Ⅳ期13例;Child-Pugh肝功能分级:A级25例,B、C级19例。肝细胞癌诊断符合《原发性肝癌诊疗规范(2011年版)》中肝癌诊断标准,TNM分期符合美国癌症联合会和国际抗癌联盟标准。纳入标准:经组织病理学检查及血清标志物检测明确诊断为肝细胞癌;除肝细胞癌外无其他恶性肿瘤;手术切除肿瘤,术中留取癌旁正常组织;术前未进行放疗、化疗及免疫治疗;临床病理资料完整。本研究经川北医学院附属医院医学伦理委员会批准,患者或其家属均知情同意。
1.2 肝组织NFE2L3表达检测 采用免疫组化两步法。取肝癌组织及癌旁正常组织,石蜡包块,3~5 μm厚连续切片。石蜡切片常规脱蜡、水化,加入3%过氧化氢50 μL,室温孵育10 min;浸于柠檬酸盐缓冲液修复组织抗原30 min;滴加5% BSA封闭液,室温孵育10 min,弃去多余液体;滴加NFE2L3一抗(工作液浓度1∶25,美国ABGENT公司),37 ℃孵育3~4 h;滴加聚合HRP标记抗兔IgG,37 ℃孵育30 min;DAB显色,蒸馏水冲洗,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。以PBS代替NFE2L3一抗作为阴性对照,阳性对照为已知NFE2L3蛋白阳性表达的组织切片。NFE2L3阳性表达主要定位于细胞质,在细胞核也有表达,呈散在分布的淡黄色或棕黄色颗粒。根据染色强度及阳性细胞所占比例综合评分判定结果[8]。阳性细胞染色强度为不着色、淡黄色、黄色、棕黄色分别记0、1、2、3分;阳性细胞所占比例<10%记0分,10%~<25%记1分, 25%~<50%记2分, 50%~<75%记3分,≥75%记4分。两项评分之和>4分为NFE2L3阳性表达。分析肝癌组织NFE2L3阳性表达与患者临床病理参数的关系。
1.3 癌症基因组图谱(TCGA)数据分析 下载TCGA数据库(https://tcga-data.nci.nih.gov/)中关于肝细胞癌的RNASeq Version2数据(Level 3,normalizeddata)。肝细胞癌数据集共包括371例份肝细胞癌组织和51例份癌旁正常组织。测序平台为Illumina hiseq2000,数据下载时间为2017年8月。利用R(Version3.4.0)软件包limma提供的经验贝叶斯方法对基因表达值进行线性建模[9],然后进行肝癌组织与癌旁正常组织NFE2L3表达的差异分析。检验后得到NFE2L3平均表达值(AveExpr)、肝癌组织与癌旁正常组织差异表达倍数(log2FC),相应统计学差异分析的P,使用Benjamini & Hochberg方法进行多重检验校正,得到校正后P(adj.P)。差异表达阈值均为adj.P<0.05且|log2FC|>1(即2倍变化)。
1.4 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织和癌旁正常组织NFE2L3表达比较 肝癌组织NFE2L3阳性表达率为70.45%(31/44),癌旁正常组织为15.91%(7/44),二者比较P<0.05。
2.2 肝癌组织NFE2L3阳性表达与患者临床病理参数的关系 肝癌组织NFE2L3阳性表达与肿瘤组织分化程度、患者是否合并乙肝有关(P均<0.01),与患者性别、年龄、是否合并肝硬化、TNM分期、肝功能分级无关(P均>0.05)。见表1。
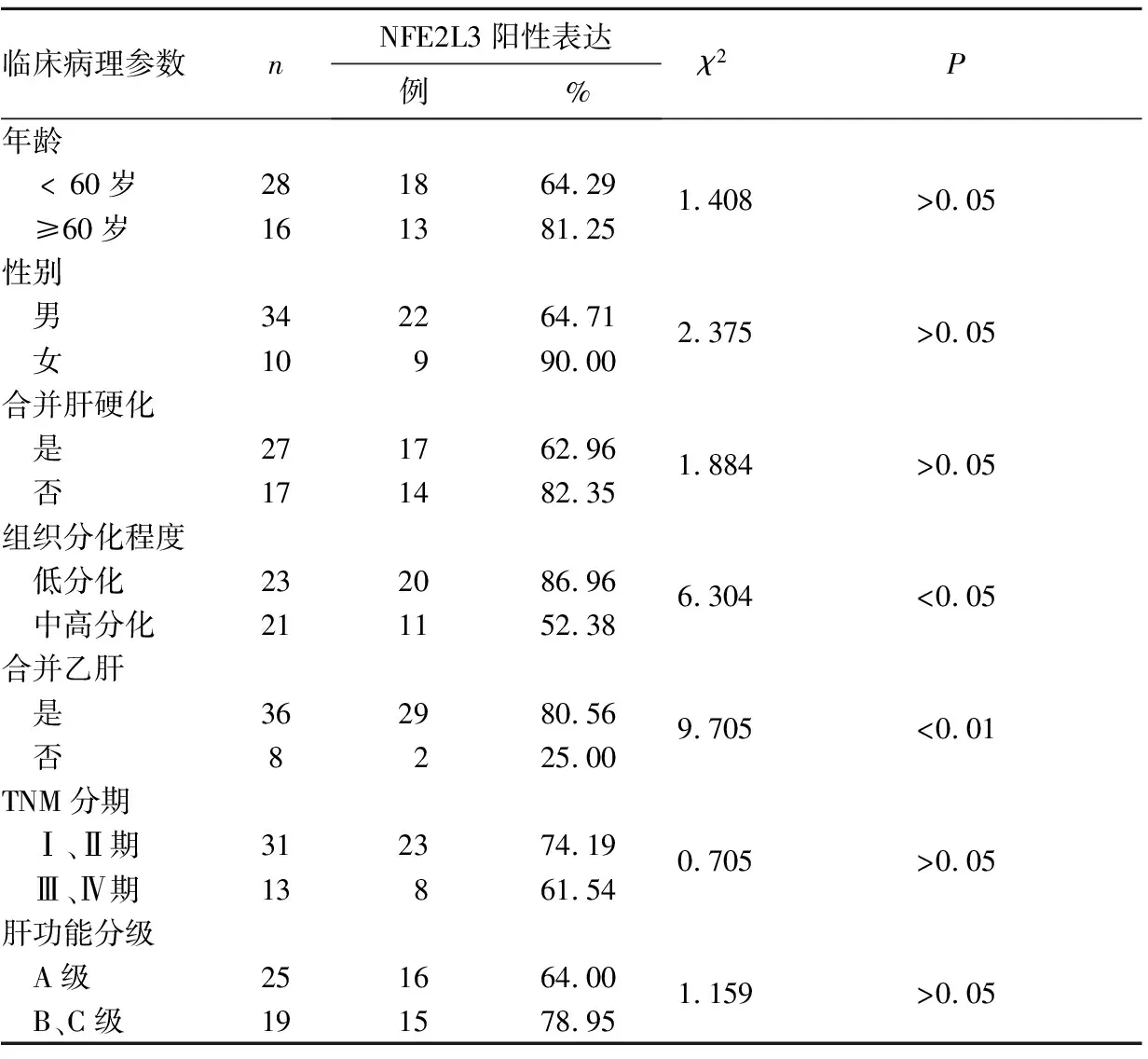
表1 肝癌组织NFE2L3阳性表达与患者临床病理参数的关系
2.3 TCGA数据库肝细胞癌数据集中肝癌组织和癌旁正常组织NFE2L3表达比较 肝癌组织NFE2L3表达显著高于癌旁正常组织,log2FC=0.750 121 651,AveExpr=2.336 727 847,P<0.01,adj.P<0.01。
3 讨论
肝细胞癌多呈低分化,侵袭和转移能力强,复发率和病死率均较高[10]。核因子E2(NFE2)家族为高度保守的调节性转录因子家族,主要参与维持细胞稳态和组织发育[11]。NFE2家族主要包括NFE2L1、NFE2L2、NFE2L3、NF-E2 p45及其转录抑制因子Bach1、Bach2[12]。目前,关于抗氧化基因转录调控的研究多集中于NFE2L2及NFE2L1。当出现病毒感染、外源性药物、炎症等刺激时,机体内氧化还原稳态被打破,诱导激活NFE2成员,调节NAD(P)H醌脱氢酶1基因表达[13,14]。通常情况下,NFE2蛋白与Maf蛋白结合组成二聚体,通过抗氧化应激元件结合于靶基因启动子,调节下游基因表达。NFE2家族成员在调节胚胎发育中扮演重要角色,尤其是NFE2L1[15]。Xu等[16]研究发现,成年小鼠肝细胞NFE2L1基因被敲除后易形成脂肪肝并有可能恶变为肝癌。进一步研究证实,相对于高分化肝癌组织,低分化肝癌组织NFE2L1表达显著降低,并扮演抑癌基因角色;NFE2L1可能通过促进细胞上皮间质转化,参与肝癌的发生和进展[17]。此外,NFE2家族在非酒精性脂肪肝病的发生及进展中也发挥重要作用,其作用机制主要包括影响胰岛素耐受、调节氧化应激和刺激脂质过氧化反应等[18~21]。
NFE2L3广泛表达于人体组织器官,其作为一种高度保守的调节性转录因子,通过结合抗氧化反应元件和亲电子体反应元件,调控下游基因表达,维持细胞稳态。与同源的NFE2L1、NFE2L2相比,目前对NFE2L3功能的研究相对较少。Sankaranarayanan等[22]报道,NFE2L3通过抑制细胞黏附,促进紫外线诱导的角质形成细胞凋亡。Chowdhury等[23]研究则证实,NFE2L3通过作用于蛋白酶体等调节肿瘤细胞增殖。最近的研究结果显示,NFE2L3的结构修饰和区域改变对调控细胞分化、炎症反应和细胞癌变具有重要意义[24],但其具体的分子机制仍不清楚。
本研究结果显示,肝癌组织NFE2L3阳性表达率显著高于癌旁正常组织,提示NFE2L3可能作为促癌基因直接或间接作用促进肝癌的发生。但有研究报道,NFE2L3对人大肠癌LoVo细胞增殖具有一定抑制作用,其可能作为抑癌基因参与大肠癌的发生[25,26],与本研究结果矛盾,其原因可能为NFE2L3在肝细胞癌和结直肠癌组织中的基础表达有一定差异,故其生物学功能不同。本研究肝癌组织NFE2L3阳性表达与肿瘤组织分化程度有关,低分化肝癌组织NFE2L3阳性表达显著高于中高分化组织,提示NFE2L3可能是一个与肝癌侵袭和转移相关的潜在生物标记分子。本研究肝癌组织NFE2L3阳性表达与肿瘤TNM分期、肝功能分级无关,可能与样本量偏少有关。NFE2L3阳性表达与肝癌患者是否合并乙肝显著相关,但与是否合并肝硬化无明显相关。乙型肝炎病毒(HBV)感染是肝细胞癌发生的病因之一。HBV能够在宿主细胞内持续存在,并协同遗传学及表观遗传学改变,共同调控参与肝细胞癌发生的信号通路[27]。HBV的HBX基因被认为不能直接与DNA结合,而是通过与转录因子、信号分子等因子相互作用直接或间接发挥调控功能[28]。已有研究证实,HBX基因能够反式激活宿主细胞基因,促进血管内皮生长因子、Myc原癌基因等生长因子及原癌基因表达[29]。在应激刺激下,HBV可通过调节NFE2L3表达,介导下游促炎、抗炎信号通路,调控细胞增殖、凋亡等相关基因表达,促进乙肝向肝癌恶性转化。本研究发现,NFE2L3阳性表达与患者是否合并肝硬化并无显著相关,这可能是由于肝硬化病因广泛,既可能是HBV感染引起的,也可能是长时间饮酒或代谢性异常引起的。肝硬化与肝细胞癌的确切关系还有赖于后期扩大样本、完善分组并结合细胞、动物模型进一步明确。
为进一步验证临床病例研究结果,明确NFE2L3在肝癌组织和癌旁正常组织中的差异表达,本研究利用生物信息学方法分析了TCGA数据库收集的肝细胞癌数据集。统计分析结果显示,NFE2L3基因在肝癌组织中的表达显著高于癌旁正常组织,但其差异表达倍数log2FC较小,AveExpr为2.336 727 847,P<0.01。以上分析结果与本研究检测结果一致,进一步在大范围样本中确认转录因子NFE2L3在肝癌组织中高表达,并与肝细胞癌的发生、发展密切相关,可能是肝细胞癌发生的一种促癌因子。
综上所述,NFE2L3可能作为促癌因子参与肝细胞癌的发生、发展。

