核转录因子NF-E2相关因子2信号通路在PM2.5致雌性大鼠生殖损伤中的作用
张丰泉,赵杉,董恩恒*,曹锦程,郭旭东
(1. 新乡医学院 公共卫生学院 新乡市大气污染健康效应与干预重点实验室,新乡 453000; 2. 新乡医学院 基础医学院分析测试实验室,新乡 453000)
目前空气污染已被证实是威胁人体健康重要危险因素之一, 2012年全球有约300万人死于空气污染相关疾病[1]。颗粒物是空气污染物的重要组成部分,研究发现细颗粒物(空气动力学直径≤10 μm)对人体具有更强的危害性[2]。
已有研究证实,PM2.5是心血管系统疾病和呼吸系统疾病的危险因素。虽然目前还不能明确PM2.5对生殖系统的危害性,但越来越多的研究结果显示PM2.5可能是影响生殖系统的重要环境因素之一。过往流行病学调查发现,当孕期PM2.5暴露浓度增加10 μg/m3时,胎儿出现早产(OR=1.10;95% CI, 1.03-1.18)、低出生体重(OR)=1.05;95%CI, 1.02-1.07)和小于胎龄儿(OR=1.15;95% CI, 1.10-1.20)的危险性明显升高[3]。我们前期研究结果显示,PM2.5不仅影响雌鼠的内分泌水平,而且可使胎鼠的活胎率明显降低[4];同时PM2.5可破坏子宫的组织结构,使子宫内膜上皮细胞变薄,排列混乱;固有层的基质细胞数量和血管数量也减少[5]。目前PM2.5对生殖系统损伤的研究还比较有限,且PM2.5生殖毒性作用机制不明确。Nrf-2信号通路是机体内重要的防御反应性系统,当机体受有害因素胁迫时可活化Nrf-2,增加Nrf-2蛋白的表达,进而激活其下游的功能性蛋白如HO-1,发挥抗炎症反应和抗氧化应激反应的作用,对机体具有重要的保护作用。本研究拟将雌性大鼠暴露PM2.5,研究Nrf-2信号通路在PM2.5致雌性大鼠生殖损伤中的作用和机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组
清洁级8周龄雌性SD大鼠30只,体重180~200 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】,饲养于河南省生物精神病学重点实验室【SYXK(豫)2014-0005】。适应性喂养1周,采用随机数字法将实验动物分为:生理盐水对照组(control group, control)、1.5 mg/kg PM2.5低剂量暴露组(Low dose exposure group, low Exp)和37.5 mg/kg PM2.5高剂量暴露组(high dose exposure group, high exp)[6]。
1.1.2 试剂与仪器
TNF-α和IL-1βELLISA试剂盒购于Abcam公司,IL-6 ELLISA试剂盒和TRIzol试剂盒购于Invitrogen公司,Nrf-2和HO-1一抗购于Abcam公司,荧光定量PCR仪(AB 7500,美国),酶标仪(Enspire,美国PerkinElmer),凝胶成像系统(FluorChem R,美国ProteinSimple)。
1.2 实验方法
1.2.1 PM2.5染毒
将本实验室制备的不同浓度PM2.5悬液(浓度分别为2和50 mg/mL)复温后,按照晋乐飞等[7]的实验方法对雌鼠PM2.5染毒暴露。雌鼠麻醉后,将75 μL/100 (g·bw)颗粒物悬液注入雌鼠舌根部,迫使其将PM2.5悬液经过口腔吸入肺内。连续染毒10 d。
1.2.2 子宫组织TNF-α、IL-1β和IL-6含量测定
冰浴研磨制备子宫组织匀浆液,取上清液测定子宫组织中炎性因子含量。用TNF-α、IL-1β和IL-6 ELISA试剂盒检测子宫组织上清中TNF-α、IL-1β和IL-6含量。按照各试剂盒说明制备标准品和样品,酶标仪于450 nm检测标准品孔和样品孔吸光值,分别绘制TNF-α、IL-1β和IL-6标准曲线并计算样品中TNF-α、IL-1β和IL-6的含量。
1.2.3 子宫组织中Nrf-2和HO-1 mRNA表达检测
按照TRIzol试剂盒说明提取子宫组织总RNA,并反转录合成cDNA。qPCR检测Nrf-2和HO-1 mRNA表达水平。目的基因序列:Nrf-2 上游引物:5’- CTCTCTGGAGACGGCCATGACT -3’,下游引物:5’- CTGGGCTGGGGACAGTGGTAGT-3’;HO-1上游引物:5’- CGTGCAGAGAATTCTGAGTTC-3’, 下游引物:5’- AGACGCTTTACGTAGTGCTG-3’;β-actin CGTGCGTGACATTAAAGAG-3’,下游引物:5’-TTGCCGATAGTGATGACCT-3’。 扩增反应条件:95℃ 3 min,95℃ 30 s,57℃ 30 s,40个循环。用2-△△CT值计算目的基因相对表达量。
1.2.4 子宫组织中Nrf-2和HO-1蛋白表达检测
研磨并提取子宫组织总蛋白,取蛋白样品,聚丙烯酰胺凝胶电泳后,转膜至PVDF膜上,封闭1.5 h,Nrf-2一抗(1∶500)、HO-1一抗(1∶300)、β-actin一抗(1∶3000)4℃过夜孵育,洗膜后加入二抗(1∶4000),室温孵育1 h,ECL发光,凝胶成像系统成像分析。
1.3 统计学方法

2 结果
2.1 子宫组织中炎性因子含量
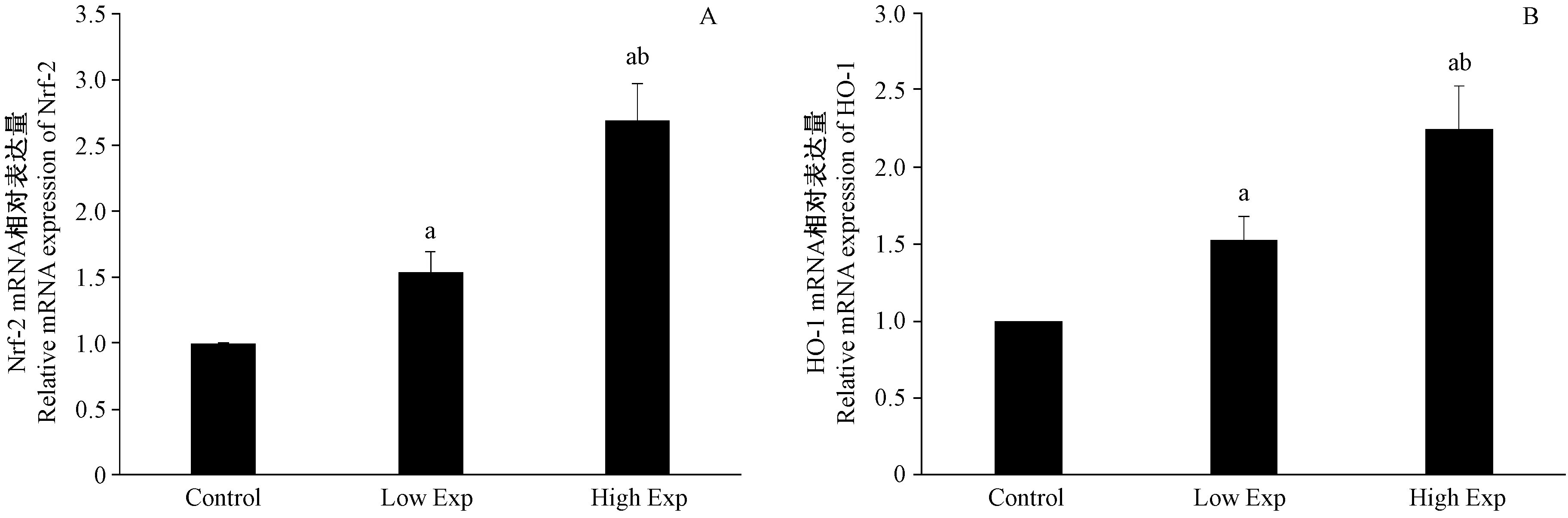
注: A为Nrf-2 mRNA的相对表达量;B为HO-1 mRNA的相对表达量。aP<0.05 VS Control;bP<0.05 VS Low Exp。图1 PM2.5对子宫Nrf-2和HO-1 mRNA表达水平的影响Note. Relative mRNA expressions of Nrf-2 and HO-1(A and B); aP<0.05 VS control; bP<0.05 VS Low Exp.Figure 1 Effects of particulate matter 2.5 (PM2.5)on mRNA expression of NF-E2 related factor 2 (Nrf-2) and heme oxygenase-1 (HO-1) in the rat uterus
对照组子宫TNF-a的含量为(78.67±17.55) pg/(mg·prot),低剂量组子宫TNF-a的含量为(112.87±26.76)pg/(mg·prot),与对照组相比,低剂量组子宫TNF-a含量明显升高(P=0.024);高剂量组子宫TNF-a的含量为(269.23±31.36) pg/(mg·prot),也明显高于对照组(P=0.000)。另外高剂量组TNF-a含量明显高于低剂量组(P=0.000)。低剂量组和高剂量组子宫IL-1β含量分别为(96.04±22.29)pg/(mg·prot)和(204.21±24.1)pg/(mg·prot),均明显高于对照组,差异有显著性(P=0.003和0.000);与低剂量组相比,高剂量组子宫IL-1β含量明显升高(P=0.000)。与对照组相比,低剂量组(102.71±22.23)pg/(mg·prot)和高剂量组(184.47±26.24)pg/(mg·prot)子宫IL-6含量均明显升高(P=0.001和0.000);与低剂量组相比,高剂量组子宫IL-6含量明显升高(P=0.000)(见表1)。
子宫组织中炎性因子含量与PM2.5浓度呈剂量效应关系,随着PM2.5暴露浓度的升高,TNF-a、IL-1β和IL-6不断升高(r=0.870、0.847和0.855)。
2.2 子宫组织Nrf-2和HO-1 mRNA表达水平
Nrf-2和HO-1 mRNA相对表达量(与内参基因的相对表达量)见图1。PM2.5低剂量组和高剂量组子宫组织Nrf-2 mRNA的相对表达量分别为(1.54±0.16)和(2.69±0.28),均显著高于生理盐水对照组,差异有显著性(P=0.000和0.000);与PM2.5低剂量组相比,高剂量组Nrf-2 mRNA表达量显著高于低剂量组(P=0.000)。
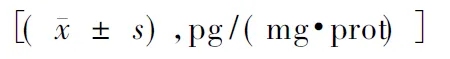
表1 PM2.5对子宫组织中炎性因子含量的影响Table 1 Effects of particulate matter 2.5 (PM2.5) on the expression of tumor necrosis factor-α (TNF-α), interleukin 1 beta (IL-1β), and interleukin-6 (IL-6)
注:aP<0.05 VS control;bP<0.05 VS Low Exp。
Note.aP<0.05 VS control;bP<0.05 VS Low Exp.
三组间子宫中HO-1mRNA表达量的变化与Nrf-2 mRNA的变化情况相一致。与对照组相比,PM2.5低剂量组和高剂量组子宫HO-1 mRNA表达水平显著升高(P=0.045和0.000);与低剂量组相比,高剂量组子宫HO-1 mRNA表达量显著高于低剂量组(P=0.008)。
2.3 子宫组织Nrf-2和HO-1 蛋白表达水平
对照组、低剂量组和高剂量组大鼠子宫Nrf-2蛋白和HO-1蛋白的相对表达量见图2。与对照组相比,低剂量组和高剂量组子宫Nrf-2蛋白(P=0.011和0.000)和HO-1蛋白(P=0.000和0.000)的相对表达量均明显升高。高剂量组子宫Nfr-2的表达量虽高于低剂量组,但差异无显著性(P=0.051)。与低剂量组相比,高剂量组子宫HO-1蛋白相对表达量明显高于低剂量组子宫HO-1蛋白表达量(P=0.037)。
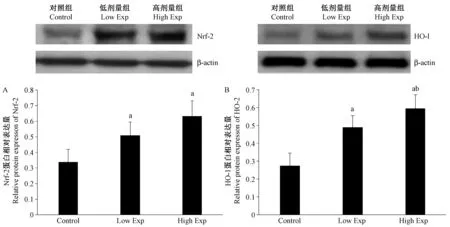
注: A为Nrf-2 蛋白的相对表达量;B为HO-1 蛋白的相对表达量。aP<0.05 VS Control;bP<0.05 VS Low Exp。图2 PM2.5对子宫Nrf-2和HO-1 蛋白表达水平的影响Note. Relative protein expressions of Nrf-2 and HO-1(A and B); aP<0.05 VS control; bP<0.05 VS Low Exp.Figure 2 Effects of PM2.5 on the protein expressions of Nrf-2 and HO-1 in the rat uterus tissue
3 讨论
最新的研究报告指出如不改善空气质量,到2050年时每年因空气污染造成的死亡人数将增加到660万人[8]。目前已有很多关于妊娠期暴露空气污染物与妊娠结局相关性的流行病学调查研究。Kingsley等[8]的调查发现孕妇暴露于低浓度的PM2.5(2.5 μg/m3)时,发生早产的危险性升高1.04倍,且新生儿的体重平均减少15.9 g。加拿大一项关于81.84万孕妇的调查中发现,当孕妇PM2.5暴露浓度仅增加2 μg/m3时,发生早产的可能性增加4%,另外如果孕妇伴有糖尿病、先兆子痫时会使早产的危险性分别增加10.6%和8.3%[9],由此可见当孕妇暴露于PM2.5并伴有其他基础性疾病时,其出现不良妊娠结局的危险性明显增加。另有研究发现,妊娠期及新生儿出生后暴露PM2.5可显著升高新生儿的死亡率,新生儿死亡危险性增加2.66倍[10]。但Kingsley等[8]的研究发现,妊娠期暴露PM2.5虽可降低新生儿体重,但与早产没有明显的相关性(OR=0.86)。这些研究结果不一致性的原因可能与PM2.5暴露时长、浓度和颗粒物所含成分以及所采用调查方法、统计分析方法不同有关。虽然研究结果有不一致性,但更多的研究结果证实PM2.5是影响生殖系统的重要环境因素之一。
PM2.5对人体损伤作用机制主要包括氧化应激反应、炎症反应、凝血功能异常。已有研究发现颗粒物可诱发呼吸、心血管等系统中炎性因子明显升高,诱发炎症反应[11-12],由此可见炎症反应在颗粒物心肺系统损伤中起重要作用。Michikawa等[13]的研究结果证实,妊娠早期暴露颗粒物可以影响子宫发育和胎盘的植入,但未对PM2.5生殖损伤的发生机制做进行进一步的研究。氧化应激和炎性反应密切相关,氧化应激可触发多种调控细胞内炎性因子的信号通路,诱发炎症反应。我们前期的研究结果已证实PM2.5能够损伤子宫组织结构,并诱发子宫氧化应激反应[5]。本次研究中子宫组织炎性因子TNF-α、IL-1β和IL-6含量检测结果显示,暴露PM2.5后子宫组织中的TNF-α、IL-1β和IL-6含量均明显高于对照组,PM2.5可诱发子宫组织中炎性因子的释放。PM2.5暴露组子宫组织TNF-α、IL-1β和IL-6含量明显高于对照组,由此可见PM2.5能够诱发子宫炎症,且随着暴露PM2.5浓度的增加,子宫组织中TNF-α、IL-1β和IL-6含量不断升高(结果见表1),PM2.5暴露与炎性因子释放量呈明显的正相关,这一结果与已有PM2.5诱发心肺循环系统炎症反应的结果相一致[14]。由此我们推测PM2.5对生殖系统的损伤与其诱发的子宫炎症反应有关。
为研究PM2.5诱发炎症的机制,本次实验中我们检测了Nrf-2信号通路的相关因子。Nrf-2通路是机体重要的防御系统。Nrf-2是机体氧化应激和炎症反应中的关键的防御性转录因子,具有重要的抗氧化、抗炎症、免疫调节作用[15]。当机体受到外界胁迫时,Nrf2磷酸化与抗氧化反应元件(antioxidant response element,ARE)结合,进而激活下游的Ⅱ相酶(如HO-1、GST等),从而发挥抗炎和抗氧化作用。HO-1是重要的Ⅱ相酶之一,在机体内发挥抗炎性反应和抗氧化损伤作用[16]。本次实验结果显示,当雌鼠暴露PM2.510 d后,暴露组雌鼠子宫组织中Nrf-2和HO-1在mRNA和蛋白水平均明显高于对照组(结果见图1和2),由此可推断PM2.5可激活Nrf-2及其下游重要的功能蛋白HO-1,使Nrf-2和HO-1表达升高,抵抗PM2.5对子宫的损伤作用。但本次实验中子宫中炎性因子TNF-α、IL-1β和IL-6的含量却因PM2.5暴露而显著升高;且随着暴露剂量的增加,子宫炎性因子含量不断升高,进而破坏子宫的组织结构。造成这种结果的原因可能是,PM2.5虽然激活了Nrf-2信号通路,对PM2.5的损伤起到一定的拮抗和保护作用,但其保护作用不足以完全抵消PM2.5诱发的炎症损伤作用,而最终造成子宫组织损伤。
综合本次实验研究的结果,我们推测雌鼠暴露PM2.5后,虽然体内的Nrf-2信号通路可被激活,Nrf-2和其下游的效应因子HO-1蛋白的表达升高,但其保护作用不足以完全抵消PM2.5的子宫的炎症损伤作用,而最终造成子宫组织造成损伤。在后续的研究中需设法特异性提高Nrf-2信号通路中关键蛋白的表达量,从而降低或消除PM2.5对生殖系统的损伤作用。

