慢性阻塞性肺病急性加重期治疗前后肺泡灌洗液中皮质抑素的变化及意义
施维 马升俊 邝敏
(广西医科大学第三附属医院<南宁市第二人民医院>呼吸内科 广西 南宁 530031)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是呼吸系统常见的疾病,其本质为持续气道慢性炎症,在COPD的发生发展中起了重要作用,但其确切发病机制仍不十分清楚[1]。慢性阻塞性肺病的炎症过程和各类炎症介质和细胞因子的释放,炎性因子相互促进、炎症反应逐级放大,最终导致气道炎症的不可逆性损伤。糖皮质激素对该病的治疗有占据重要地位,但仍有一定的局限性。新的GOLD指南也提出了制定个体化的治疗[2]。皮质抑素(cortistatin,CST)是新的生长抑素家族成员,是1996年发现的神经内分泌多肽,具有和生长抑素相似的结构,广泛分布于中枢神经系统及外周组织,包括免疫系统、心脏、肝脏、胃肠道、肺及肾脏等,参与多种炎症性疾病的病理生理过程[3-4]。但在慢性阻塞性肺病的发病机制中的作用研究甚少。本研究旨在通过探讨皮质抑素在慢阻塞性肺病患者肺泡灌洗液中的表达和炎症关系,为慢性阻塞性肺病的治疗提供新的思路。
1.对象与方法
1.1 研究对象
选取2016年1月至2018年1月在我院收治的中重度慢性阻塞性肺病急性发作患者55例,年龄在40岁至75岁,诊断符合最新《慢性阻塞性肺疾病诊断指南》[5],FEV1%>30%预计值,并排除呼吸衰竭,慢性肺源性心脏病,肺结核,肺癌,间质性肺疾病,糖尿病,冠心病,高血压,肾衰竭。其中男性38例,女性17例,平均年龄(65.33±8.54)岁。正常对照组30例,来自不明原因胸痛或健康自愿者,无吸烟史,入院行血液检查、痰菌检查,肺功能,胸部影像学等检查无异常发现,排除有冠心病、慢性阻塞性肺病等肺部炎症病变。其中男性29例,女性11例,平均年龄(43.1±9.6)岁,入选对象经过伦理委员会同意,签署支气管镜检查知情同意书。
1.2 材料和方法
正常对照组和COPD发作组患者入院当天或次日采血,行气管镜检查。治疗组达临床缓解后采集标本。(1)清晨空腹采静脉血4mL于促凝管,标本静置15rain,1000r/rain离心15rain,取血清约1.5mL于EP管,-20℃冻存。(2)所有研究对象在肺功能测定之前均休息20min,然后在肺功能检测医师指导下使用德国耶格肺功能仪测定肺功能,包括FEV1%pred和FEVl/FVC指标。(3)行支气管镜检查肺泡灌洗术,用生理盐水灌洗,总量60~100mL,回收30~50%,所得肺泡灌洗液进行预处理,取上清,同时检测细胞学分类和皮质抑素的测定。细胞学分类根据总细胞计数,以PBS混悬细胞沉淀,调整细胞浓度为2×106个细胞/ml的细胞悬液,甩片机甩片,Wright-Giemsa染色,在高倍镜下按一定方向 数200个除上皮细胞以外的有核细胞,分别计算出嗜中性粒细胞、巨噬细胞、嗜酸性粒细胞等细胞所占细胞总数的百分比。皮质抑素测定采用放射免疫法(美国Phoenix Pharmaceuticals公司提供,批号20170901),按照放射免疫商品试剂盒说明书进行操作,根据标准曲线读取样品皮质抑素含量,以pg/ml表示。
1.3 统计学方法
采用SPSS13.0软件进行统计分析,正态分布计量资料以(±s)表示,采用方差分析和q检验;以P<0.05为差异有统计学意义。
2.结果
2.1 BALF细胞学检测
三组BALF淋巴细胞百分比差异均无统计,慢阻肺组BALF嗜中性粒细胞百分比显著高于对照组且巨噬细胞百分比低于对照组(P<0.05)见表1。
表1 3组治疗前后肺功能结果(±s)
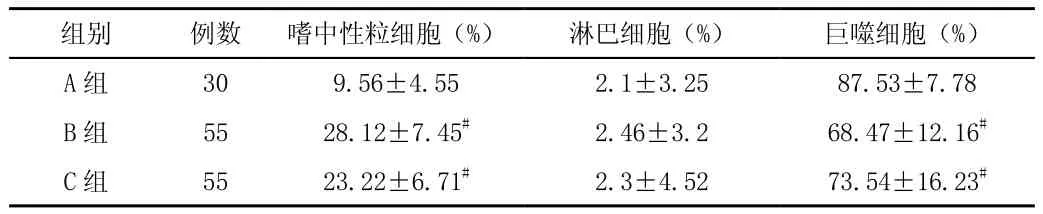
表1 3组治疗前后肺功能结果(±s)
注:A组:正常对照组,B组:慢性阻塞性肺病患者急性加重组。C组:慢性阻塞性肺病患者治疗组。与A组比较,#P<0.05。
组别 例数 嗜中性粒细胞(%) 淋巴细胞(%) 巨噬细胞(%)A 组 30 9.56±4.55 2.1±3.25 87.53±7.78 B 组 55 28.12±7.45# 2.46±3.2 68.47±12.16#C 组 55 23.22±6.71# 2.3±4.52 73.54±16.23#
2.2 皮质抑素和C反应蛋白水平
慢阻肺组BALF皮质抑素水平和C反应蛋白水平显著高于对照组(均P<0.05)见表2。
表2 3组患者治疗前后 BALF皮质抑素和C反应蛋白水平(±s)
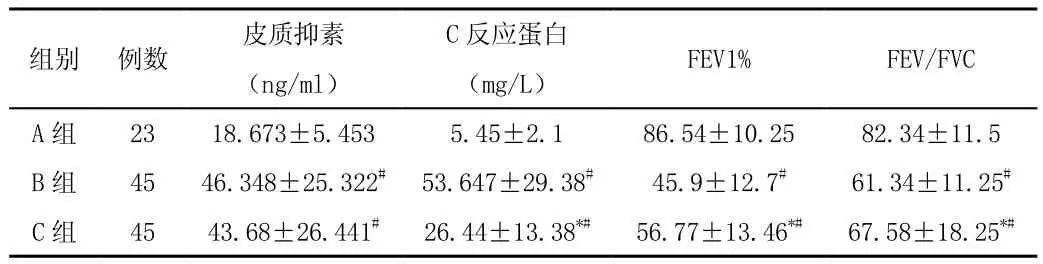
表2 3组患者治疗前后 BALF皮质抑素和C反应蛋白水平(±s)
注:A组:正常对照组,B组:慢性阻塞性肺病患者急性加重组。C组:慢性阻塞性肺病患者治疗组。与A组比较,#P<0.05,与B组比较,*P<0.05。
组别 例数 皮质抑素(ng/ml)C反应蛋白(mg/L) FEV1% FEV/FVC A 组 23 18.673±5.453 5.45±2.1 86.54±10.25 82.34±11.5 B 组 45 46.348±25.322# 53.647±29.38# 45.9±12.7# 61.34±11.25#C 组 45 43.68±26.441# 26.44±13.38*# 56.77±13.46*# 67.58±18.25*#
2.3 BALF皮质抑素和C反应蛋白水平相关性分析
COPD患者治疗前后BALF中皮质抑素与C反应蛋白无明显相关性,分别为治疗前比较(r=0.221,P>0.05),治疗后比较(r=0.280,P>0.05)。
3.讨论
慢性阻塞性肺疾病(COPD)是一种常见的以持续性呼吸道症状持续气流受限为特征的可以预防和治疗的疾病[2],由于气流受限和呼吸道症状的持续存在,其内在的表现为慢性气道炎症造成肺泡结构的破坏,气道重塑。气道内出现巨噬细胞增加,中性粒细胞活化,在叠加哮喘时还出现嗜酸性粒细胞、淋巴细胞增加的炎症改变[6]。引起一系列炎症因子和介质的释放,因而其慢性炎症机制复杂,迄今未能完全阐明。
皮质抑素已被证明来源于生长抑素的神经肽类,可发挥不同于生长抑素功能的神经肽类[7]。2005年ALLIA用RT-PCR检测出皮质抑素可分布于甲状腺,肾上腺,肺,肠道等外周组织器官中,并能调节机体内分泌激素的释放[8]。CST能作用于淋巴细胞及巨噬细胞,减少炎症因子的生成并促进抗炎因子的释放,参与免疫炎症反应的调节过程[9]。但皮质抑素发挥生理作用的信号通路还在研究,其特异性受体没有准确定论[10]。近年来有关皮质抑素在一些炎症性疾病的研究成为其功能学研究的重大突破。体外研究证实CST能够抑制活化的巨噬细胞产生TNF-α、白介素-6(interleukin-6,IL-6)、白介素-12(interleukin-12,IL-12等,在脓毒血症、三硝基苯磺酸(TNBS)所致的结肠炎和胶原所致的关节炎等啮齿类动物模型中,CST能够改善临床症状,减轻组织病理性改变参考文献[11]。这些数据表明,CST的效应与降低Thl介导的自身免疫和炎症反应,以及增加调节T细胞维持免疫耐受有关。在肺组织的研究中,廖程程,陈亚红[12]等研究发现慢阻肺组大鼠血浆皮质抑素显著高于对照组,BALF中皮质抑素含量也显著高于对照组,而大鼠肺组织皮质抑素较对照组升高超过1倍。本研究针对皮质抑素可能存在的炎症抑制作用,检测了慢性阻塞性肺病急性加重和激素治疗缓解后肺泡灌洗液的皮质抑素水平,结果提示两组慢阻肺患者组BALF中皮质抑素含量均显著高于正常对照组,两组慢阻肺患者组中C反应蛋白亦明显高于正常对照组,但皮质抑素与C反应蛋白无明显相关性,C反应蛋白的增高往往反应的是急性炎症状态,与感染关系较大,结果有可能说明皮质抑素未能提示与感染诱发的气道炎症的相关性。而激素治疗后慢性阻塞性肺病组与未治疗前组相比无显著性差异,说明皮质抑素在慢性阻塞性肺病缓解过程中的变化仍需进一步分析。
在慢性阻塞性肺病的发病机制中,往往存在炎症性Th细胞的炎症极化失衡[13]与调节性/抑制性T细胞失衡的学说[14],尽管激素在慢性阻塞性肺病的急性加重期和慢性缓解期都是可推荐用药,但其疗效和疗程仍需个体化分析。本研究初步发现皮质抑素在慢阻肺患者肺泡灌洗液中表达升高,但皮质抑素作为一种能调节神经激素释放的神经内分泌多肽如何参与炎症过程,是否作为一种有效的炎症抑制因子,为慢性阻塞性肺病治疗的新思路目前尚需进一步的临床研究。

