饲养方式对苏尼特羊脂肪组织中脂肪代谢相关基因表达量的影响
杨 蕾,王柏辉,罗玉龙,王 宇,苏 琳,赵丽华,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
脂肪具有储存甘油三酯并释放脂肪酸的作用,被认为是改善羊肉品质和影响羊肉风味的重要物质。在脂肪组织中硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)、脂肪酸脱氢酶Ⅰ(Δ5-fatty acid desaturases,FADS1)、脂肪酸脱氢酶Ⅱ(Δ6-fatty acid desaturases,FADS2)、脂肪酸延长酶(elongase of very long chain fatty acid 5,Elove5)、脂蛋白脂酶(lipoprotein lipase,LPL)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、肉碱棕榈酰转移酶Ⅰ(carnitine palmitoyltransferase I,CPT1)、脂肪酸结合蛋白酶(fatty acid-binding protein,FABP4)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor,PPARγ)是影响脂肪合成和分解的关键酶。近年来,大量的研究表明,调控饲养方式对脂肪酸组成和脂肪代谢相关基因的表达有一定影响[1-3]。有研究结果表明不同饲养方式对羊肉中LPL、ACC、FABP4、CPT1和SCD基因表达量以及脂肪酸组成和含量均有影响[4-5]。Meadus等[6]发现在日粮中添加共轭亚油酸可以影响PPARγ基因的表达,从而促进肌内脂肪的沉积。
苏尼特羊作为内蒙古独特的优良羊种,原产于锡林郭勒盟,含蛋白高且膻味轻,并且富含人体所需的各种氨基酸和脂肪酸,具有较高的营养价值[7]。罗玉龙[8]、郭月英[9]、苏琳[10]等主要对苏尼特羊肉中风味物质、生长特性相关基因和肌纤维的种类分布等方面进行研究,但对于影响苏尼特羊肉中营养成分的因素,特别是对肉中不饱和脂肪酸种类与含量的研究相对较少。本实验采用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法研究饲养方式对脂肪代谢相关基因mRNA表达量的影响,同时分析不同脂肪组织中脂肪代谢基因表达量的差异性,以期从分子生物学的角度解释放牧和圈养两种饲养方式下苏尼特羊脂肪组织中脂肪和脂肪酸的沉积机理,为改善圈养条件下苏尼特羊肉品质和风味提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
随机从内蒙古巴彦淖尔市五原县巴美肉羊种园区选取放牧和圈养条件下12 月龄的苏尼特羊各10 只(公母各5 只),宰前绝食20 h,屠宰后,取肌内脂肪、尾脂和肾脂各约10 g,于液氮中保存,并转移到实验室置于-80 ℃冰箱下保藏待用。
氯仿、异丙醇、无水乙醇(均为分析纯)、RNase-free水北京天根生物技术有限公司;琼脂粉 天津市风船化学试剂科技有限公司;核酸染料 北京百泰克生物技术有限公司;焦碳酸二乙酯 Intrivogen公司;RNAiso Plus、6×loading buffer、Marker DL2000、Premix Taq®Version2.0、PremeScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM大连宝生物工程有限公司。
1.2 仪器与设备
ZHJH-C1112C超净台 上海智城分析仪器制造有限公司;5430R低温台式冷冻离心机 德国Eppendorf公司;BG-power5000型稳压稳流电泳仪 北京百晶生物科技有限公司;水平电泳槽、凝胶成像分析仪、CFX96TMReal-Time PCR仪 美国Bio-Rad公司;普通PCR仪美国Applied Biosystems公司。
1.3 方法
1.3.1 引物与探针设计与合成
SCD、FADS1、FADS2、LPL、ACC、CPT1、PPARγ、Elove5、FABP4由上海生工生物工程有限公司设计并合成,β-actin作为管家基因(表1)。
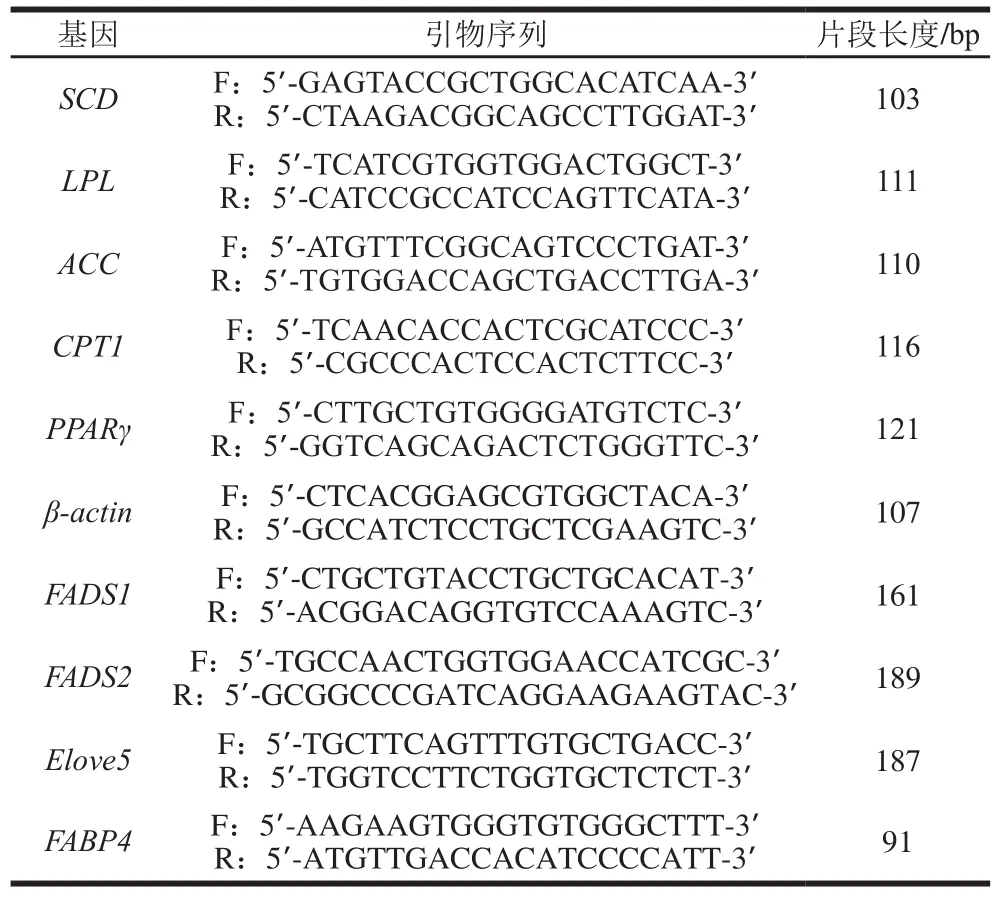
表 1 实时荧光定量PCR引物Table 1 Primers used for quantitative real-time PCR
1.3.2 总RNA提取与反转录
称取50~100 mg的样品放入经液氮冷却的研钵中,并不断加入液氮研磨样品至细粉末状用于RNA提取,提取参照参考文献[11],得到RNA后使用质量分数1%的琼脂糖胶点样并电泳检测提取的总RNA的质量与质量浓度。
将所有RNA样品稀释为统一质量浓度500 ng/µL。使用反转录试剂盒(PrimerScriptTMRT reagent Kit with gDNA Eraser)两步法将RNA样品反转录为cDNA,反转录过程参照参考文献[11],反转录后得到的cDNA质量浓度默认为50 ng/L,在-20 ℃冰箱内保存备用。
1.3.3 实时荧光定量PCR
本实验按照CFX96TMReal-Time PCR Detection System的二步法进行操作。以上述所合成的cDNA为模板,使用SYBR®Premix Ex TaqTMII(TLi RNaseH Plus)试剂盒进行实时荧光定量PCR扩增[12]。
荧光实时定量PCR体系(25.0 µL):SYBR®Premix Ex TaqTMII(TLi RNaseH Plus) 12.5 µL、引物F 1.0 µL、引物R 1.0 µL、cDNA模板2.0 µL、RNase Free dH2O 8.5 µL。
实时荧光定量PCR条件:预变性95 ℃、30 s;变性95 ℃、5 s,退火,各引物对应时间30 s,延伸72 ℃、30 s(变性、退火和延伸35 个循环);延伸72 ℃,10 min。
1.4 数据统计分析
应用SPSS 20.0软件进行统计分析,检验实验数据的正态分布性,差异性分析采用双因素方差分析(Two way-ANOVA)进行LSD多重比较,P<0.05为差异显著,P<0.01为差异极显著。相关性采用双变量相关分析(Pearson),检测相关水平为r=0.05。
2 结果与分析
2.1 饲养方式对脂肪代谢基因表达量的影响
2.1.1 脂肪酸脱氢酶
由图1可知,不同饲养方式对脂肪组织中脂肪酸脱氢酶基因(SCD、FADS1、FADS2和Elove5)表达量均有影响。在圈养条件下,SCD基因在脂肪组织中表达量显著高于放牧条件(P<0.05)。由于SCD基因主要促进油酸的合成[13],在脂肪合成过程中,油酸更容易成为酰基辅酶A胆固醇酰基转移酶和二脂酰甘油酰基转移酶合成底物,从而生成胆固醇酯和甘油三酯,而这两者是动物体内最主要的中性脂成分[14],SCD基因在放牧组脂肪中的表达量显著低于圈养组,因此推断放牧条件不利于脂肪的合成。卜登攀等[15]证明在饲料中添加亚麻酸对SCD基因表达具有抑制作用,同时有研究证明牧草中含有较多的亚麻酸和亚油酸等多不饱和脂肪酸[16],因此牧草中高含量的亚麻酸可能是抑制放牧组SCD基因表达的原因之一。

图 1 饲养方式对不同脂肪组织中脂肪酸脱氢酶基因表达量的影响Fig. 1 Effects of two different feeding patterns on the expression of fatty acid desaturase gene in different adipose tissues
放牧条件下,脂肪组织中FADS1、FADS2和Elove5基因表达量高于圈养条件,特别在放牧组肌内脂肪中这3 种基因的表达量显著高于圈养组(P<0.05)。这与Urrutia等[17]对羔羊日粮中添加亚油酸的研究结果一致,在饲料中添加亚油酸对肾脂和尾脂中FADS1、FADS2和Elove5基因表达量未产生显著影响,但可以促进肌内脂肪中FADS1和FADS2基因表达,从而可能使肌内脂肪中二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)等多不饱和脂肪酸的沉积。
2.1.2 脂肪合成调节酶
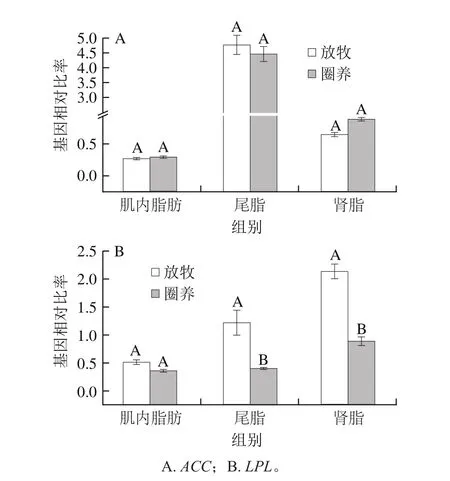
图 2 饲养方式对不同脂肪组织中脂肪合成分解酶基因表达量的影响Fig. 2 Effects of two different feeding patterns on the expression of fat decomposition and synthesis enzyme genes in different adipose tissues
如图2所示,不同饲养方式对脂肪合成分解酶基因(ACC和LPL)表达量有显著影响。在不同饲养方式下,脂肪组织中ACC基因的表达量均无显著差异(P>0.05)。ACC是脂肪酸合成的限速酶,参与催化脂肪酸合成的第一步反应[18],杨若琳等[19]研究发现ACC活力大小与脂肪酸含量的高低有很大关系,说明ACC基因的高表达有利于脂肪酸的沉积,可推测出不同饲养方式对脂肪组织中脂肪酸沉积无影响。研究发现圈养对肌肉组织ACC基因表达量的影响为显著高于放牧组[4],与本实验结果存在差异,可能由于不同品种间ACC基因的表达有差异。
LPL能够将血液中乳糜微粒和极低密度脂蛋白所携带的甘油三酯分解成甘油和脂肪酸,向有关组织提供合成甘油三酯所需的原料,对脂肪沉积起着重要的调控作用[20],其活力的高低是评价脂肪储积能力的重要指标之一[21],放牧条件下,脂肪组织中LPL的表达量高于圈养条件,在尾脂和肾脂中放牧组显著高于圈养组(P<0.05);因此推测放牧条件有助于脂肪组织中脂肪的沉积,特别是对脂肪储存影响较大。
2.1.3 脂肪酸转移酶和调控因子
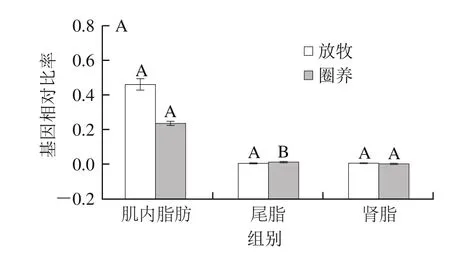
图 3 饲养方式对不同脂肪组织中CPT1和FABP4基因表达量的影响Fig. 3 Effects of two different feeding patterns on the expression of CPT1 and FABP4 in different adipose tissues
由图3可知,不同饲养方式对脂肪组织中脂肪酸转移酶基因(FABP4和CPT1)表达量有影响。放牧条件下,肌内脂肪组织中CPT1基因的表达量高于圈养条件,但差异不显著(P>0.05),有研究表明日粮中亚油酸的含量与CPT1基因的表达量呈正相关[22],可以推测牧草中亚油酸的含量是导致放牧组肌内脂肪组织中CPT1高表达的原因之一。放牧条件增加FABP4基因在脂肪组织中表达量,但差异不显著(P>0.05),这与Dervishi等[4]的研究结果一致。
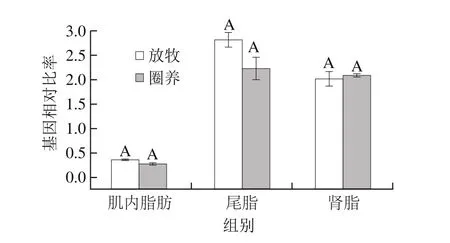
图 4 饲养方式对不同脂肪组织中PPARγ基因表达量的影响Fig. 4 Effects of two different feeding patterns on the expression of PPARγ in different adipose tissues
如图4可知,放牧条件下可增加肌内脂肪和尾脂中PPARγ基因在脂肪组织中的表达量,但差异不显著。PPARγ具有脂肪组织特异性,能被脂肪酸和外源性过氧化氢酶增殖剂激活,从而调控脂质代谢酶的表达[21],它和SREBP1促进甘油三酯合成脂肪组织,是调控脂肪生成的关键酶之一[23],也有研究证明PPARγ基因的表达与脂肪沉积率呈正相关[24],由此得出,放牧组苏尼特羊脂肪组织中脂肪沉积可能会高于圈养组,但对肌内脂肪的沉积没有明显影响。
2.2 不同脂肪组织中脂肪代谢基因表达量差异性分析
由表2可知,不同脂肪组织间脂肪代谢基因表达量存在显著差异。在尾脂中SCD和ACC的表达量显著高于肌内脂肪和肾脂(P<0.05),SCD和ACC基因的高表达量有助于脂肪的沉积,因此导致两种基因在尾脂中的表达量显著高于其他两种脂肪组织。在肌内脂肪中FADS1和FADS2基因表达量显著高于尾脂和肾脂(P<0.05),这2 种酶是生成长链不饱和脂肪酸的关键酶,因此可以证明在同一机体中肌肉是营养价值较高的部位。Elove5基因在背最长肌中的表达量显著高于尾脂(P<0.05)。在肾脂中LPL基因的表达量显著高于肌内脂肪(P<0.05),有研究发现LPL基因表达量在不同部位存在差异且在肌内脂肪中表达量低于其他脂肪组织[17,25],LPL基因在肾脂中表达量最高,其次为尾脂中,在肌内脂肪中表达量最低,本实验结果验证了这一结论。
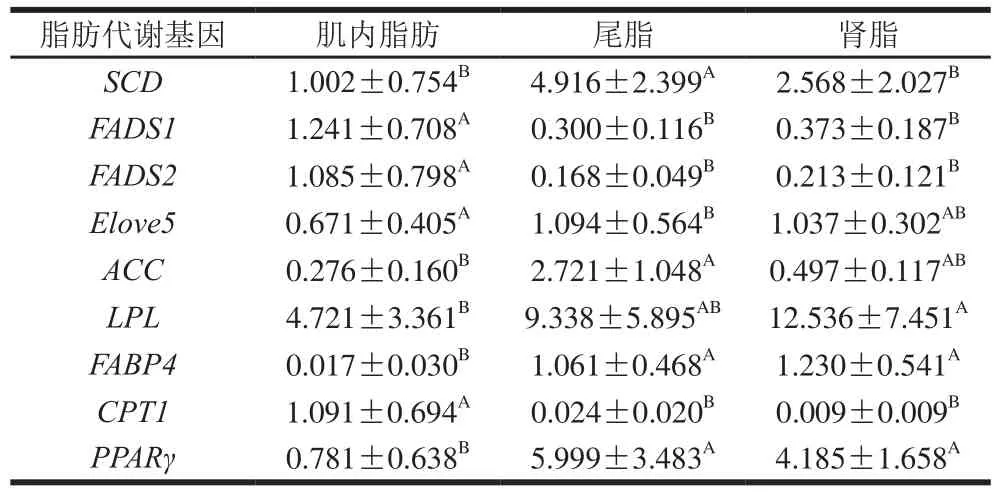
表 2 不同脂肪组织中脂肪代谢基因表达量差异性分析Table 2 Differential analysis of fat metabolism genes expression in different adipose tissues
不同脂肪组织中脂肪酸转移酶和调控因子的基因表达存在显著差异。肌内脂肪中FABP4基因表达量显著低于其他两个部位(P<0.05)。FABP4基因作为脂质积累调控的下游关键基因,其高表达量有助于脂肪沉积[26],推断其在肌内脂肪中的表达量显著降低,本实验验证了这一推断。CPT1基因在肌内脂肪中表达量显著高于尾脂和肾脂(P<0.05),张艳芳[27]发现猪肉CPT1基因的高表达有利于肌内脂肪的沉积,本研究中放牧组苏尼特羊肌内脂肪中的CPT1基因mRNA表达量较高,可以推断放牧条件有利于苏尼特羊肌肉中脂肪的沉积。PPARγ基因在尾脂和肾脂中的表达量显著高于肌内脂肪(P<0.05),大小为尾脂>肾脂>肌内脂肪。林婄婄等[28]研究发现PPARγ基因在浅层脂肪组织(尾脂、皮下脂肪)中的表达量低于深层脂肪组织,并推测因浅层脂肪组织储存大量的脂肪从而使PPARγ基因在尾脂和皮下脂肪组织中表达量较高,本实验验证了这一结论。
2.3 脂肪酸代谢基因间mRNA水平相关性分析
由表3~5可知,脂肪组织中脂肪酸脱氢酶与脂肪合成分解酶基因的mRNA基因表达量相关性分析发现,ACC与SCD基因表达量呈负相关(P>0.05)。说明了当ACC高表达时促进了SCD基因表达量的升高,使脂肪组织中单不饱和脂肪酸的含量增加。LPL是脂肪分解的关键酶,这些酶通过调控体内甘油三酯的水解,来降低体脂合成和沉积,并促进脂肪酸的氧化[29]。本实验结果表明,当LPL基因表达量高时会抑制SCD基因表达,使机体中脂肪含量降低同时降低脂肪组织中单不饱和脂肪酸含量。
对脂肪酸脱氢酶与脂肪酸转移酶和调控因子相关性分析中,脂肪组织中FADS1和FADS2与CPT1和FABP4基因表达量呈负相关,但相关性不显著(P>0.05),FABP4作为膜周边蛋白,分子中心有高亲和力的长链脂肪酸结合位点,能可逆地与长链脂肪酸以非共价结合,参与饱和及不饱和长链脂肪酸的代谢和转运[30],当FABP4基因的表达量高时会抑制FADS1和FADS2基因表达,不利于长链脂肪酸的沉积;因此通过调控FABP4基因的表达促进脂肪组织中长链脂肪酸的沉积还需进一步研究。在肌内脂肪中FADS1和FADS2与PPARγ基因表达存在显著正相关(P<0.05),PPARγ作为脂肪沉积的重要的调节因子,其高表达正向调控FADS1和FADS2基因的表达量,使羊肉中肌内脂肪中不饱和脂肪酸沉积,从而改善羊肉嫩度和营养价值;在尾脂和肾脂中FADS1和FADS2与PPARγ基因表达量负相关,但相关性不显著(P>0.05),与上述肌内脂肪相关性分析得到的结果相反,推测基因在不同部位中的表达可能存在差异。
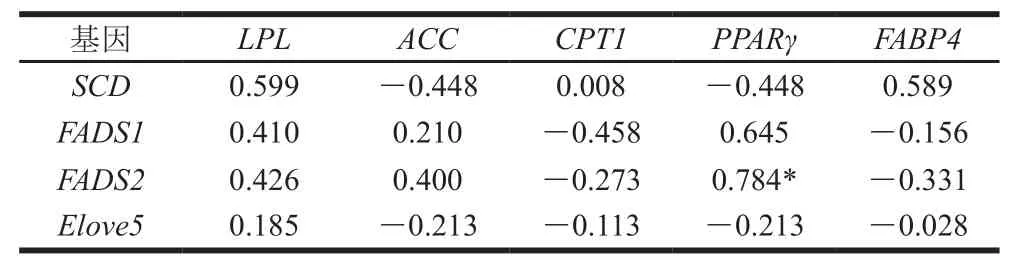
表 3 肌内脂肪中脂质代谢基因mRNA表达量的相关性Table 3 Correlation of lipid metabolism genes in intramuscular adipose tissues
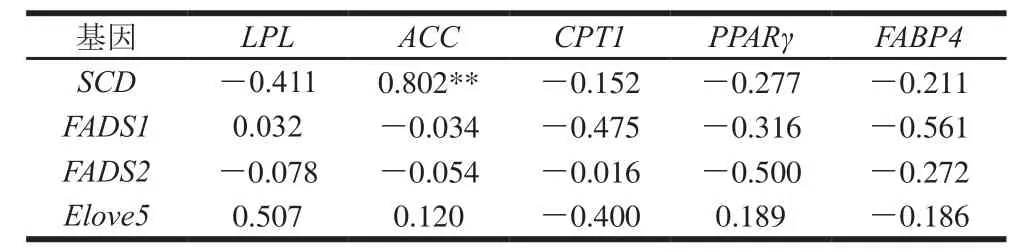
表 4 尾脂中脂质代谢基因mRNA表达量的相关性Table 4 Correlation of lipid metabolism genes in tail adipose tissues
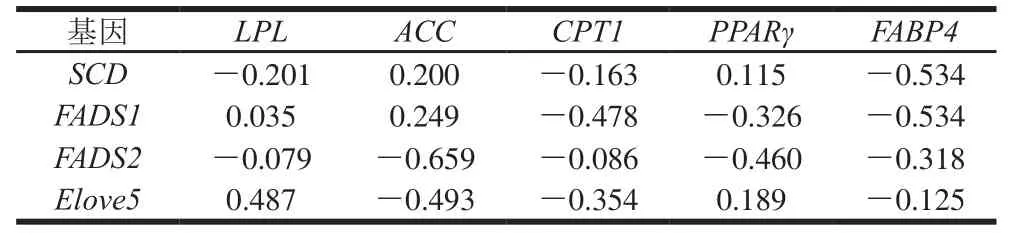
表 5 肾脂中脂质代谢基因mRNA表达量的相关性Table 5 Correlation of lipid metabolism genes in perirenal adipose tissues
3 讨 论
本实验通过实时荧光定量PCR分析不同饲养方式下脂肪代谢相关基因表达量的差异,得到放牧组LPL基因在尾脂和肾脂中的表达量显著高于圈养组(P<0.05),因此放牧条件更有利于储能脂肪的沉积。圈养组SCD基因表达量显著高于放牧组(P<0.05),表明圈养方式有利于促进油酸的合成,Nuernberg等[31]验证了这一结果。对饲养方式影响脂肪组织中脂肪酸含量和种类的研究发现放牧方式有利于多不饱和脂肪酸的沉积[31-33],本实验得出放牧组中FADS1、FADS2和Elove5基因表达量显著高于圈养组(P<0.05),可以证明放牧方式有利于亚麻酸、DHA和EPA的沉积的原因之一是脂肪酸脱氢酶基因的高表达。
通过不同脂肪组织间脂肪代谢相关基因mRNA基因表达量差异性分析发现,肌内脂肪中FADS1和FADS2的基因表达量显著高于其他两组(P<0.05),研究发现肌内脂肪有利于C18:2、C18:3、C20:5和C20:6的沉积[33],实验结果与上述结论一致。PPARγ基因在尾脂和肾脂中的表达量显著高于肌内脂肪(P<0.05),由高到低依次为尾脂>肾脂>肌内脂肪,说明苏尼特羊尾脂的合成强度明显高于其他两个脂肪组织,这一结论完全符合肉羊中脂肪沉积规律,即皮下脂肪最先沉积,接着是尾部脂肪和内脏贮脂,最后沉积于肌肉内[34]。
脂肪代谢基因间相关性分析发现,在苏尼特羊脂肪组织中,通过调控SCD基因的表达量可以调节脂肪的沉积。CPT1和FABP4基因的高表达量有利于脂肪组织中EPA和DHA的沉积。在尾脂和肾脂中PPARγ基因的高表达不利于C18:2和C18:3的沉积。以上研究都证明采用分子生物学的手段调控基因表达对脂肪和脂肪酸的沉积有显著影响。由此可知,饲养方式会影响脂肪代谢相关基因的表达,进而调控脂肪沉积。目前为适应生态与畜牧业发展双赢的目标,内蒙古、新疆和青海等地羊养殖方式由传统放牧散养到集中圈养是大势所趋,如何在圈养条件下控制羊的运动量、改变饲料营养水平,从而改善舍饲羊的肉用品质和营养品质是未来的研究核心和方向。

