内分泌治疗联合经尿道前列腺电切术对晚期前列腺癌的临床疗效观察
吴 斌,王旭刚,史红雷,莫乃新,吕 忠
(江苏大学附属武进医院泌尿外科,江苏 常州 213000)
前列腺癌是老年男性临床常见的恶性肿瘤之一,近年来随着工业化发展、社会环境污染以及人们生活方式的改变,前列腺癌的发病率和病死率亦呈逐渐上升的趋势[1],在全球范围内,其发病率已位居男性恶性肿瘤发病率的第2位。由于前列腺癌的临床表现与前列腺增生较为相似,常因为误诊而错过最佳治疗时机,并且临床症状不明显,通常容易被患者忽视,大多数患者当确诊时已属于晚期,不宜进行根治性手术[2]。临床上多采用内分泌治疗为常规治疗,经尿道前列腺电切术(TURP)也逐渐成为前列腺癌的重要治疗方法[3-4]。本研究以我院收治的40例晚期前列腺癌患者为研究对象,通过采用内分泌治疗联合前列腺电切术治疗晚期前列腺癌,取得了良好疗效,现将结果报告如下。
1 资料与方法
1.1一般资料:选取2012年1月~2016年12月间我院泌尿外科收治的46例晚期前列腺癌患者为研究对象,年龄58~86岁,平均(67.83±8.38)岁,病程7~42个月,平均(22.33±7.62)个月,均以尿频、排尿困难等症状住院,伴有急性尿潴留30例,血尿9例,合并心脏病12例,高血压10例,糖尿病6例,肾功能不全7例。采用随机数字表法将46例患者分为对照组和观察组,每组23例。(1)纳入标准:患者经前列腺穿刺活检确诊为前列腺癌,且临床分期为C期或D期;②血清前列腺特异抗原(PSA)≥4 ng/ml;③尿动力学检察最大尿流率(Qmax)<10 ml/s;④患者及家属签署《知情同意书》。排除标准:①伴有心脑血管系统、肝肾功能损伤等严重疾病,或为精神病患者;②符合激素非依赖性前列腺癌诊断标准;③合并其他泌尿系统疾病及其他肿瘤;④患者及家属不同意接受前列腺电切术。两组患者年龄组成、病程、Qmax及PSA水平比较,差异均无统计学意义(P>0.05),具有可比性。两组患者基本资料如表1所示。
1.2方法:对照组采用内分泌治疗,观察组患者在内分泌治疗的基础上联合TURP治疗。TURP术:患者行持续硬膜外阻滞麻醉,在监视系统下采用GYRUS等离子电切镜,切除压迫后尿道的大部前列腺肿瘤组织至后尿道有一宽敞通道。内分泌治疗给予皮下注射诺雷德3.6 mg,1次/28 d,加以口服康士德50 mg/d。
1.3观察指标:对两组患者定期随访,比较两组患者治疗前后残余尿量(residual urine volume,RV)、最大尿流率(maximum urinary flow rate,Qmax)、国际前列腺症状评分(International Prostate Symptom Score,IPSS)和生活质量评分(quality of life score,QoL)的变化,记录治疗前后患者血清前列腺特异性抗原(PSA)、血红蛋白(Hb),T细胞亚群(CD4、CD8、CD4/CD8)和NK细胞水平,患者肿瘤控制率和不良反应发生率。


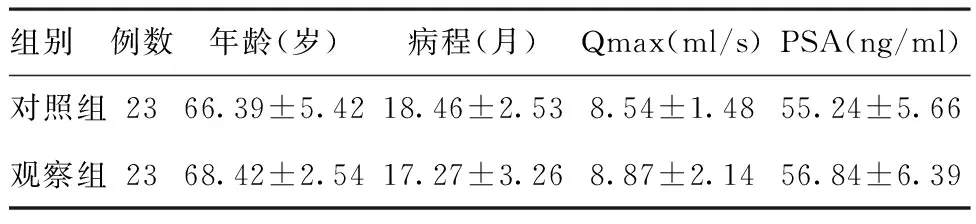
组别例数年龄(岁)病程(月)Qmax(ml/s)PSA(ng/ml)对照组2366.39±5.4218.46±2.538.54±1.4855.24±5.66观察组2368.42±2.5417.27±3.268.87±2.1456.84±6.39
注:两组间各项比较,P>0.05
2 结果
2.1两组治疗前后血清前列腺特异性抗原(PSA)和血红蛋白(Hb)水平的比较:两组治疗前PSA和Hb水平比较,差异均无统计学意义(P>0.05),治疗后PSA水平降低,Hb含量升高,且观察组优于对照组,差异均有统计学意义(P<0.05,P<0.01),见表2。

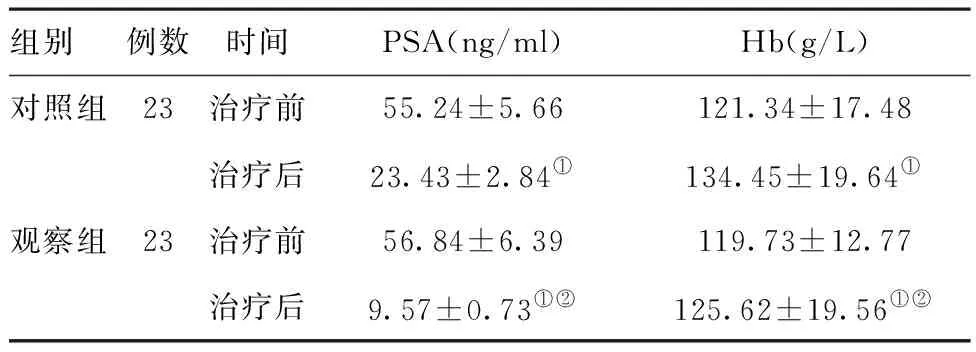
组别例数时间PSA(ng/ml)Hb(g/L)对照组23治疗前55.24±5.66121.34±17.48治疗后23.43±2.84①134.45±19.64①观察组23治疗前56.84±6.39119.73±12.77治疗后9.57±0.73①②125.62±19.56①②
注:与同组治疗前相比,①P<0.05;与同期对照组比较,②P<0.05
2.2两组治疗前后残余尿量(RV)、最大尿流率(Qmax)、国际前列腺症状评分(IPSS)和生活质量评分(QoL)的比较:经治疗后,两组患者Qmax和QoL较治疗前明显升高,RV和IPSS水平较治疗前明显减少,差异有统计学意义(P<0.05,P<0.01),且观察组与对照组比较,差异具有统计学意义(P<0.05)。见表3。
2.3两组治疗前后T细胞亚群和NK细胞水平的比较:治疗前两组患者各项指标水平比较,差异均无统计学意义(P>0.05);经治疗后,两组中CD4、CD4/CD8和NK水平均较治疗前升高,而CD8水平较治疗前降低,其中观察组效果优于对照组,差异有统计学意义(P<0.05)。见表4。

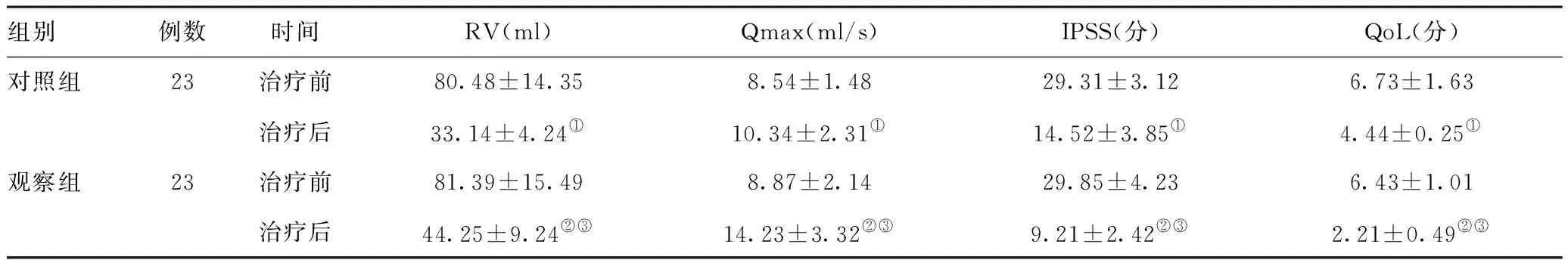
组别例数时间RV(ml)Qmax(ml/s)IPSS(分)QoL(分)对照组23治疗前80.48±14.358.54±1.4829.31±3.126.73±1.63治疗后33.14±4.24①10.34±2.31①14.52±3.85①4.44±0.25①观察组23治疗前81.39±15.498.87±2.1429.85±4.236.43±1.01治疗后44.25±9.24②③14.23±3.32②③9.21±2.42②③2.21±0.49②③
注:与同组治疗前相比,①P<0.05,②P<0.01;与同期对照组比较,③P<0.05


组别例数时间CD4(%)CD8(%)CD4/CD8NK(%)对照组23治疗前37.24±2.3129.21±3.941.27±0.5917.42±2.45治疗后39.63±1.7527.53±2.451.44±0.7119.64±2.35①观察组23治疗前37.93±3.3328.94±3.521.31±0.9518.74±2.58治疗后41.43±2.42①③24.56±3.23①③1.69±0.75②24.63±3.47①③
注:与同组治疗前相比,①P<0.05;与同期对照组比较,②P<0.05,③P<0.01
2.4两组患者治疗1年后肿瘤控制率及不良反应发生率的比较:对照组肿瘤控制率13例(56.52%),不良反应发生率15例(65.22%),观察组分别为16例(69.57%)、11例(47.83%),观察组两项均优于对照组,且差异具有统计学意义(P<0.05)。
3 讨论
前列腺癌是指发生在前列腺组织的上皮性恶性肿瘤,主要表现为前列腺腺泡组织细胞的异常无序生长[5],由于其发病隐匿,早期通常无明显症状,当肿瘤浸润及膀胱颈阻塞尿道时则会发生尿路梗阻等症状,严重者可出现尿潴留、尿失禁、血尿、骨痛等症状,就诊时多已属晚期。由于前列腺癌细胞的生长主要依赖于雄激素,近年来,临床上对于晚期前列腺癌的治疗多采用内分泌治疗,包括手术和药物去势两种,主要目的均是通过降低雄激素水平从而抑制癌细胞的生长繁殖[6]。此外,经尿道前列腺电切术通过对癌组织进行姑息性切除,因其创伤小、出血少、有利于患者的术后恢复,提高患者生活质量,在解决尿路梗阻方面的显著疗效而得到医学界的广泛认可,在晚期前列腺癌的临床应用也越来越广泛。
晚期前列腺癌患者行经尿道前列腺电切术是否会发生肿瘤的扩散一直是学者们所研究的热点问题之一。因TURP只切除部分的癌组织,而其残留的癌组织仍然会继续转移、生长。前列腺癌发生转移的原因主要在于其具有转移性的癌细胞,而前列腺癌细胞为一种激素依赖性细胞,主要依赖于睾酮,因而还需再结合去势联合雄激素阻断疗法促进癌细胞凋亡、抑制癌细胞的生长和转移。有研究认为,经尿道前列腺电切术结合内分泌治疗具有积极作用[7]。诺雷德是促性腺激素释放激素(LHRH)的一种合成类似物,长期使用可抑制脑垂体促性腺激素的分泌,从而使男性血清睾酮水平下降至去势水平。康士德为一类非甾体类拮抗雄激素的药物,在细胞水平通过与雄激素竞争对应受体,阻断雄激素受体复合物由向胞核转运从而抑制雄激素依赖性肿瘤细胞的生长和转移,两者联用可最大限度达到抑制前列腺癌细胞生长的目的。本研究通过采用内分泌治疗联合经尿道前列腺电切术,与对照组比较,结果显示患者的Hb、Qmax、CD4、CD4/CD8和NK水平均明显升高,差异有统计学意义(P<0.05),而CD8、RV、QoL和IPSS等指标均明显下降,差异有统计学意义(P<0.05),且患者肿瘤控制率和不良反应率均显著高于对照组。
一般来说,前列腺癌内分泌治疗可引起雄激素依赖性前列腺癌细胞发生凋亡,而TURP治疗则可迅速有效改善患者下尿路梗阻症状,降低患者体内肿瘤细胞负荷。本研究结果表明,对于晚期前列腺癌患者通过采用内分泌疗法联合TURP治疗,可有效解除患者下尿路梗阻,抑制前列腺癌转移,能较好地改善患者生活质量,提高患者肿瘤控制率,减少不良反应发生,具有一定临床推广应用价值。

