用生存分析模型挖掘LY6E基因表达与胃癌放疗敏感性关系研究
简国浩,孙海橦,杨婧怡,敖 磊,汤在祥
(苏州大学医学部公共卫生学院流行病与卫生统计学系,江苏 苏州 215000)
胃癌是一种常见的癌症,胃癌的死亡率居全球癌症患者死亡率中的第三位 ,仅次于肺癌和肝癌[1]。超过70%的胃癌新发病例发生在发展中国家,约50%的病例发生在亚洲东部,主要集中在中国[2],中国胃癌发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%[2]。可见胃癌的治疗是一个急需解决的问题。目前癌症的治疗方法主要为手术和化疗,胃癌的转移是加重病情关键原因,而肿瘤的转移是影响患者预后的重要因素。Lymphocyte antigen 6 complex,locus E(LY6E)与肿瘤的预后密切相关[8]。在乳腺癌的研究中发现,LY6E与乳腺癌的发展、免疫逃逸、耐药性相关[3],LY6E负调控乳腺癌的肺转移[4];在胃癌上,研究发现LY6E的高表达是胃癌细胞存活、增殖和转移的潜在重要因素[5];在胰腺癌的研究中发现,LY6E在胰腺癌细胞系球中过度表达[6]。
然而,如今对LY6E的研究中,还没有报道过LY6E的表达与胃癌放疗敏感性的关系。本次研究中,假设LY6E低表达的患者具有放疗敏感性,会从放疗中获得生存收益。本次研究以开放的TCGA数据库中的肿瘤数据作为基础,来研究放疗敏感性和LY6E表达的联系,以此来验证本研究的假设。
1 资料与方法
1.1一般资料:本研究的数据来源是TCGA (TCGA,http://cancergenome.nih.gov/)中胃癌患者LY6E的mRNAseq数据,患者均为美国人群,数据清理过程如下:首先,合并临床数据信息,获得患者的生存信息,将无生存结局或生存时间的患者去除。获得有效的生存数据后,再与其他临床指标数据合并,获得完整的临床数据。其次,将下载到的LY6E的mRNAseq数据中的重复个体删除,然后与清理过的临床数据合并,获得最终用于分析的数据,该数据包括了371个患者。
1.2分析方法:在患者接受放疗后,与不接受放疗的患者相比,其生存率提高,获得显著的生存收益,即定义为具有放疗敏感性;能够预测个体放疗敏感性或与个体放疗敏感性有关的基因,称为预测放疗敏感性的生物标记物。为验证本研究的结果,在分析时,本研究将数据随机分为两份,一份为测试数据,一份为验证数据。在两份数据中采用同样的分析方法,如果两份数据的结果均与本研究假设一致,则验证本研究假设,说明LY6E的表达与放疗敏感性有关。
1.3统计学分析:由于LY6E基因mRNAseq表达值在测试数据中呈现偏态分布,此时中位数更能体现样本均数,所以本研究定义测试数据的中位数为高低表达的临界值。接着对LY6E高低表达的患者分别进行单因素和多因素的分析,分析放疗和非放疗组的生存差异。本研究采用R软件survival包的生存分析模型进行分析,生存曲线作图采用rms包,以P值为0.05作为显著性判断标准。
2 结果
2.1LY6E的表达水平以及临床数据与患者生存的相关性分析:在本研究中,生存为最重要的观察指标,首先分析临床指标及LY6E表达水平与总生存的关系。由表1的分析结果可以看出,放疗与生存有明显的关联,测试数据的单因素分析以及对照数据的单因素和多因素分析均有统计学意义(P<0.05),其他因素包括LY6E表达水平大多无统计学意义(P>0.05)。在测试数据和验证数据中,多因素分析的P值分别为0.38和0.23,表明患者生存与LY6E的表达水平无明显关联。但年龄的验证数据和N分期的测试数据分析有统计学意义(P<0.05),说明这两种因素可能与患者的生存有关。虽然放疗与患者的总生存有明显的关联,但是这并不能证明放疗能让所有患者都收益,如果想要进行精准放疗,就需要通过某种因素来辨别出患者放疗后是否能得到较好的生存收益。
表1临床指标及LY6E表达水平与总生存的关系
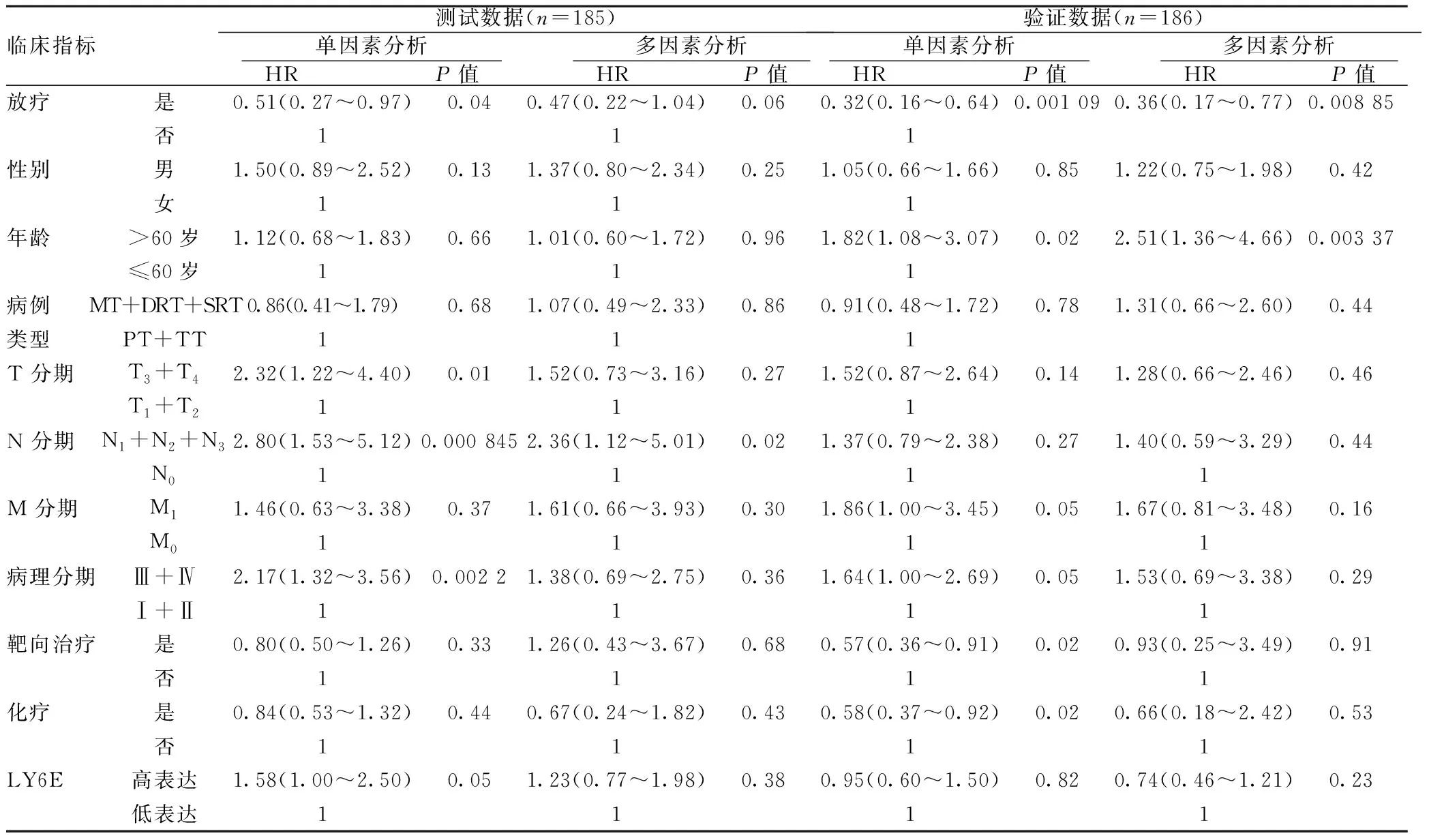
临床指标测试数据(n=185) 单因素分析 HR P值 多因素分析 HR P值 验证数据(n=186) 单因素分析 HR P值 多因素分析 HR P值 放疗是0.51(0.27~0.97)0.040.47(0.22~1.04)0.060.32(0.16~0.64)0.001 090.36(0.17~0.77)0.008 85否111性别男1.50(0.89~2.52)0.131.37(0.80~2.34)0.251.05(0.66~1.66)0.851.22(0.75~1.98)0.42女111年龄>60岁1.12(0.68~1.83)0.661.01(0.60~1.72)0.961.82(1.08~3.07)0.022.51(1.36~4.66)0.003 37≤60岁111病例MT+DRT+SRT0.86(0.41~1.79)0.681.07(0.49~2.33)0.860.91(0.48~1.72)0.781.31(0.66~2.60)0.44类型PT+TT111T 分期T3+T42.32(1.22~4.40)0.011.52(0.73~3.16)0.271.52(0.87~2.64)0.141.28(0.66~2.46)0.46T1+T2111N 分期N1+N2+N32.80(1.53~5.12)0.000 8452.36(1.12~5.01)0.021.37(0.79~2.38)0.271.40(0.59~3.29)0.44N01111M 分期M11.46(0.63~3.38)0.371.61(0.66~3.93)0.301.86(1.00~3.45)0.051.67(0.81~3.48)0.16M01111病理分期Ⅲ+Ⅳ2.17(1.32~3.56)0.002 21.38(0.69~2.75)0.361.64(1.00~2.69)0.051.53(0.69~3.38)0.29Ⅰ+Ⅱ1111靶向治疗是0.80(0.50~1.26)0.331.26(0.43~3.67)0.680.57(0.36~0.91)0.020.93(0.25~3.49)0.91否1111化疗是0.84(0.53~1.32)0.440.67(0.24~1.82)0.430.58(0.37~0.92)0.020.66(0.18~2.42)0.53否1111LY6E高表达1.58(1.00~2.50)0.051.23(0.77~1.98)0.380.95(0.60~1.50)0.820.74(0.46~1.21)0.23低表达1111
2.2临床指标与LY6E表达水平的关系:本研究采用卡方检验单因素分析,分析LY6E的表达水平是否与临床指标有关,结果见表2。结果表明,LY6E的表达水平与临床指标无显著关联。说明如果LY6E的表达水平能够提示患者是否具有放疗敏感性,那么它有很大概率是一个独立在临床指标外的分子标记物。
表2LY6E表达水平与临床指标的关系(例)

临床指标测试数据(n=185)LY6E高表达LY6E低表达P值验证数据(n=186)LY6E高表达LY6E低表达 P值性别男62650.8458560.16女30284527年龄>6066590.2771520.45≤6026343231病例类型MT+DRT+SRT21280.4926210.73PT+TT19152919NOS52504843T 分期T3+T472640.2777590.69T1+T220292624N 分期N1+N2+N367580.1973610.84N025353022M 分期M1750.751280.84M085889175病理分期Ⅲ+Ⅳ48370.1159460.83Ⅰ+Ⅱ39514437
2.3LY6E的高低表达组放疗与患者生存的关系:本研究假设了LY6E低表达的患者具有放疗敏感性,则需要探究LY6E低表达的患者在接受放疗后生存率是否提高了。表3的分析结果表明,LY6E高表达组放疗后并无明显的生存收益,无论测试数据还是验证数据,调整前和调整后均无统计学意义(P>0.05)。但在低表达组的测试数据中,HR值为0.18(0.04~0.76),P=0.02,多因素调整后的HR值为0.06(0.01~0.36),P=0.002 36,即表明低表达组的患者在接受放疗后,生存率有了显著的提升,而验证数据的分析结果也能得出该结论,验证数据多因素调整后HR值为0.05(0.005~0.46),P=0.008 39。通过表3的分析结果可见,LY6E低表达的患者接受放疗后,生存率明显提升,有显著的生存收益。
图1为测试数据和验证数据LY6E高低表达组通过是否放疗为区别生成的生存曲线图。图1中高表达组(见图1①、③)显示,LY6E高表达的患者接受放疗后没有得到显著的生存收益。而在低表达组(见图1②、④)中,可见患者接受放疗后获得了明显的生存收益。该结果与本研究的假设一致,即LY6E低表达的患者具有放疗敏感性。本研究继续对全部数据进行分析,得出表3的全部数据分析结果。结果显示,高表达组放疗调整后的HR值为0.83(0.44~1.55),P=0.55,无统计学意义;反观低表达组放疗调整后的HR值为0.09(0.03~0.30),P=0.000 096 2,也可得出低表达患者很可能拥有放疗敏感性的结论。该进一步对全部数据的研究也是为了防止因为样本量过小而导致得出错误的结论。
图2中①是全体高表达患者分为放疗与不放疗两组得到的生存曲线图,显示放疗与不放疗对LY6E高表达患者的生存率没有明显的影响。图2中②是全体低表达患者分为放疗与不放疗两组后得到的生存曲线图,可见LY6E低表达的患者接受放疗后生存率有了明显的提升。图2中③为接受放疗的全体患者分为LY6E高低表达两组而得到的生存曲线图,也可见低表达的患者接受放疗后得到了明显的生存收益。图2进一步地说明了LY6E低表达的患者具有较好的放疗敏感性。
表3LY6E高低表达组放疗与总生存关系分析

项目组别调整前(RT vs NRT) HR P值 调整后(RT vs NRT) HR P值 测试数据高表达组(n=92)0.84(0.40~1.74)0.631.28(0.47~3.47)0.63低表达组(n=93)0.18(0.04~0.76)0.020.06(0.01~0.36)0.002 36验证数据高表达组(n=103)0.64(0.30~1.40)0.280.72(0.29~1.76)0.47低表达组(n=83)0.04(0.005~0.29)0.001 770.05(0.005~0.46)0.008 39全部数据高表达组(n=195)0.73(0.43~1.24)0.240.83(0.44~1.55)0.55低表达组(n=176)0.12(0.04~0.34)0.000 066 20.09(0.03~0.30)0.000 096 2
注:调整因素为性别、年龄、病例类型、TNM分期、病理分期及是否靶向治疗

图1 测试数据和验证数据LY6E表达水平与放疗后生存关系

图2 全部患者LY6E表达水平与放疗后患者生存关系
3 讨论
本研究使用了TCGA数据库公开数据,没有外部独立的数据作为验证,所以采用了交叉验证的方法,把数据随机地分为两组,再分别分析。研究中发现LY6E低表达的患者拥有较高的放疗敏感性,但是LY6E高表达的患者对于放疗并不敏感。这对于临床放疗是有一定的指导意义的。
虽然在过去的研究中,放疗并不是治疗胃癌最主要的手段,但是认为放疗能提高患者的生存率[7],然而这并不说明放疗对所有患者都是有益的。本研究的结果也说明了放疗和患者的生存是有明显的联系的,但是放疗的不良反应仍然让人们感到担心。临床工作中发现,患者放疗后肿瘤消退程度有明显差异,其主要原因就在于个体之间的放疗敏感性有较大的差距。因此把胃癌患者中有显著放疗敏感性的患者划分出来,进行精准放疗,而剩余没有放疗敏感性的患者不接受放疗,这样使放疗更加有效,也使得对放疗不敏感的患者免去了放疗带来的不良反应。由此可见,在临床治疗中,找到合适的生物标志物,再以此来分辨出敏感人群具有重要意义。然而,到目前为止,在胃癌上尚未发现鉴别放疗敏感性的有效分子标记物。
Yeom CJ等人揭示了LY6E在恶性肿瘤生长中的机制和功能联系[8]。LY6E蛋白在多种肿瘤中高表达[9-10]。这些研究提示,LY6E与癌症有明显关联。
本研究设计了这个实验,试图去找出合适的生物标志物。目前尚未见到有报道研究LY6E与胃癌放疗敏感性的关系,研究的结果表明,LY6E有很大可能是提示胃癌放疗敏感性的有效分子标记物。本研究存在着一些不足之处,如样本量较小,样本都为TCGA数据中的数据,可能会存在误差,但研究采用交叉分析的方法,寻找LY6E与胃癌放疗敏感性的联系,为实现精准放疗提供了参考依据,也为该类其他研究提供了一些思路与线索。

