外源6-BA对白花败酱草生长和酶活性的调控
吕璐,赵晓萌,彭修文,彭铁双,何功秀
(中南林业科技大学 林学院,湖南 长沙 410004)
白花败酱草,又名苦益菜,属多年生草本植物,是一种重要的传统中药材,在山区可作为野生蔬菜,含有丰富的营养物质,具有独特的风味。广泛分布于华南、华中和华北等地[1-2]。白花败酱草具有抑菌、抗病毒、抗肿瘤、清热解毒、活血化瘀等功效,广泛应用于附件炎、慢性盆腔炎、流行性腮腺炎、慢性胃炎等病症的治疗[3-5]。白花败酱草也可以作为荒山荒地植被修复。已有研究表明,植株在生长过程中受到多种因素的调控和影响,例如植物生长调节剂[6-7]。6-BA是一种重要的细胞分裂素,对植物的生长和次生代谢物的合成与积累具有重要的调控作用[8-9]。迄今为止,还未见有关植物生长调节剂6-BA对白花败酱草生长及酶活性影响的报道。本文研究6-BA对白花败酱草生长、色素含量及抗氧化酶活性的影响,旨在为运用植物生长调节剂来调节白花败酱草的生长提供理论依据。
1 材料与方法
1.1 材料
于2016年5月,选取长势较为一致、密度均匀无杂草的当年生盆栽白花败酱草幼苗作为试验材料,用少量的KOH溶液溶解1 mg的6-BA,用蒸馏水配制浓度为1.0和2.0 mg·L-1的6-BA溶液,随机取24株分为2组,每组3个重复,分别以上述6-BA溶液处理,再取12株作为1组用清水重复处理作为对照。每隔3 d喷施1次,每次每株喷施6-BA 100 mL,喷施时间为下午4:00左右,共喷施10次。处理当日取1次样品,以后每隔10 d取1次样品,共取4次,每次采样均为混合采样;每次记录株高、叶片数及鲜重。
1.2 测定指标与方法
叶绿素a、b和类胡萝卜素含量采用无水乙醇-纯丙酮混合液(1∶1)浸提法测定[10]。超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定[11]。过氧化物酶(POD)活性按照愈创木酚法测定[12]。
1.3 数据分析
用SPSS 22.0和Excel 2010对原始数据进行处理与分析。
2 结果与分析
2.1 6-BA对白花败酱草生长的影响
图1所示为6-BA对白花败酱草生长的影响。无外源植物激素处理的白花败酱草(CK)生长良好,随着培养时间的延长,其整株的鲜重显著增加,培养至30 d时达到最大值,约为5.96 g,是培养初期鲜重的8.6倍。与对照相比,外源6-BA处理显著的抑制白花败酱草的生长。培养至30 d时,1.0和2.0 mg·L-16-BA处理的白花败酱草鲜重分别为3.47 g和2.96 g,是培养初期鲜重量的4.4和3.5倍,是同期对照鲜重的58.3%和49.7%,这说明外源植物激素6-BA显著的抑制白花败酱草的生长,降低其生物量。

图1 6-BA对白花败酱草鲜重的影响
2.2 6-BA对叶绿素含量的影响
由图2可知,对照组白花败酱草叶片中叶绿素a含量随着培养时间的延长而逐渐增加,培养至30 d时达到最大值,约为1.49 mg·g-1,是培养初期叶绿素含量的2.2倍。1.0和2.0 mg·L-16-BA处理的白花败酱草叶片中叶绿素a的含量则随着培养时间的延长而逐渐降低,培养至30 d时达到最低值,分别为0.19和0.42 mg·g-1,是培养初期叶绿素a含量的24.1%和57.9%,是同期对照组叶绿素a含量的12.6%和28.2%。对照组白花败酱草叶片中叶绿素b的含量随着培养时间的延长呈递增趋势,培养至30 d时达到最大值,约为0.58 mg·g-1,是培养初期叶绿素b含量的2.1倍。但1.0和2.0 mg·L-16-BA处理的白花败酱草叶片中叶绿素b的含量则随着培养时间的延长而呈递减趋势,培养至30 d时达到最低值,是培养初期叶绿素b含量的39.3%和39.7%,是同期对照组中叶绿素b含量的19.6%和23.6%。
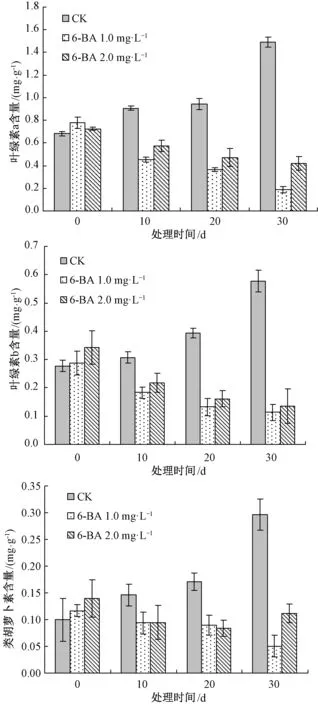
图2 6-BA对白花败酱草叶绿素和类胡萝卜 素含量的影响
对照组白花败酱草叶片中类胡萝卜素的含量随着培养时间的延长呈逐渐增加的趋势,培养至30 d时达到最大值,约为0.29 mg·g-1,是培养初期类胡萝卜素含量的3.0倍。1.0 mg·L-16-BA处理的白花败酱草叶片中类胡萝卜素的含量随着培养时间的延长而逐渐降低,培养至30 d时达到最低值,约为0.05 mg·g-1,是培养初期类胡萝卜素含量的43.2%,是同期对照组类胡萝卜素含量的17.0%。而2.0 mg·L-16-BA处理的白花败酱草叶片中类胡萝卜素含量则呈现先降低后升高的变化趋势。在培养至20 d时,2.0 mg·L-16-BA处理的白花败酱草叶片中类胡萝卜素含量达到最低值,是培养初期含量的59.8%;而培养至30 d时,其含量升高,是培养初期含量的80.2%,是同期对照组含量的37.7%。以上试验结果证实,外源激素6-BA可以显著的降低白花败酱草叶片中叶绿素a/b和类胡萝卜素的含量。
2.3 6-BA对酶活性的影响
由图3可知,对照组白花败酱草中SOD活性水平呈现先升高后降低的变化趋势。培养至20 d时达到最大值,约为90.30 U·g-1,是培养初期SOD活性水平的1.9倍,随后其活性又降低,但高于培养初期SOD活性水平。1.0 mg·L-16-BA处理的白花败酱草中SOD活性水平随着培养时间的延长而逐渐升高,培养至20 d时达到最大值,约为54.65 U·g-1,是培养初期SOD活性水平的1.3倍,随后又降低,低于培养初期SOD活性水平且低于同期对照组SOD活性水平。而2.0 mg·L-16-BA处理的白花败酱草中SOD活性水平则呈现先降低后升高的变化趋势。培养至20 d时达到最低值,约为14.34 U·g-1,是培养初期SOD活性水平的30.5%;培养至30 d时,其SOD活性水平又升高,达到24.57 U·g-1,是培养初期SOD活性水平的52.3%,且低于同期对照组SOD活性水平。
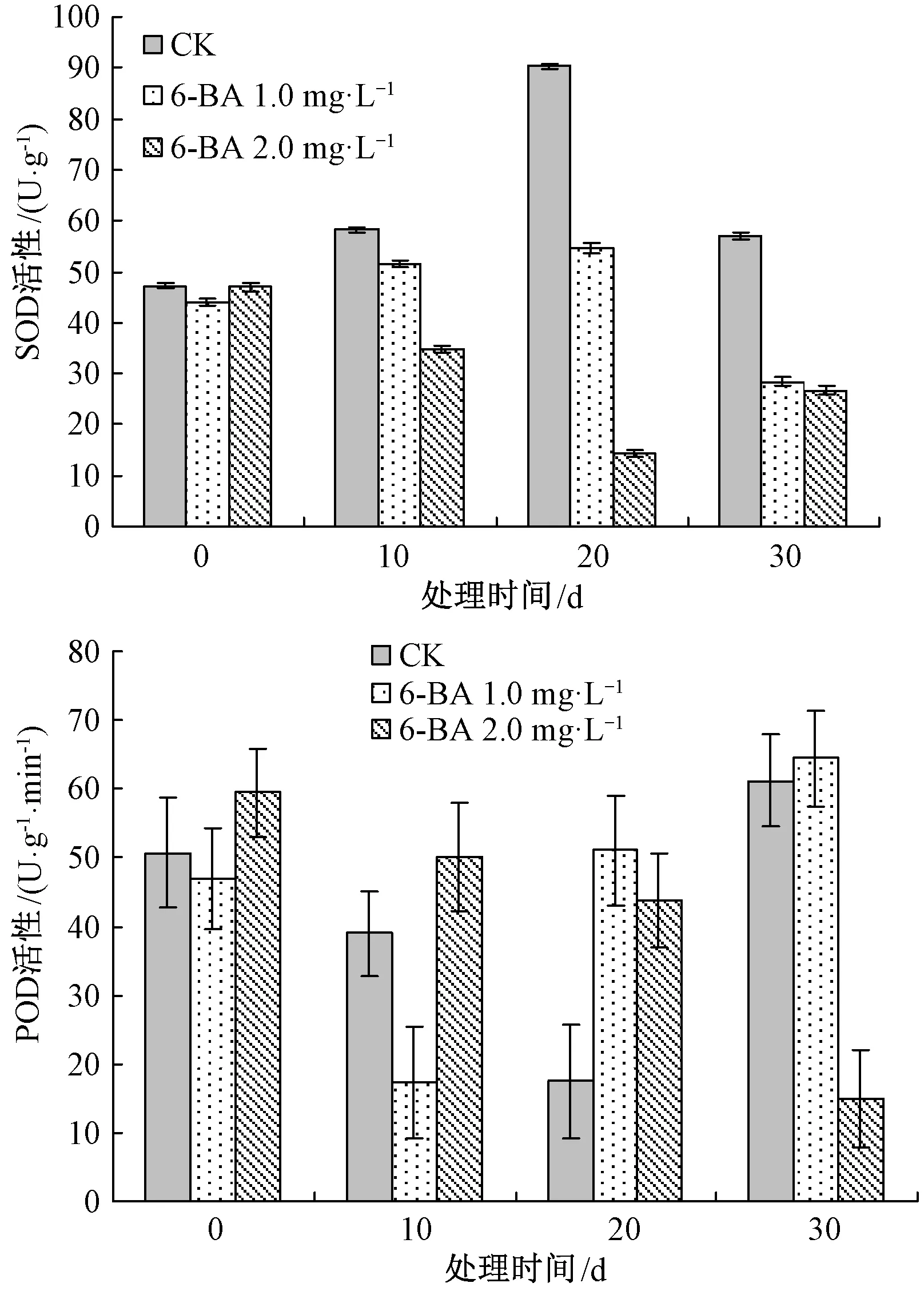
图3 6-BA对白花败酱草中SOD和 POD活性的影响
对照组白花败酱草中POD活性水平呈现先降低后升高的变化趋势。培养至20 d时达到最低值,约为17.48 U·g-1min,是培养初期POD活性水平的34.5%,而后其活性又升高,达到61.24 U·g-1min,较培养初期POD活性水平增加20.9%。1.0 mg·L-16-BA处理的白花败酱草中POD活性水平也呈现先降低后升高的变化趋势,培养至30 d时达到最大值,约为64.41 U·g-1min-1,是培养初期POD活性水平的1.4倍,略高于同期对照组中POD活性水平。而2.0 mg·L-16-BA处理的白花败酱草中POD活性水平则呈现逐渐降低的变化趋势。培养至30 d时,达到最低值,约为14.91 U·g-1min-1,是培养初期POD活性水平的25.1%,是同期对照组中POD活性水平的24.4%。以上试验结果说明,外源6-BA可以不同程度的调控白花败酱草中SOD和POD的活性水平。
3 讨论
植物在生长过程中受到多种因素的影响,如植物生长调节剂等。已有的研究表明,外施不同浓度的6-BA,对长春花幼苗的株高、叶长和叶宽具有促进作用,这表明外源6-BA对长春花(Catharanthusroseus)幼苗的生长具有促进作用[13]。外施高浓度的6-BA溶液,则可以显著的增加津春2号黄瓜(Cucumissativus)幼苗叶片干重/鲜重的比值[14];而适宜浓度的6-BA则可以促进香椿(Toonasinensis)幼苗的生长,同时促进其干物质的积累[15]。高温胁迫则抑制P13201品种甜椒(Capsicumannuum)的株高和鲜重,阻滞其生长,而外施6-BA则可以显著的缓解高温胁迫对甜椒的伤害,其株高和鲜重与无胁迫处理的对照组无显著性差异[16]。外源6-BA可以显著的增加金鱼草(Antirrhinummajus)的叶长和叶宽,但是降低其株高,这表明外源6-BA对金鱼草的生长具有重要的调控作用[17]。在本试验中,外源6-BA则抑制败酱菜的生长,降低其鲜重量,同时抑制叶绿素a/b和类胡萝卜素的合成与积累,推测6-BA可能通过抑制色素的合成与积累进而阻碍白花败酱草的生长。外施6-BA则可以显著增加香水百合叶绿素a/b的含量,这与本试验的结果相反,可能因植物种类和外施6-BA浓度不同而造成的[18]。
植物生长受到抑制时,体内的抗氧化酶活性水平会发生变化。SOD和POD是植物体内重要的抗氧化酶,植株的生长状态与体内的SOD和POD活性水平密切相关。外施6-BA可以不同程度的增加香水百合体内SOD和CAT的活性水平[18]。6-BA和硝酸银组合处理三裂叶野葛毛状根,则降低其体内的SOD和POD活性水平,而6-BA单独处理三裂叶野葛毛状根,则降低毛状根中SOD活性水平,提高POD活性水平[19-20]。试验结果显示,外施6-BA,则可以显著的降低白花败酱草体内SOD活性,降低或升高POD活性,推测其可能通过调节细胞内抗氧化酶的活性水平来缓解外源6-BA对白花败酱草生长的抑制作用,酶活性变化的差异可能因植物种类不同而有所差异。外源6-BA抑制白花败酱草的生长,调控体内抗氧化酶的活性水平,是否影响其体内次生代谢物的合成与积累尚不清楚,有待于进一步研究。

