烧伤复合海水浸泡大鼠的多器官损伤分析
李丹丹,马伟,胡明,冯友新,瞿秀华,张达矜,乔媛媛
(中国人民解放军海军总医院,北京100048)
随着我国海洋经济的发展,海洋事业活动日益频繁,加之海军执行任务半径增大,海上事故时有发生,受伤合并烧伤发生率较高。海水具有特殊的物化性质,如高渗、碱性、低温、有菌等,若伤员坠海则伤口被海水浸泡[1]。烧伤合并海水浸泡会造成伤员电解质紊乱、高渗性脱水、酸碱失衡、感染及多脏器功能衰竭,甚至死亡[2]。严重烧伤后人体将发生不同程度的低血容量休克,引起主要器官缺血、缺氧损害,尤其肠道损伤,导致烧伤后全身炎症反应综合征和多器官功能障碍综合征(MODS)[3]。2017年10月~2018年2月,本研究以烫伤合并海水浸泡大鼠为模型,观察烫伤合并海水浸泡后的伤情特点,为研究烧伤合并海水浸泡救治提供依据。
1 材料与方法
1.1 动物、试剂及仪器 雄性SD大鼠120只,体质量(290.3±7.5)g,由军事医学科学院动物研究所提供,昼夜节律饲养,自由饮食,实验室内适应饲养1周。B淋巴细胞瘤2(Bcl-2)一抗兔多克隆抗体(北京碧云天公司),天冬氨酸特异性半胱氨酸蛋白酶3(Caspase-3)一抗兔多克隆抗体(美国Abcam公司),PV-9000二步法免疫组化检测试剂、DAB显色试剂盒、SAP-9100试剂盒(中杉金桥公司),其他试剂均为国产分析纯或优级纯。全自动生化分析仪(日立)。
1.2 人工海水配制 根据国家海洋局第三研究所配方配制。渗透压(1 250±11)mmol/L,pH 8.2,钠离子(630±5)mmol/L,钾离子(10.88±0.68)mmol/L,氯离子(658.8±5.5)mmol/L,温度(22±1)℃,水温20~22 ℃。
1.3 动物分组及处理 将大鼠随机分为正常对照组、单纯烧伤组及烧伤浸泡2、6、12、24 h组(n=20)。正常对照组不作处理;单纯烧伤组、烧伤浸泡组用1.5%苯巴比妥钠腹腔注射麻醉,背部30%区域脱毛,按文献[4]方法电烙铁烧5 s,致背部30%总体表面积深Ⅱ度烫伤。烧伤浸泡组致伤后将大鼠置于固定架,浸泡于人工海水中,浸泡平面超过伤口创面,分别浸泡2、6、12、24 h。最终正常对照组、单纯烧伤组及烧伤浸泡2、6、12、24 h组分别存活20、20、17、13、14、8只。各组分别取8只大鼠,麻醉后采集其下腔静脉血,将其处死取肝、肺及肠道组织,于距回盲部5 cm处取小肠组织(长度2 cm)。
1.4 血液指标检测 肝功能指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA);肾功能指标:尿素氮(BUN)、血肌酐(SCr)、血尿酸(UA)、乳酸脱氢酶(LDH);应激指标:超敏C反应蛋白(hs-CRP)、血糖;组织代谢及缺氧指标:乳酸(LAC)、乙酰丙酮(ACAC)、血红蛋白(Hb);血离子:钾、钠、氯、钙、磷、镁等离子。
1.5 肝、肺、肠组织病理学变化观察 取各组肝、肺、肠组织在等渗盐水中清洗后,于10%中性多聚甲醛溶液中固定24 h,行常规石蜡包埋、切片(厚度5 μm),经苏木精-伊红染色,于光镜下观察各组织病理变化。
1.6 肝、肺、肠组织中凋亡相关蛋白Caspase-3、Bcl-2表达检测 采用免疫组化法。取组织切片,置65 ℃恒温箱烘烤60 min;二甲苯Ⅰ、Ⅱ溶液各浸泡15 min;各浓度乙醇梯度水化,1×PBS缓冲液洗切片5 min×3次,滴加3%过氧化氢,室温放置30 min去除内源性过氧化物;1×PBS缓冲液洗切片5 min×3次;柠檬酸盐溶液中煮沸进行抗原热修复;1×PBS缓冲液洗切片5 min×3次;滴加10%胎牛血清,37 ℃孵育60 min封闭非特异性结合位点,用滤纸吸去血清,不洗,直接滴加一抗Bcl-2(稀释比例1∶100),Caspase-3(稀释比例1∶100),放入湿盒后置于4 ℃冰箱孵育过夜;隔日将切片复苏1 h,回收一抗,1×PBS缓冲液洗切片5 min×3次;滴加二抗,37 ℃孵育30 min;滴加二抗,37 ℃孵育30 min;1×PBS缓冲液洗切片5 min×3次;显微镜下滴加DAB 工作液(稀释比例1∶200)显色,出现深棕色后,自来水充分冲洗终止显色反应;苏木素复染细胞核;各浓度乙醇梯度脱水,中性树胶封片置于镜下观察。Caspase-3及Bcl-2阳性染色为棕黄色,定位于细胞质,以细胞呈清晰棕色或棕褐色为阳性。用PBS代替一抗做阴性对照。计算各组蛋白阳性表达率[5]。
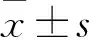
2 结果
2.1 各组肝功能指标比较 与正常对照组比较,单纯烧伤组、烧伤浸泡组AST、ALT水平高(P均<0.05);烧伤浸泡2、6、12、24 h组AST、ALT水平逐渐升高(P均<0.05),且烧伤浸泡6、12、24 h组AST、ALT水平均高于单纯烧伤组(P均<0.05)。各组肝功能其他指标比较差异无统计学意义(P均>0.05)。见表1。
2.2 各组肾功能指标比较 与正常对照组比较,单纯烧伤组、烧伤浸泡组BUN、LDH水平高(P均<0.05);与单纯烧伤组比较,烧伤浸泡24 h组AST、 ALT水平高(P均<0.05)。各组其他肝功能指标比较差异无统计学意义(P均>0.05)。与正常对照组比较,烧伤浸泡2 h组SCr低(P<0.05)。烧伤浸泡组UA虽升高,但与正常对照组比较差异无统计学意义(P>0.05)。见表2。
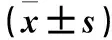
表1 各组肝功能指标比较
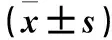
表2 各组肾功能指标比较
2.3 各组应激及组织代谢、缺氧指标比较 烧伤浸泡组hs-CRP水平逐渐升高,烧伤浸泡12、24 h组hs-CRP水平较正常对照组和单纯烧伤组高(P均<0.05);烧伤浸泡2、6、12 h组血糖先升高,浸泡24 h组血糖降低,浸泡12 h组血糖与正常对照组比较差异有统计学意义(P>0.05)。烧伤浸泡组ACAC与正常对照组比较差异有统计学意义(P<0.05),与单纯烧伤组比较差异无统计学意义(P均>0.05)。烧伤浸泡组Hb逐渐升高,烧伤浸泡6、12、24 h组Hb与正常对照组、单纯烧伤组比较差异有统计学意义(P均<0.05)。见表3。
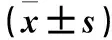
表3 各组应激及组织代谢、缺氧指标比较
2.4 各组血离子水平比较 烧伤浸泡2 h组血钠、氯较正常对照组高(P均<0.05),烧伤浸泡6、12、24 h组血钠、氯较正常对照组、单纯烧伤组高(P均<0.05)。烧伤浸泡2 h组血钾、钙较正常对照组高(P均<0.05);烧伤浸泡2、6 h组血磷、镁升高,血镁较正常对照组高(P<0.05),血磷较正常对照组、单纯烧伤组高(P均<0.05)。烧伤浸泡12、24 h组血钾、钙、磷、镁与正常对照组、单纯烧伤组比较差异无统计学意义(P均>0.05)。见表4。
表4 各组血离子水平比较
2.5 各组肝、肺、肠组织病理学改变比较 肝脏组织病理改变:正常对照组肝小叶结构完整清晰,肝细胞形态结构正常;单纯烧伤组肝细胞肿胀,胞质疏松,甚至空泡化或嗜酸性变,肝窦变窄,肝窦腔内有多形核白细胞聚集;烧伤浸泡24 h组肝细胞线粒体退变,大量脂质小体形成,核皱缩,异染色质边集,窦内皮细胞高度肿胀。肺脏组织病理改变:正常对照组肺组织结构正常,肺间质及肺泡壁无水肿;烧伤组肺组织结构被破坏,有少部分肺间质及肺泡壁轻度水肿;烧伤浸泡24 h组有明显肺间质及肺泡腔水肿,红细胞溢出,肺泡间质增厚,炎性细胞浸润;小血管周围间隙增宽,并可见片状出血。肠组织病理改变:正常对照组肠黏膜形态正常,肠黏膜绒毛结构完整,绒毛排列整齐,上皮细胞排列整齐,间质无水肿;肠黏膜绒毛破坏明显,绒毛顶端上皮有片状坏死、脱落绒毛间质疏松,间质充血及炎细胞浸润。
2.6 各组肝、肺、肠组织中Caspase-3、Bcl-2蛋白表达比较 正常对照组肝、肺、肠组织中Caspase-3蛋白阳性表达率均为0,单纯烧伤组分别为12.5%(1/8)、37.5%(3/8)、50%(4/8),烧伤浸泡24 h组分别为50%(4/8)、100%(8/8)、100%(8/8),各组肝、肺、肠组织中Caspase-3蛋白阳性表达率比较差异有统计学意义(P均<0.05);正常对照组肝、肺、肠组织中Bcl-2蛋白阳性表达率均为100%,单纯烧伤组分别为37.5%(3/8)、50%(4/8)、37.5%(3/8),烧伤浸泡24 h组均为0。各组肝、肺、肠组织中Bcl-2蛋白阳性表达率比较差异有统计学意义(P均<0.05)。
3 讨论
海水中含有高浓度的钠、钾、氯离子[6]及大量致病菌[7],同时还具有低温、强散热的特性。研究表明,烧伤合并海水浸泡会造成机体高渗性脱水、电解质紊乱、酸碱失衡、血流动力学紊乱,加重组织缺血、缺氧性损害[8]。文献报道胸部开放伤后海水浸泡可对大鼠、猪、狗等实验动物的呼吸、循环系统及全身水、电解质平衡造成严重影响,甚至引起MODS[9]。
肝脏是机体物质代谢最旺盛的器官之一,当机体遭受创伤而发生应激反应时,肝脏细胞会首先受到影响。其中ALT、AST的活性可反映肝细胞受损情况。本研究中大鼠烧伤合并海水浸泡组血液中ALT、AST水平比正常对照组、单纯致伤组高,表明其肝脏组织受损,有炎症细胞浸润,进而影响机体正常的代谢功能。
UA、SCr及BUN是临床常用的反映肾功能的指标。其中UA可反映肾小球的滤过功能。本研究中烧伤合并海水浸泡组BUN较正常对照组和单纯致伤组高。BUN变化较灵敏,可反映早期肾功能不全,当机体主要脏器出血及机体严重缺水时,BUN会显著升高。LDH催化碳水化合物代谢中无氧酵解的最终反应,其广泛存在于各种组织和器官内,细胞受损伤后将多种酶释放到细胞外,其活力与细胞损伤程度呈正相关。由于烧伤合并海水浸泡导致大鼠主要脏器处于缺水、缺血及缺氧等应激状态,受损细胞释放大量的LDH进入血液,故血清LDH水平升高。而烧伤合并海水浸泡组UA和SCr水平虽有改变,但变化不大,与正常对照组比较差异无统计学意义。有研究认为,肾滤过率低于50%时SCr才会明显升高[10]。这可能由于肾脏抗应激能力强,在一定范围内可维持内环境的相对稳态。
创伤后组织会存在缺血缺氧改变。ACAC及LAC是反映机体组织循环障碍及缺氧的指标。本研究烧伤合并浸泡组LAC虽升高但差异无统计学意义,而ACAC变化显著。当缺血缺氧时,机体进行无氧代谢产生乳酸,乳酸再形成大量的ACAC,而ACAC形成糖原的能力变弱,故机体堆积大量的ACAC,导致血液中ACAC水平升高。此外,当烧伤合并海水浸泡后,组织细胞和红细胞受损,会释放大量的炎症介质和Hb,故血清中hs-CRP和游离Hb相应升高。
钾、钙、磷、镁、氯、钠等离子是组成人体重要的物质。烧伤合并浸泡组血离子水平较正常对照组、单纯烧伤组高。血液中钙、磷、镁、钾水平依赖于肠道及肾脏调节。调控钙、磷代谢的激素有甲状旁腺素、甲状腺素等,其相互作用可维持血液离子浓度的正常水平。当机体受到创伤时,大量失血及缺氧等应激因素造成肠、肾、激素功能失调,进而引起血液中钙、磷、镁、钾等离子水平变化。
Bcl-2、Caspase-3与细胞凋亡密切相关,二者主要位于细胞质内。其中Caspase-3属于白细胞介素1β转换酶家族,是细胞凋亡的执行者[11]。Bcl-2是一种与膜稳定性相关的蛋白,通过细胞催化抗氧化作用、离子通道蛋白和吸附/锚定蛋白,抑制Caspase-3的活化,阻断细胞凋亡,提高细胞存活能力[10]。正常情况下,Caspase-3以无活性酶原形式存在,被激活为活性的Caspase-3时可引起细胞凋亡。本研究烧伤浸泡组肝、肺、肠组织结构和细胞形态变化最大,肝、肺、肠组织中Caspase-3蛋白阳性表达率最高、Bcl-2蛋白阳性表达率最低。严重烧伤合并海水浸泡导致消化道血供急剧减少,组织毛细血管微循环障碍,缺血缺氧引起酸中毒,自由基和炎性介质等水平升高,与凋亡相关的基因表达增强,启动了内源性和外源性及其他细胞凋亡激活途径,诱导内皮细胞、淋巴细胞和肠黏膜上皮细胞凋亡,肠黏膜上皮细胞稳态被打破,产生一系列级联反应,诱发脓毒症及MODS[12]。
海水浸泡会加重烧伤后肝、肺及肠道组织结构破坏和屏障功能损伤。在致伤浸泡短时间内海水温度较低,因此还是保护因素。本研究部分结果也提示烧伤浸泡2 h组肝肾功能指标较单纯烧伤组有改善,但随着浸泡时间的延长,机体损伤加重。严重烧伤后主要组织脏器缺血、缺氧,使组织中细胞保护因子水平降低,组织自我修复及保护功能减弱;而大量增加的炎症介质促进细胞凋亡。此外海水高致病菌、高盐、低温及强散热作用引起高渗性脱水、电解质紊乱、血流动力改变和心功能损害。因此,烧伤合并海水浸泡会加重肠道、肺脏及肝脏等的损伤,但机体对烧伤合并海水浸泡后的调节机制,特别是对内分泌的调节机制,尚不清楚,需进一步研究。

