大黄活性成分对实验性自身免疫性脑脊髓炎相关基因蛋白表达以及炎性因子的影响
姬军风 袁有才 王伟卓
(陕西中医药大学,咸阳712046)
多发性硬化(Multiple sclerosis,MS)是一种炎症介导的发生于中枢神经系统的慢性、进行性的自身免疫性疾病,引发脑、脊髓髓鞘脱落以及神经损伤,多发于中青年[1]。该病的发病机制尚不清楚,既往研究认为抗原特异性T淋巴细胞被异常激活,可穿过血脑屏障进入中枢神经系统,导致特异性免疫反应和中枢神经系统白质脱髓鞘、轴索损伤以及小血管炎性细胞浸润,诱导MS的产生[2]。随着诊断、治疗技术的发展,MS的检出率逐年升高,复发率降低,但MS可引起身体发生不可逆转的残疾,这对MS的诊断和治疗提出了巨大的挑战。实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)同样是由于抗原特异性T淋巴细胞介导的自身免疫性疾病,与MS的病理特征相似,因此常用来作为研究MS的动物模型[3,4]。MS的基本病机是肾虚痰瘀,而大黄酸是具有补泻作用的大黄活性成分,广泛应用于各种局部或者系统性炎症的治疗。研究表明,大黄酸具有高效的抗炎作用,并且可以阻碍经典Th1细胞分泌白细胞介素2(Interleukin-2,IL-2),降低氧化应激损伤[5-7]。但关于大黄酸在MS的相关研究较少。本实验参照文献[8]制备EAE小鼠模型的方法并加以改进,采用髓鞘少突胶质细胞糖蛋白35-55(Myelin oligodendrocyte glucoprotein,MOG35-55)抗原乳剂免疫C57BL/6小鼠造模,研究EAE小鼠模型的行为学和IL-2、Foxp3转录因子(Foxp3 transcription factor,Foxp3)的水平,旨在探究大黄酸补泻和调节免疫反应的作用机制,为补泻兼施治疗MS提供理论依据。
1 材料与方法
1.1实验材料 SPF小鼠(7~10周龄,体重17~23 g)购自第四军医大学实验动物中心;MOG35-55购自南京金斯瑞生物技术有限公司;完全弗氏佐剂、百日咳毒素、大黄酸购自美国Sigma公司;IL-2酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)检测试剂盒、Foxp3羊抗鼠单克隆抗体购自武汉博士德生物工程有限公司;β肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶标记的鼠抗羊二抗购自北京中杉金桥公司;离心机购自美国Beckmen公司;蛋白质印迹法(Western blot)检测仪器购自美国Bio-Rad公司。
1.2实验方法
1.2.1EAE模型的制备 SPF小鼠单独饲养在18~25℃、湿度为60%左右的环境中,自由采食和饮水。无菌纯水将抗原MOG35-55稀释为10 mg/ml,再加入PBS稀释为2 mg/ml,与等量的完全弗氏佐剂混合均匀,在冰上制成油包水状抗原乳剂。对照组则为等量的完全弗氏佐剂与PBS混合均匀。模型制备前,采用水合氯醛麻醉小鼠,吸取200 μl抗原乳剂分别皮下注射于小鼠背部两侧4个部位,免疫当天和48 h后经腹腔注射100 μl百日咳毒素。对照组皮下注射完全弗氏佐剂与PBS混合液,其余处理相同。
1.2.2实验分组与处理 实验小鼠随机分为对照组、模型组、给药组1、给药组2、给药组3,每组18只小鼠。模型制备当天给药组分别腹腔注射大黄酸5、10、20 mg/kg,对照组和模型组给予等量的生理盐水,连续给药30 d。
1.2.3EAE模型的评价 从免疫当天起,观察小鼠的发病率、死亡率,并进行临床评分。按照目前国际公认的临床评分标准进行评分:0分:正常;1分:鼠尾无力或张力障碍;2分:单肢部分麻痹或步态蹒跚;3分:单肢完全麻痹;4分:双肢完全麻痹;5分:濒临死亡或死亡。
1.2.4采集样本 选取EAE模型小鼠以及对照组第14天、20天、30天处死动物,每次取6只小鼠10%水合氯醛经腹腔注射后,将小鼠固定于鼠板上,剪开胸腔,排空血液,取小鼠脑、脊髓,暂放于液氮中保存,随后置于-80℃冰箱中保存。
1.2.5检测细胞因子IL-2的含量 采用酶联免疫吸附法检测细胞因子IL-2水平的变化,根据检测试剂盒说明书进行检测,在酶标仪中读取450 nm波长的OD值,根据标准曲线找到相应浓度。
1.2.6蛋白质印迹法检测Foxp3蛋白的表达量 称取小鼠脑组织的重量,按照1∶9的比例加入组织裂解液,在组织匀浆器中进行3次匀浆,并及时加入冰水降温,匀浆结束后置于冰上孵育20 min,4℃离心,取上清。吸取BCA 工作液A液和B液与蛋白样品以1∶8 的比例混合,室温孵育60 min,酶标仪上测定蛋白质的浓度。将蛋白样品与5×样品缓冲液混合,调整蛋白样品的浓度为4 mg/ml,100℃煮沸变性 5 min。根据目的蛋白分子量配置12%的分离胶和5%浓缩胶。每孔取20 μg蛋白样品,设定浓缩胶电压为90 V,电泳20 min,分离胶电压为160 V,以蛋白标准品的条带迁移确定电泳时间。将提前组装好的转膜装置置于电泳槽中,300 mA恒定电流转膜60 min。将携带目的蛋白质的膜完全浸没在3%胎牛血清-TBST溶液中,摇床中室温封闭30 min。加入采用3%胎牛血清-TBST稀释的一抗,室温静置10 min,4℃过夜。次日取出膜,室温静置30 min,TBST洗膜5次×3 min,加入5%脱脂奶粉-TBST稀释的二抗,摇床中室温孵育40 min,TBST洗膜6次×3 min,化学发光试剂ECL加入膜上反应3~5 min,暗室中曝光10 s~5 min,显影2 min。以β-actin作为内参,分析蛋白质的表达量。

2 结果

2.2小鼠临床评分的变化 对照组小鼠未出现临床症状,临床评分为0;各组小鼠免疫后14~15 d开始发病,20~25 d达到高峰期,26~30 d症状有所缓解,如表1所示,与模型组相比,给药组1、给药组2、给药组3在第20天(t1=39.250,P1=0.000;t2=34.889,P2=0.000;t3=34.017,P3=0.000 )和30 d(t1=30.889,P1=0.000;t2=21.488,P2=0.000;t3=14.773,P3=0.000 )之间差异显著;与给药组1相比,给药组2、给药组3在第30天间差异显著(t1=9.401,P1=0.000;t2=16.116,P2=0.000 )。
2.3小鼠脑组织中细胞因子IL-2的变化 结果如表2所示,模型组脑组织中IL-2的表达水平在实验过程中均显著高于对照组(t1=25.948,P1=0.000;t2=44.002,P2=0.000;t3=23.702,P3=0.000 );给药组1、给药组2、给药组3在第20天(t1=7.508,P1=0.000;t2=22.724,P2=0.000;t3=21.391,P3=0.000 )和第30天(t1=7.709,P1=0.000;t2=11.655,P2=0.000;t3=14.395,P3=0.000 )脑组织中IL-2的表达水平显著高于对照组,显著低于模型组;与给药组1相比,给药组2、给药组3在第20天(t1=15.217,P1=0.000;t2=13.884,P2=0.000 )和第30天(t1=3.946,P1=0.000;t2=6.686,P2=0.000 )显著升高。
2.4小鼠脊髓组织中细胞因子IL-2的变化 结果如表3所示,模型组脊髓组织中IL-2的表达水平在实验过程中均显著高于对照组(t1=15.188,P1=0.000;t2=41.499,P2=0.000;t3=32.890,P3=0.000 );给药组1、给药组2、给药组3在第14天(t1=9.837,P1=0.000;t2=11.912,P2=0.000;t3=13.348,P3=0.000)、第20天(t1=23.453,P1=0.000;t2=32.544,P2=0.000;t3=33.139,P3=0.000 )和第30天(t1=14.668,P1=0.000;t2=21.647,P2=0.000;t3=23.679,P3=0.000 )脊髓组织中IL-2的表达水平显著高于对照组,在第20天和第30天显著低于模型组;与给药组1相比,给药组2、给药组3在第20天(t1=9.091,P1=0.000;t2=9.686,P2=0.000 )和第30天(t1=6.979,P1=0.000;t2=9.011,P2=0.000 ) IL-2表达水平显著升高。


Groups14 d20 d30 dModel group0.35±0.063.50±0.231.70±0.15Administration group 10.33±0.091.25±0.141)0.55±0.091)Administration group 20.18±0.061)1.50±0.171)0.90±0.071)2)Administration group 30.23±0.081)1.55±0.131)1.15±0.121)2)F21.760660.355337.876P0.0000.0000.000
Note:Compared with the model group,1)P<0.05;compared with the administration group 1,2)P<0.05.
2.5小鼠Foxp3蛋白的表达量变化 结果如表4、图1所示,模型组脑组织中Foxp3蛋白的表达量在第20天、第30天均显著低于对照组(t1=2.429,P1=0.017;t2=19.536,P2=0.000;t3=15.276,P3=0.000 );给药组2(t1=9.768,P1=0.000;t2=6.018,


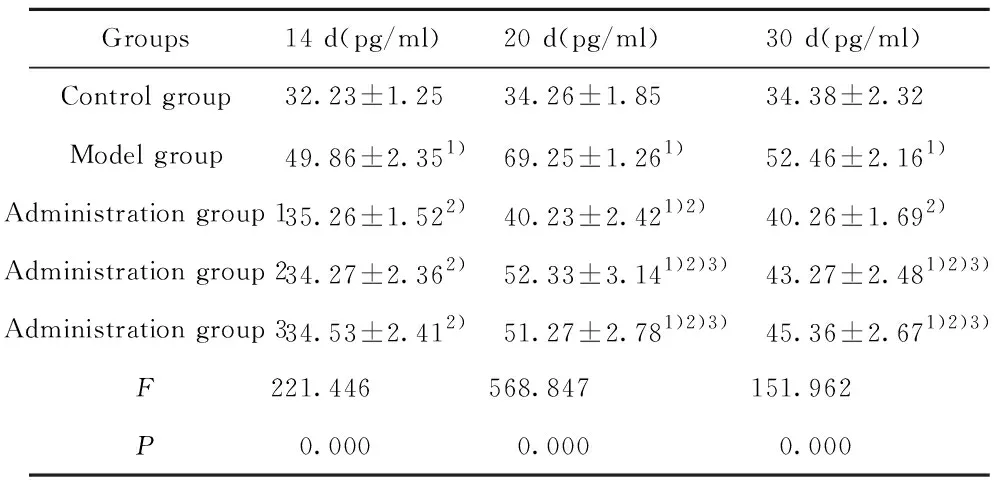
Groups14 d(pg/ml)20 d(pg/ml)30 d(pg/ml)Control group32.23±1.2534.26±1.8534.38±2.32Model group49.86±2.351)69.25±1.261)52.46±2.161)Administration group 135.26±1.522)40.23±2.421)2)40.26±1.692)Administration group 234.27±2.362)52.33±3.141)2)3)43.27±2.481)2)3)Administration group 334.53±2.412)51.27±2.781)2)3)45.36±2.671)2)3)F221.446568.847151.962P0.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05;compared with the administration group 1,3)P<0.05.


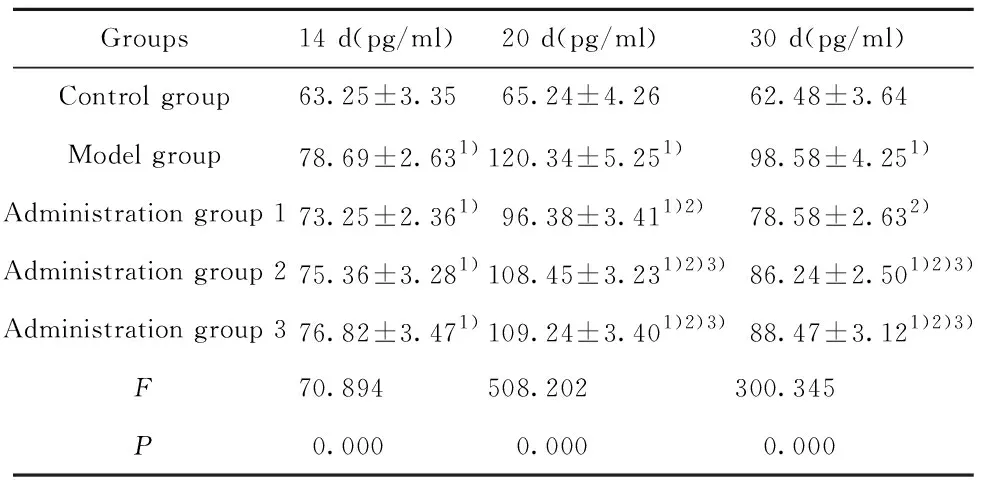
Groups14 d(pg/ml)20 d(pg/ml)30 d(pg/ml)Control group63.25±3.3565.24±4.2662.48±3.64Model group78.69±2.631)120.34±5.251)98.58±4.251)Administration group 173.25±2.361)96.38±3.411)2)78.58±2.632)Administration group 275.36±3.281)108.45±3.231)2)3)86.24±2.501)2)3)Administration group 376.82±3.471)109.24±3.401)2)3)88.47±3.121)2)3)F70.894508.202300.345P0.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05;compared with the administration group 1,3)P<0.05.


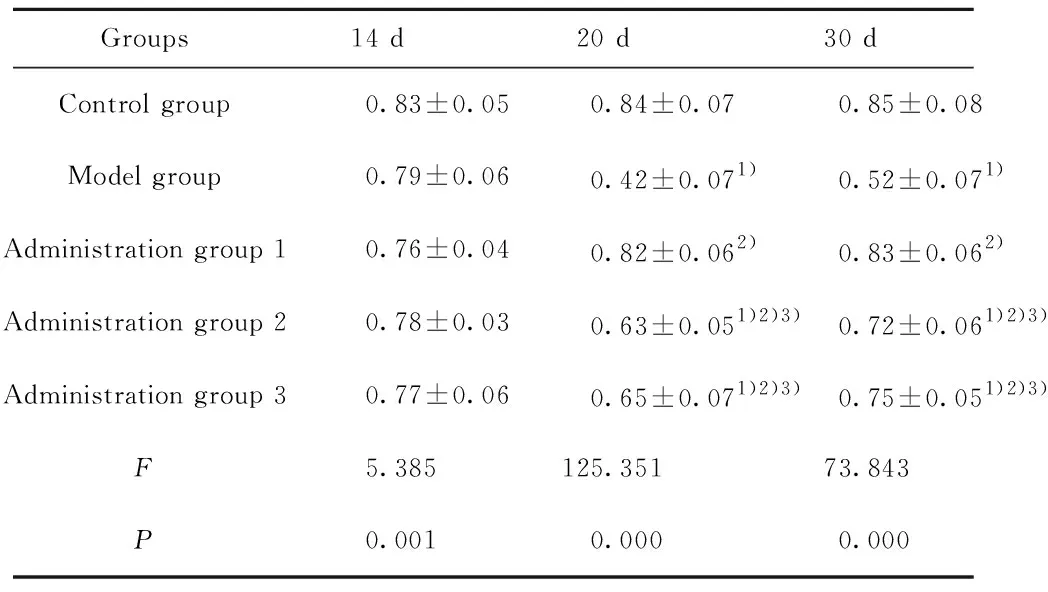
Groups14 d20 d30 dControl group0.83±0.050.84±0.070.85±0.08Model group0.79±0.060.42±0.071)0.52±0.071)Administration group 10.76±0.040.82±0.062)0.83±0.062)Administration group 20.78±0.030.63±0.051)2)3)0.72±0.061)2)3)Administration group 30.77±0.060.65±0.071)2)3)0.75±0.051)2)3)F5.385125.35173.843P0.0010.0000.000
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05;compared with the administration group 1,3)P<0.05.

图1 小鼠脑组织中Foxp3蛋白的表达量变化Fig.1 Changes of Foxp3 protein level in brain tissue of mice
P2=0.000)、给药组3(t1=8.838,P1=0.000;t2=4.629,P2=0.000 )在第20天和第30天脑组织中Foxp3蛋白的表达量显著低于对照组,显著高于模型组;与给药组1相比,给药组2、给药组3在第20天(t1=8.838,P1=0.000;t2=7.907,P2=0.000 )和第30天(t1=5.092,P1=0.000;t2=3.703,P2=0.000 ) Foxp3蛋白的表达量显著降低。
3 讨论
EAE是敏感实验动物产生的自身免疫性疾病,以中枢神经炎性细胞浸润和脱髓鞘为特征,与人类多发性硬化的病理症状极为相似,因此常被用于研究多发性硬化的发病机制和治疗方案的动物模型。EAE通过在敏感动物体内注射特异性的抗原与完全弗氏佐剂混合液主动免疫诱导,或转移致敏性髓鞘成分的肽段的CD4+T淋巴细胞过继免疫诱导。MOG35-55抗原乳剂免疫C57BL/6小鼠诱导EAE的产生,其病理损伤与MS极为相似。MOG是一种由少突胶质细胞和髓鞘膜分泌的跨膜糖蛋白,细胞膜外区域含有3个致脑炎抗原决定簇,其中MOG35-55多肽是MOG蛋白胞外区最外边的致脑炎抗原决定簇,极易受到攻击。实验证明,MOG是目前唯一的既能诱导T细胞发生反应又能促进脱髓鞘抗体反应的蛋白[9],因此被广泛应用于致脑炎性髓鞘动物模型中。C57BL/6小鼠遗传背景清晰,繁殖能力较强,因此常被用于研究基因工程等领域的动物模型。
大黄是一种临床常用药,具有退热、泻下、抗炎作用,其活性成分之一是大黄酸,是广为人知的局部和系统抗菌类药物。研究显示大黄酸同样具有显著的抗菌作用,可阻碍经典Th1细胞分泌抗炎相关因子[10]。实验发现大黄酸可抑制相应靶蛋白的表达从而阻碍炎症信号通路的传播,降低下游靶基因的表达,从而发挥抗炎作用[11]。研究证明,大黄酸由于微环境的差异,在脂多糖诱导细胞的不同时期既表现出抗炎的作用又发挥促炎作用[12]。在本研究中,给予EAE小鼠模型不同剂量的大黄酸可有效降低小鼠的发病率;临床评分结果显示模型组小鼠的评分显著高于给予不同剂量的大黄酸的小鼠,其中给予5 mg/kg大黄酸的EAE小鼠评分显著降低,提示大黄酸对EAE小鼠具有显著治疗效果,其中小剂量治疗作用最佳。
Th0是一种未完全分化的细胞,其分化受细胞局部微环境细胞因子的调节[13]。IL-12和干扰素γ因子可促进Th0细胞分化形成Th1细胞,分泌Th1型细胞因子比如IL-2和肿瘤坏死因子β,主要参与细胞的免疫应答反应,增强细胞的吞噬作用、细胞毒功能等[14,15]。其中IL-2还可刺激细胞毒性T细胞的活化。Foxp3是调控Treg细胞分化和功能的关键因素[16]。研究表明,诱导CD4+T淋巴细胞表达Foxp3可引起Treg免疫抑制反应,表明Foxp3是免疫抑制反应的主要调节基因[17,18]。在本实验中,模型组小鼠在第20天和第30天脑、脊髓组织中分泌的IL-2显著增加,脑组织中Foxp3表达量显著降低;给予不同剂量的大黄酸可降低EAE小鼠脑、脊髓组织中的IL-2水平,上调Foxp3表达量,小剂量的作用效果相对显著,提示小剂量大黄酸可能通过抑制IL-2水平和促进Foxp3表达量,诱导炎症反应,从而发挥调节免疫的功能。
综上所述,小剂量大黄酸对EAE小鼠的治疗效果最佳,其作用机制可能是通过抑制IL-2水平、促进Foxp3表达量,从而发挥调节炎症反应和免疫功能,为MS的治疗提供新的思路和科学依据。

