肌纤维类型分类及转化机理研究进展
梁婷玉,吴建平,2,*,刘 婷,柏 妍,张 瑞
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730000;2.甘肃省农业科学院,甘肃 兰州 730000)
随着生活水平的提高,人们对于食品的需求已从基本的量的需求上升到对于营养均衡和高品质的要求,因此对肉类食品品质的要求也在不断提升。肉品质主要由其本身的形态结构及化学组成决定,肌纤维作为组成肌肉的基本单位,其生长发育及类型组成是影响畜禽生长发育和肉品质的重要因素之一[1]。根据肌纤维形态、代谢酶活性、收缩速率及肌球蛋白重链(myosin heavy chain,MyHC)亚型等可对肌纤维类型进行差异区分。随着分子生物学的蓬勃发展,骨骼肌肌纤维的分型方法也在不断改进和演变。从最初的基于形态机能的分类法逐渐发展到肌原纤维ATP酶染色法、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electropheresis,SDS-PAGE)法和免疫组化法等。恰当的肌纤维分型方法对肌纤维特性及肉产品品质研究至关重要,而不同的分类方法在不同条件下的应用会存在一定的局限性,如实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)适用于对肌肉中4 种MyHC表达的定量分析,SDS-PAGE可用于微量的单个肌纤维类型鉴定[2]。动物出生后,其肌纤维数目已经确定,但类型组成并非固定不变,肌纤维类型保持高度可塑性[3],一些外界因素,如营养水平、个体的运动状态以及环境和年龄等,均可影响肌纤维类型的转化。肌纤维类型的转化也受机体内多种信号通路及调控因子等内在因素的调控[4]。本文主要从肌纤维类型的分类方法及转化影响因素两方面进行阐述。
1 肌纤维类型的分类
肌纤维类型的研究已经有近百年的历史。早期的分类方法是基于肌纤维形态结构的分类,随着各种先进生物技术的相继产生和广泛应用,肌纤维分类也逐渐发展到肌原纤维ATP酶染色法、SDS-PAGE法、qRT-PCR法和免疫组化法等。
1.1 基于肌纤维形态和功能特性的分类
骨骼肌肌纤维高度分化,根据生理功能、组织化学和形态结构可将其分为不同的类型。早在1873年,Ranvier根据肉色提出将骨骼肌划分为红肌和白肌2 种类型[5]。Berri等[6]研究发现,肌肉色泽与肉品质及动物生长性能有关,高比例的红肌纤维在一定程度上代表较好的肉品质,红肌纤维比例相对较高的肉色泽鲜亮、肉质细嫩,而高比例的白肌纤维则更多地代表较强的生长性能。
根据电刺激后肌纤维的收缩特性,将肌纤维分为慢速收缩型(Ⅰ型)和快速收缩型(Ⅱ型)[7],该分类方法将肌纤维类型与机能相关联。随着科学技术的发展,大量研究人员根据肌纤维代谢类型及酶活性等生理特异性对肌纤维类型进行进一步区分。根据代谢酶系活性的相对大小,将Ⅱ型肌纤维分为Ⅱa型(快速氧化型)、Ⅱb型(快速酵解型)和Ⅱx型(中间型)。根据骨骼肌的代谢类型可将肌纤维分为慢收缩氧化型(slow oxidative,SO)、快收缩氧化型(fast oxidative,FO)、快收缩氧化酵解型(fast oxido-glycolytic,FOG)及快收缩酵解型(fast glycolytic,FG)[8]。
1.2 基于肌球蛋白ATP酶染色法的分类
20世纪70年代,Guth-Samaha肌球蛋白ATP酶染色法建立,该方法的应用极大地推动了骨骼肌相关研究的深入与发展,并对神经性肌萎缩和肌源性肌萎缩的诊断具有重要价值[9]。1970年,Brooke和Kaiser用一系列不同pH值的缓冲液对肌纤维进行孵育,形成了一套能够将肌纤维类型分为Ⅰ、Ⅱa和Ⅱb 3 类的方法,即肌球蛋白ATP酶酸法染色(pH 4.4)和碱法染色(pH 10.4)[10]。ATP酶碱法染色可区分Ⅰ、Ⅱ 2 种肌纤维类型:Ⅰ型肌纤维较细,染色浅,呈淡蓝色;Ⅱ型肌纤维较粗,染色深,呈深蓝色。ATP酶酸法染色可进一步将Ⅱ型肌纤维区分为Ⅱa和Ⅱb型[11],该方法是目前被广泛接受的分类法之一,可较好地分辨肌肉中不同的肌纤维类型。
在ATP酶染色的基础上,结合异染性染料甲苯胺蓝可同时鉴别4 种不同肌纤维型,即为异染ATP酶染色法。该方法的基本原理是不同肌纤维ATP酶在酸性预孵育液中的活性差异导致局部磷酸钙与染料聚合体浓度不同,继而呈现染色结果的不同[12]。1990年,Ogilvie首次用异染ATP酶染色法在1 张切片上同时区分出Ⅰ、Ⅱa、Ⅱb和Ⅱx 4 种肌纤维[13]。异染ATP酶染色法是通过生理机能来区分肌纤维类型,而不是通过MyHC亚型蛋白的差异表达。
除ATP酶外,也可以利用其他肌纤维酶进行肌纤维分类。朱道立[14]利用琥珀酸脱氢酶染色法(依据肌纤维氧化能力)及烟酰胺腺嘌呤二核苷酸-四唑还原酶染色(依据肌纤维酵解能力)等组织化学染色方法来区分肌纤维,但这2 种染色方法影响因素较多,染色结果不稳定,如运动可使琥珀酸脱氢酶活性增强,从而导致染色结果不稳定。
1.3 基于MyHC的分类
收缩蛋白和代谢蛋白结构与功能的多样性决定了骨骼肌肌纤维功能的差异性。作为骨骼肌主要的收缩蛋白,肌球蛋白分子由2 对起调节作用的肌球蛋白轻链(myosin light chain,MLC)和2 个具有三磷酸腺苷酶(ATPase)活性的MyHC组成,肌肉的收缩特性由MyHC亚型决定[9]。MyHC有4 种不同亚型(即MyHCⅠ、MyHCⅡa、MyHCⅡb和MyHCⅡx),据此可将肌纤维分为4 种类型,即Ⅰ型(慢速氧化型肌纤维)、Ⅱa型(快速氧化型肌纤维)、Ⅱb型(快速酵解型肌纤维)和Ⅱx型(中间型肌纤维)[15]。近年来,许多研究人员试图从MyHC基因表达水平不断深入研究骨骼肌纤维的组成及特性,如采用电泳法和免疫组化染色法,并取得了显著成效。
1.3.1 MyHC基因PCR检测法
MyHC基因是目前研究肌纤维类型及组成的重要分子标记。1989年,Ansved等[16]利用聚丙烯酰胺梯度凝胶电泳及MyHC单克隆抗体免疫组化等方法鉴定出一种新型肌纤维——Ⅱx型。依据MyHC的4 种不同亚型,通过电泳法可以清晰地区分单肌纤维的4 种纯合型,同时可以显示不同MyHC亚型表达的杂合肌纤维。另外,结合荧光定量检测技术可灵敏、精确地确定不同肌纤维的比例及含量,该方法相比于其他组化染色法既省时又省力[17]。
1.3.2 免疫组化染色法
免疫组织化学染色即抗原与抗体的特异性结合,通过荧光素、酶等化学反应中抗体标记显色剂显色来对组织细胞中的抗原(多肽和蛋白质)进行定位和定量分析。而对于肌纤维分型研究,是根据肌纤维类型找到各类型肌纤维所对应的抗体,从而将其区分开[18]。相对于前文中的各方法,该方法的针对性和精确性均较高,也可以避免ATP酶染色法的缺陷。特异性抗体进行单独免疫染色可以识别特定类型的肌纤维。在大鼠中已确定出与Ⅰ、Ⅱa、Ⅱb和Ⅱx 4 种肌纤维对应的单克隆抗体分别为BAF8、A4.74、BF-F3和BF-35[19]。Wu等[20]使用上述抗体分别对大鼠胫骨前肌和比目鱼肌的Ⅰ、Ⅱa、Ⅱb和Ⅱx型肌纤维进行免疫酶染色,4 种纤维染色结果依次为深灰色、深棕色、深红色和不被染色或被染为淡棕色。但该免疫染色法需要多个连续组织切片才可以鉴定肌肉组织中所有的肌纤维类型,因此该方法工作量大,操作过程繁琐。早在1968年,Nakane[21]就提出多重免疫组化染色法,该方法能够在同一张肌肉切片上同时鉴别出所有的肌纤维类型,如三联免疫荧光染色(triple immunofluorescence staining,TIF)和三联免疫酶染色(triple immunoenzyme staining,TIE)。TIF是基于MyHC蛋白的差异表达来区分不同类型肌纤维及其横截面积。Babcock等[22]用免疫荧光染色法鉴定大鼠胫骨前肌肌肉中的4 种肌纤维,同时研究同一区域中肌肉生长抑制素和激活素受体(actRⅡB)的表达,结果表明,采用TIF对慢性御载后肌纤维类型特异性萎缩反应的研究结合基本差干涉对比成像系统可以有效区分肌纤维类型间蛋白的差异表达,也表明该技术可以在空间上分辨细胞核、卫星细胞和间质细胞,以评估其在御载后肌肉特异性萎缩反应中的潜在作用。相比于TIF,TIE更具优势。TIE能够更好展示肌纤维的形态特征和组织结构,其以免疫反应为基础的染色经过很长时间也不会褪色;另外,该方法能够弥补TIF法对基底膜不能清晰区分的缺陷,尤其是在Ⅱx型肌纤维存在的条件下[23]。Wu等[20]确立了一种新型的特异性TIE法,该方法对大鼠正常胫骨前肌、比目鱼肌、不同程度下去神经支配和神经再支配后胫骨前肌和比目鱼肌中的肌纤维类型及比例进行了较为精确的分析,同时鉴定出杂合型肌纤维Ⅱa/Ⅱx型、Ⅱb/Ⅱx型和ⅠC(Ⅰ/Ⅱa)型。Sawano等[24]提出一步四重免疫染色法,该方法摒弃了二级抗体的使用,仅用4 种初级抗体的混合物就可以在1 张切片上有效染色并区分出4 种肌纤维类型,该方法能够应用于由环境因素等诱导肌纤维类型转化的检测。
尽管肌纤维因分类方法多样而命名各异,但不同肌纤维之间存在一定的相关性,如SO型肌纤维即为Ⅰ型,FO型肌纤维为Ⅱa型,FG型肌纤维为Ⅱb型,FOG型肌纤维为Ⅱx型[25]。但不同分类方法所确定的肌纤维类型之间是否存在完全对应关系还有待进一步研究。
以上所列举的基于组织化学染色的方法不需要特异性抗体,故成本较低,染色结果直观、清晰,但缺点是结果不够精确,重复性差,且耗时耗力。异染ATP酶法效果较优,但也存在一定的局限性:对pH值和温度变化敏感,随着时间的延长,ATP酶活性逐渐减弱,不能对严重萎缩的肌纤维进行染色[26]。多重免疫染色能够克服这些不足,该方法在鼠类等啮齿类动物的肌纤维分型中应用更为成熟。
不同类型肌纤维的形态特征、收缩性能等生理生化特性具有显著差异。肌纤维的形态和生理特征指标包括肌纤维数量、肌纤维直径、肌纤维长度和肌纤维类型[27]。不同肌纤维类型酶活性的不同决定了其代谢性能的差异。由于Ⅰ型肌纤维含有较高活性的有氧代谢酶(琥珀酸脱氢酶、细胞色素氧化酶等)、线粒体含量高,而ATP酶活性较低(与收缩强度相关),故收缩慢而持久。相反,Ⅱb型肌纤维中ATP酶和糖酵解酶系活性高、糖原含量高,而线粒体含量少、有氧代谢酶活性低,故收缩快但不持久[28]。相比于Ⅰ型肌纤维,Ⅱb型肌纤维直径大、血管化程度低、ATP酶活性较高、抗疲劳性较弱。Ⅱx型纤维特征与Ⅱb型接近,但其收缩速率略低,氧化代谢程度较高。Ⅱa型纤维在收缩和代谢方面介于Ⅱx和Ⅰ型之间[29]。4 种肌纤维类型的氧化能力由高到低依次为Ⅰ型>Ⅱa型>Ⅱx型>Ⅱb型,肌纤维收缩速率表现为Ⅰ型<Ⅱa型<Ⅱx型<Ⅱb型。
2 肌纤维类型转化及调控因素
一般认为肌纤维总数在动物出生后基本保持不变,但肌纤维类型在生长过程中持续相互转化,且其转化是环境等外界因素和机体内部因子协同调控的结果。动物出生时几乎没有酵解型肌纤维,主要以氧化型肌纤维为主。一些肌纤维在生长过程中具有由氧化型向酵解型转化的能力,一些后天因素会导致肌纤维类型整体由氧化型向酵解型转化,且早期生长阶段是肌纤维类型转变的重要阶段[30]。肌纤维在年龄、营养、环境等多种因素影响下发生表型转化,以适应外界环境的要求,将这些外界因素区分为营养因素和非营养因素。机体内部调控因子主要为机体信号通路及相关细胞因子。Dingboom等[31]认为,肌纤维类型的转化次序为慢肌向快肌转化,快肌向中间型快肌转化,最终转化为白肌。总体来说肌纤维转化遵循Ⅰ型↔Ⅱa型↔Ⅱx型↔Ⅱb型[32]。
2.1 营养因素
肌肉发育的基础保障便是营养水平,肌纤维生长发育及类型组成受动物出生前后营养水平的影响[33]。动物出生前妊娠母体的营养水平对其肌纤维有调控作用。在胚胎肌纤维形成前,降低母体营养水平会使羔羊背最长肌和骨外侧肌的快肌纤维显著减少,慢肌纤维明显增加,而在妊娠后期降低母羊营养水平对羔羊肌纤维数量无影响[34]。出生后幼畜的营养水平对肌纤维类型转化也有重要影响。Fahey等[35]对禁食条件下(断食不断水24 h)不同代谢类型肌肉肌纤维类型组成的研究结果表明,比目鱼肌和腓肠肌中MyHCⅠ mRNA表达显著提高,而趾长伸肌则无显著影响。而长期营养不良会导致趾长伸肌中Ⅱa/Ⅱx型纤维比例提高,Ⅱb型纤维的比例降低[33]。综上所述,营养不足会导致肌纤维类型由快速酵解型向慢速氧化型或中间型转化。
饲粮中能量水平、蛋白质、脂肪酸和天然饲料添加剂等营养组分的含量及其原料来源均会引起肌纤维类型转化。高能量饲粮可以提高肉中Ⅱa型和Ⅱx型肌纤维的比例,降低Ⅱb型肌纤维的比例[36]。Li Yinghui等[37]发现,饲粮中蛋白质水平由16%降至13%时,育肥猪背最长肌和腰大肌Ⅱa型肌纤维和股二头肌中Ⅰ型肌纤维的比例显著升高。低淀粉、高纤维饲粮可降低Ⅱb型肌纤维的比例[38]。
作为日粮的重要组成成分,脂肪酸被动物肠道消化吸收,最终影响动物机体内肌肉发育。Eshima等[39]研究发现,长期高脂饮食(high fat diet,HFD)可能通过对肌纤维组成等形态特征的改变使小鼠快收缩肌纤维收缩能力受损;但短期的HFD无此作用。相比于饱和脂肪酸,不饱和脂肪酸可以显著降低小鼠肌肉中酵解型肌纤维的含量,提高氧化型肌纤维含量[40]。不饱和脂肪酸的种类对肌纤维类型的转化也有一定影响。小鼠饲粮中添加富含n-3多不饱和脂肪酸的鱼油可以显著增加趾伸长肌中Ⅱx型肌纤维的比例,显著降低Ⅱb型肌纤维的比例[41]。共轭亚油酸可以改变体外培养的猪肌纤维类型组成,且主要表现为提高Ⅰ和Ⅱa型肌纤维比例,显著降低Ⅱx和Ⅱb型肌纤维比例[42]。天然提取物中的多酚类物质可以提高骨骼肌中腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的磷酸化程度,进而促进过氧化物酶受体增殖激活受体γ(peroxisome proliferator-activated receptors-γ,PPAR-γ)辅助激活因子-1α(PPAR-γ coactivator 1α,PGC-1α)磷酸化并活化,推测天然植物提取物可能通过调节AMPK途径调控肌纤维类型的转化[43]。白藜芦醇作为一种植物类多酚化合物,能够诱导氧化型肌纤维的表达,而抑制酵解型肌纤维的表达[44]。饲粮中添加5%苹果酸多酚可以提高小鼠肌肉中慢肌纤维的比例[45]。但也有研究表明,营养因素对肌纤维类型的转化无显著影响。日粮中添加中草药对育肥猪肌纤维类型比例无显著影响[46]。因此,营养可能因动物物种、个体年龄、体质量及肌肉部位等因素的差异而对骨骼肌肌纤维类型组成产生不同影响。
2.2 非营养因素
肌纤维是动态学结构,随着生理环境的变化,其类型组成也在不断改变。在动物生长发育阶段,随着年龄的增加,氧化型肌纤维比例减少,酵解型肌纤维比例升高[47]。大量研究表明,品种、性别、年龄和部位等因素对动物肌肉肌纤维类型组成的影响较大,但品种和组织部位是影响肌肉纤维类型组成的最主要因素[48]。品种间肌纤维类型、数目及特性存在显著差异,早在1985年,Esséngustavsson等[49]就发现,与瑞典约克郡猪相比,汉普夏猪背最长肌和臀中肌的氧化能力更强。因肌肉部位的不同,品种对肌纤维含量的影响也不同[50]。苏琳等[51]研究发现,苏尼特羊肱二头肌Ⅰ型肌纤维数量比例、面积比例及Ⅱa型肌纤维的面积比例均显著小于巴美肉羊,表明对于特定部位的肌肉,肌纤维类型组成受遗传因素的极大影响。性别对肌纤维类型分布的影响有种属特异性[52]。随着年龄的增长,所有类型肌纤维的横截面积逐渐增大,不同类型的肌纤维增长速率不同,当生长到一定阶段时,氧化型肌纤维开始向酵解型肌纤维转化[53]。
除上述影响因素外,外界刺激和运动等对肌纤维类型组成也至关重要。高温应激会诱导Ⅰ型肌纤维向Ⅱ型肌纤维转化[54]。运动对肌纤维类型的影响包括运动方式、运动强度等[55]。关于运动对肌纤维类型转化的影响观点不一,目前还没有形成一致的结论。任阳[28]的研究表明,经有氧运动后,动物骨骼肌的氧化能力明显提高,并可以诱导酵解型肌纤维向氧化型转化(Ⅱb型或Ⅱx型向Ⅱa型转化)。长期高强度间歇训练课能够提高SD小鼠快肌中Ⅰ型、Ⅱa型肌纤维及慢肌中Ⅰ型肌纤维的比例[56]。运动引起的肌纤维类型转变与原来肌肉组织中肌纤维类型的组成密切相关,而运动等外界因素对肌纤维转化的调控需通过一系列生物学通路来实现。
2.3 信号通路及细胞因子
肌纤维类型间的相互转化受复杂的生物学通路调节。由于骨骼肌的高度可塑性,机体在自然生长发育或受到某些生理变化、病理刺激和应激时,细胞内相关的信号通路就会发生改变,调节肌纤维特异性基因的表达,进而诱发肌纤维类型的转化[57]。这些特异性的变化涉及肌节中MyHC和轻链结构表达的修饰以及神经肌肉去极化等[58]。肌纤维类型转化过程的信号通路主要包括Ca2+信号通路、AMPK信号通路和PGC-1α信号通路等。
2.3.1 Ca2+/CaN信号通路
骨骼肌中的Ca2+依赖转运途径对肌纤维转化起重要作用,其可通过激活转录因子调节线粒体核编码的基因,使肌纤维类型发生转化[59]。细胞内的Ca2+分为游离钙和结合钙,只有当Ca2+与底物蛋白结合时才能发挥其作用[60-61]。存在于细胞质中的钙蛋白酶水解系统,即钙蛋白酶(包括μ-calpain和m-calapain)和钙蛋白酶抑制蛋白(calpastatin),受Ca2+浓度调节,在肌纤维生长和降解过程中起决定性作用。Felicio等[62]的研究表明,鸡肉中的钙蛋白酶基因与肌纤维组成及生长性状显著相关。Moyen等[63]的研究表明,编码μ-calpain蛋白大亚基的CAPN1基因参与肌细胞分化和肌纤维形成过程。敲除CAPN1基因会影响肌纤维的组成比例。高强[64]研究发现,敲除CAPN1基因小鼠的Ⅱb型肌纤维比例显著高于野生型小鼠。CAPN1基因可能参与鸡骨骼肌纤维类型的转化[65]。位于细胞质中的钙调神经磷酸酶(calcineurin,CaN)受Ca2+/钙调蛋白活化,可以调节肌纤维类型特异性基因的表达,从而改变肌纤维表型。不同肌纤维中Ca2+浓度不同,故CaN会被不同程度的激活,活化CaN通路,慢肌纤维特异性基因启动子的活性选择性上调,进一步实现由快肌向慢肌的转化[66]。
2.3.2 AMPK信号通路
AMPK是平衡细胞能量的重要调节激酶,被称为“细胞能量调节器”。除对肌肉能量代谢起关键调控作用外,AMPK与肌纤维类型的转化也密切相关。运动训练等外界刺激对肌纤维类型转化的影响可能通过AMPK代谢途径来实现。辛雪等[40]的研究表明,氧化型肌纤维含量高的金华猪肌肉中AMPK显著高表达,揭示了AMPK与猪肌纤维组成密切相关。AMPK受多种代谢因子的调节,如抑癌基因FLCN及其伴侣分子FLCN相互作用蛋白1(FNIP1)复合物FLCN-FNIP1可负向调控AMPK活性[67]。AMPK经磷酸化激活后会调控其下游通路PGC-1α、NAD+/NADH等,进而影响MyHC基因的表达,改变肌纤维类型[68]。AMPK的磷酸化水平受高浓度ATP引起的上游激酶磷酸化和蛋白质磷酸酶抑制去磷酸化作用影响[69]。
2.3.3 PGC-1α信号通路
转录因子与辅因子是联系肌纤维类型与机体运动能力的关键。PGC-1α是参与线粒体生物合成、能量代谢和糖脂代谢等过程的多功能转录调节因子。PGC-1α基因表达可诱导Ⅱx型肌纤维向Ⅰ型肌纤维转化[70]。PGC-1α基因可以通过多种信号途径调控畜禽骨骼肌肌纤维类型的转化。Yamaguchi等[71]研究发现,PGC-1α基因的表达可以使人的肌纤维由快肌向慢肌转化,鸡胸肌中部分Ⅱb型肌纤维向Ⅱa型转化。束婧婷等[72]研究发现,PPARGC1A基因能够与钙离子信号通路相关基因协同作用,改变鸡肌纤维组成。PGC-1α基因可能通过PGC-1α/MEF2、PGC-1α/HIF2α、PGC-1α/PPAR-δ等途径影响肌纤维转化,且其表达具有导向性[73]。Zhang Lin等[74]研究发现,骨骼肌PGC-1α基因过表达通过提高线粒体呼吸作用及脂肪酸氧化作用,诱导小鼠和猪肌纤维组成发生变化,其研究结果表明,相比于野生型,PGC-1α转基因猪腓肠肌中Ⅰ型肌纤维的含量显著增加,转基因小鼠腓肠肌Ⅱa型肌纤维的含量显著减少,表明PGC-1α基因的过表达促进了红肌纤维(氧化型肌纤维)的形成。
2.3.4 其他调控因子
调控肌纤维代谢的信号通路复杂多样,除上述通路外,还有大量通路与肌纤维转化相关,如图1所示[75]。另有部分研究证实microRNA和部分代谢因子同样是影响肌纤维类型组成的重要因素。例如,成肌纤维生长因子21(FGF21)及细胞增长因子(MEF2)等均可调控肌纤维类型的转化。郭佳[53]通过基因芯片筛选和活体基因超表达模型发现,细胞外信号调节激酶超表达后Ⅰ型肌纤维含量降低,Ⅱ型肌纤维含量升高。化朝举[76]研究表明,miR-378a在股四头肌、胫骨前肌和腓肠肌等酵解型肌纤维含量较高的肌肉中表达水平高,而在富含氧化型肌纤维的比目鱼肌中表达水平低;通过ATP酶染色发现,敲除miR-378a后氧化型肌纤维的单位面积百分比增加,从而表明miR-378a可能对快肌纤维的形成起调控作用。
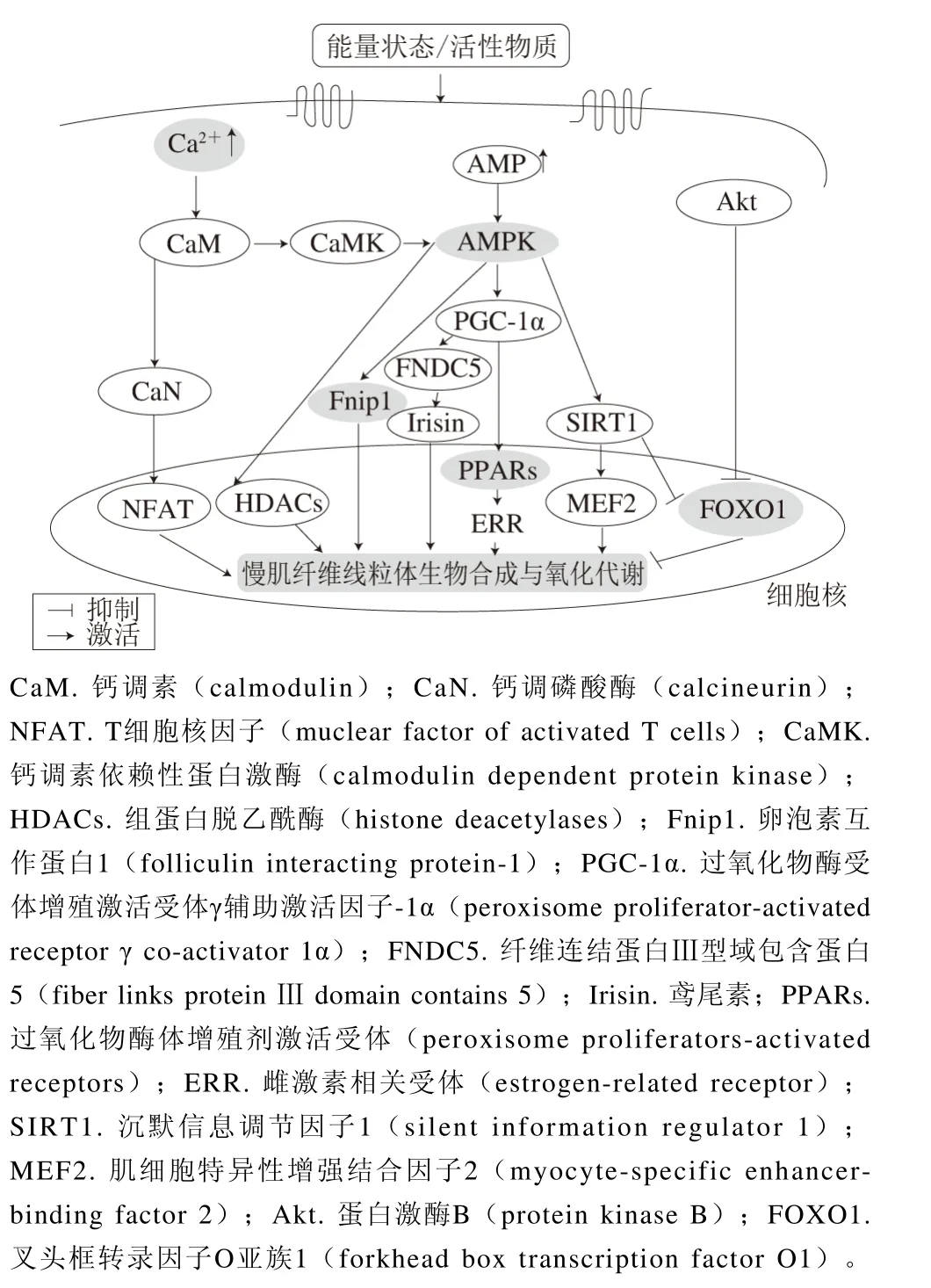
图 1 骨骼肌纤维类型转化信号通路Fig. 1 Signaling pathways of skeletal muscle fi ber transition
肌纤维转化调控因子形式多样,且不同信号通路对肌纤维类型转化的作用机理不同。但由于调控网络的复杂性,各信号通路之间不能被完全划分,而是调控因子之间相互影响、相互依存。如AMPK信号通路的激活可能与Ca2+信号通路相关;PGC-1α基因的表达受AMPK信号通路的激活或抑制的影响[77]。因此,对肌纤维类型的转换机理有待进一步深入研究。
3 结 语
随着科技的不断进步,肌纤维类型的分类方法也在不断改进与完善,为进一步深入研究各类肌纤维特性及其对肉品质的影响提供理论依据。由于肌纤维的可塑性,近年来多数研究人员通过营养调控的方式来改变骨骼肌肌纤维类型组成,进而改善畜禽肉品质。另外,从骨骼肌miRNA和卫星细胞等分子水平进一步深入研究肌纤维转化机制及影响因子是后续肌纤维研究的主要方向。本文对国内外近年来肌纤维的相关研究进行综述,简要介绍了不同肌纤维类型特性及其转化影响因素,以期为肌纤维类型特性及转化机理的研究提供参考,为精准、高效的畜牧养殖和畜禽肉质改善提供理论基础。

