构建乙氧基化磷脂稳定的油酸囊泡用作药物传输系统
王淑钰 薄纯玲 王 杰 王 轩 茅沁怡 方 云
(1. 江南大学化学与材料工程学院,2. 江南大学至善学院,江苏无锡,214000)

囊泡作为亲水性和亲脂性生物活性成分的药物传输载体已经得到广泛研究并已有实际应用。囊泡通常由天然的、可生物降解的和无毒的分子制备,除了由磷脂制备的脂质体外,脂肪酸也能够形成囊泡[1-2],且形成的囊泡是多分散的,尺寸可以从小囊泡到巨囊泡。脂肪酸比磷脂更廉价易得,因此,有作为磷脂替代品的可能,然而脂肪酸囊泡只能在很窄的pH范围内形成,因此,其在长期储存过程中的不稳定性和对周围环境的热力学敏感性,阻碍了脂肪酸囊泡作为药物传输系统的适用性和有效性。由非离子表面活性剂形成的非离子囊泡虽然稳定[3],但囊泡粒径较难控制且原料昂贵[4]。Teo[5]等人证实各种不饱和脂肪酸均能形成脂肪酸囊泡,最近Suk[6]等人发现:如果将脂肪酸囊泡的理念与非离子囊泡的理念相结合,仅需将少量非离子囊泡的囊材乙氧基化磷脂(DOPEPEG2000)加入到大量脂肪酸囊泡的囊材油酸(OA)中就能形成稳定且粒径较大的囊泡,这在药品和日用化学品工业中具有应用价值。
1 DOPEPEG2000/OA复合脂质体

图1 不同pH值下OA的相变曲线
图1为OA在不同pH下的相变曲线及形貌图[6],以此确定OA囊泡存在的主要pH区域。在pH高于10的情况下,相邻的羧酸基团之间的离子排斥使油酸钠呈澄清溶液;而加入HCl降低溶液的pH后,OA的羧酸基团开始质子化并降低了静电斥力;当溶液的pH逐渐接近OA的pKa(9.39)时,大约一半的羧酸基团被质子化,故使溶液变得浑浊。质子化的和电离的羧酸基团之间的氢键作用使其随后自发形成OA囊泡的双层膜。溶液pH在8.00~10.00之间时,通过光学偏光显微镜(OPM)和高分辨透射电子显微镜(HR TEM)观察OA囊泡。根据中和终点计算OA的pKa。当向溶液中加入过量的HCl时,剩余的游离羧酸盐被质子化。因此,pH在6.50~8.00时,观察到乳液液滴的出现。由于双折射效应,OPM观察到蓝色和黄色干涉色的OA囊泡。由于双层的有序分子组装,双折射效应由囊泡的不同折射率产生。图1(ai,bi和ci)显示不同pH环境中的OA。OA在不同pH下的HR TEM影像(图1 aii,bii和cii)验证了存在平均直径为100~300nm的OA囊泡。
ζ电位或表面电荷对稳定具有静脉内药物传输作用的囊泡非常重要,虽然红细胞膜带负电荷,但囊泡负电荷过强会增加被从血液系统中清除的机会。0.05mol/L磷酸缓冲液中的OA囊泡的ζ电位高达-72 mV,但随着DOPEPEG2000添量增加该绝对值急剧下降,如图2a所示。当DOPEPEG2000∶OA为0.02∶1时,ζ电位值在-30mV左右,此时DOPEPEG2000在双层中饱和,锚定在囊泡膜上长且体积庞大的聚乙二醇基团增加了对静电荷的屏蔽能力,使ζ电位不随时间的推移发生较大变化(图2b),囊泡因而不会团聚被血液清除。
如图3所示,DOPEPEG2000/OA比为0.02∶1的情况下,囊泡内/外表面的曲率减小,DOPEPEG 2000/OA囊泡的平均粒径减至最小(图3a);由于其粒径低于4000nm的毛细血管的尺寸,因而不会堵塞血流而被身体清除,且长时间内粒径稳定(图3b)。

图2 pH8.5和30℃下DOPEPEG2000/OA囊泡的ζ电位
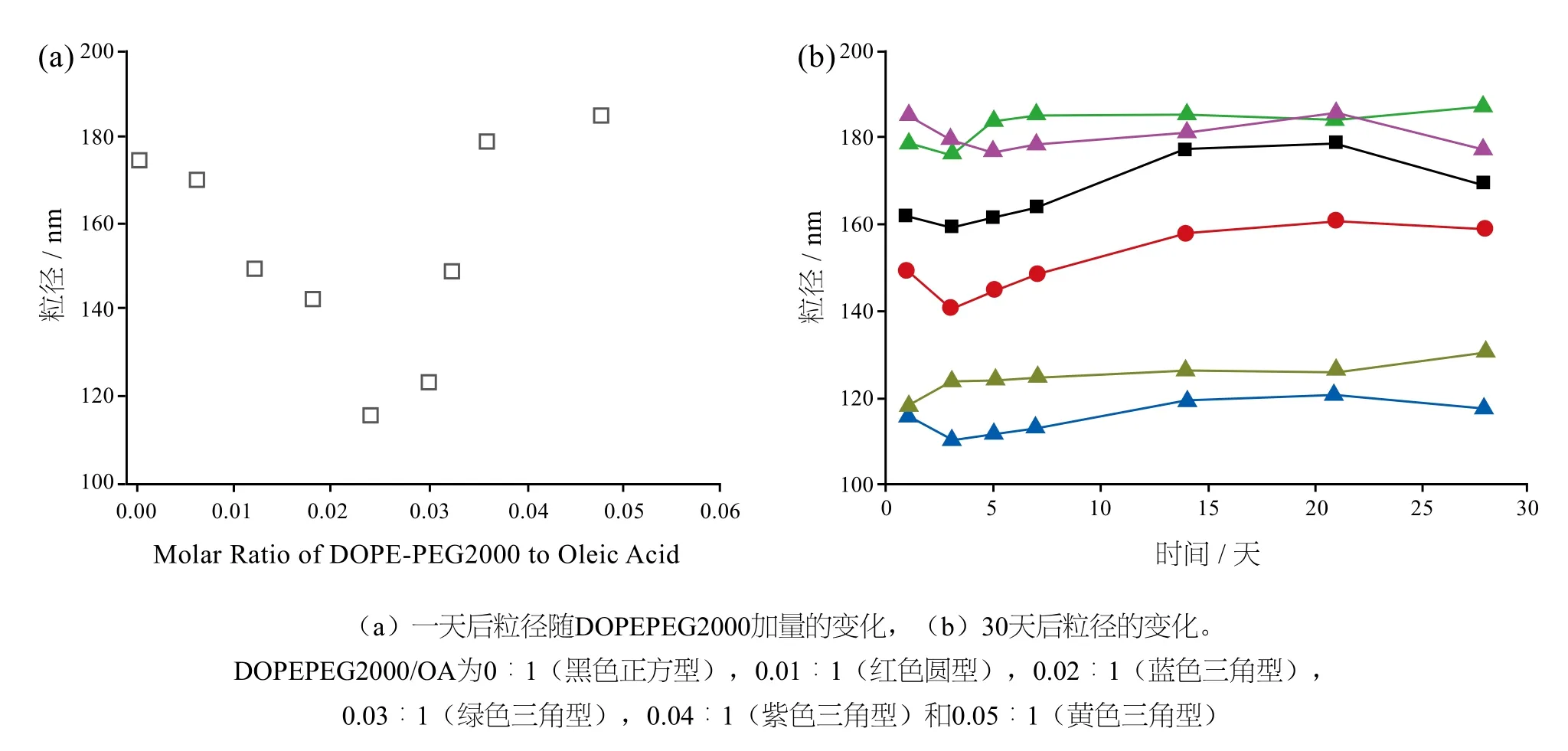
图3 pH8.5和30℃下DOPEPEG2000/OA囊泡的粒径
2 药物包埋和缓释
在Suk[6]等人的研究中,他们将亚叶酸钙盐,甲氨蝶呤,盐酸多柔比星和盐酸伊立替康4种抗癌药物包埋到上述复合囊泡中,它们的logP值分别为-2.67,-0.50,+0.53和+2.78。DOPEPEG2000/OA囊泡成功地包埋了60%以上的各种抗癌药物(图4),其中亲水性药物亚叶酸钙盐和甲氨蝶呤位于囊泡的水性空腔中,而亲脂性药物阿霉素和伊立替康盐酸盐被包埋在囊泡的疏水双层内。由于亲水性药物在水性介质中溶解度大并容易跨膜扩散,故亲水药物的包埋率低于亲脂性药物。这种跨膜扩散引起了药物从囊泡到环境的泄漏,DOPEPEG2000/OA囊泡显示出比文献[3]更好的包埋率,那里只能包埋4%的亲水性药物平推后和60%的亲脂性药物。图5显示:图4中的包埋体系24小时后释放到扩散池中的药物的百分比,加入DOPEPEG2000后药物释放增加,这是因为DOPEPEG2000可以促进囊泡的流动性,从而提高囊泡的透膜渗透性。其中叶酸,多柔比星和伊立替康释放较慢,24小时后只释放20%的药物,而亲水性药物甲氨蝶呤释放超过30%,这可能是因为甲氨蝶呤居中的logP可以使其位于水相和膜之间,更有利于透膜扩散因而释放量高于其他药物。此外,药物释放模式也会受到各种因素的影响,如药物在不同pH梯度下的性质,药物与囊泡双层间的相互作用以及扩散路径长度等。

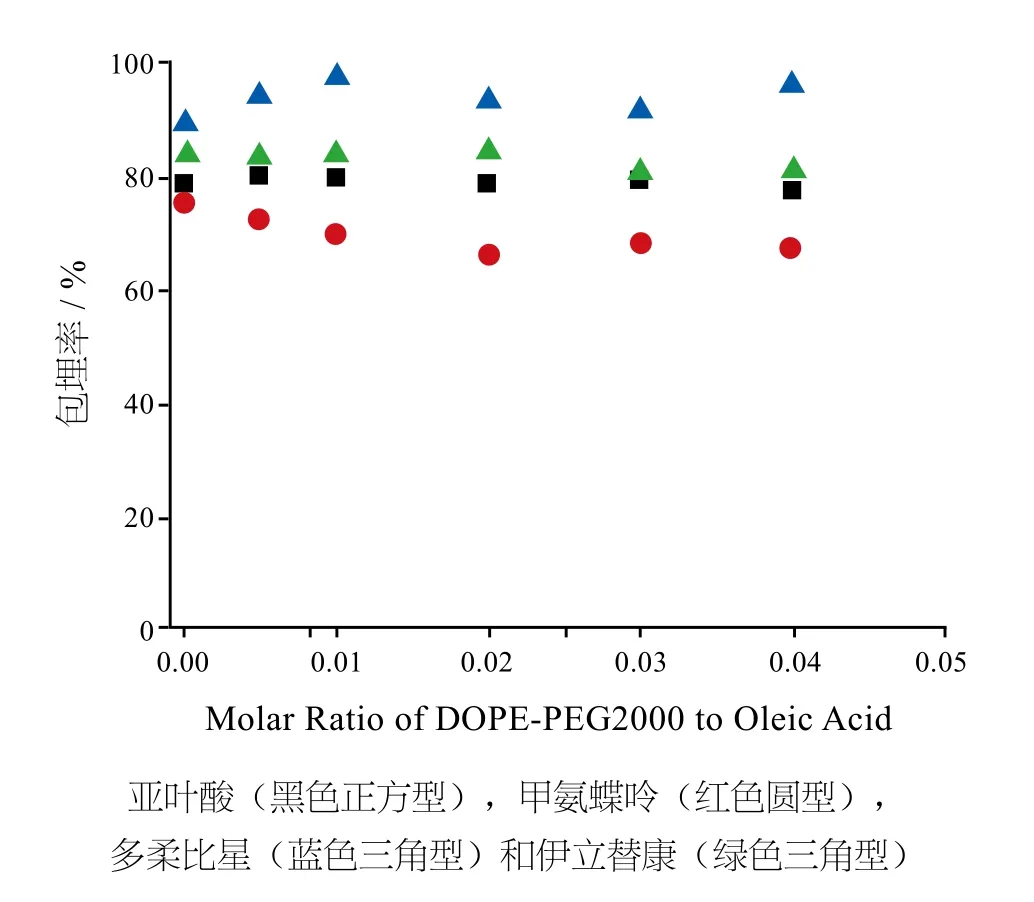
图4 30℃和pH8.5下DOPEPEG2000/OA囊泡的包埋率

图5 37℃和pH8.5下24小时后从DOPE-PEG2000/OA囊泡释放
3 脂肪酸囊泡的潜在应用
3.1 透皮药物传输
不饱和脂肪酸囊泡相对于常规脂质体的主要优点包括成本效益,增加的包封和加载效率以及适于渗透。Rajkamal[7]等人评估过不饱和脂肪酸囊泡介导的地塞米松的药物传输,他们得出的结论是在不饱和脂肪酸囊泡介导的药物传输中,透皮渗透和皮肤分配显著高于普通药物和普通凝胶制剂,并发现不饱和脂肪酸囊泡介导的药物传输的渗透性达到普通药物的4.7倍,表明不饱和脂肪酸囊泡是一种有前途的透皮药物传输模式。
3.2 静脉药物传输
Suk[6]等人设计出DOPEPEG2000/OA囊泡(0.02∶1)的粒径小于200 nm,其ζ电位值小于-20 mV(与红细胞膜相比在可接受范围内),因而可应用于静脉传输。研究结果进一步表明其对所有抗癌药物的包埋率均在60%以上,其中大约20%~40%的药物在24小时后释放。
此外,马洁等[8]还利用烷基糖苷修饰共轭亚油酸,将共轭亚油酸囊泡的pH窗口从原先的8.0~9.0迁移并扩张至6.0~8.0,从而与生命体系适应pH范围相匹配,且囊泡形貌基本未改变,因而也具有经皮或静脉药物传输的潜力。

3.3 钙响应性纳米载体
以脂肪酸囊泡起到类胶囊物的作用,可以包裹香精或活性物,减少香精等被温度或pH等外界条件影响的现象,在日用化学品和洗涤用品中具有应用前景。魏贝[9]等人制备了共轭亚油酸囊泡,在配方的软水环境中稳定,而应用时遇到硬水后膨胀破裂,因而可能用于包埋/释放液体洗涤剂配方中的酶制剂和香精等敏感物质。他们的实验结果表明,交联程度为70%的共轭亚油酸囊泡具有良好的钙稳定性,钙离子浓度低于2.73mmol/L以下均可以稳定,因而具有在硬水中膨胀并达到缓释的效果;而自交联程度越低的共轭亚油酸囊泡其钙响应性越好,如交联度为51%的共轭亚油酸囊泡在钙离子浓度1.36mmol/L以下具有较大的膨胀度,而在1.36mmol/L以上就能够迅速解体而达到一次性释放,适用于洗涤剂用酶等活性物质的快速释放,提高洗涤性能。而且破裂后的脂肪酸囊泡在碱性洗涤条件下还能发挥皂类的助洗作用或消泡等辅助作用。
4 结论
脂肪酸囊泡因其原料价格廉价、来源广泛、生物相容性好、制备过程简单而具有部分替代脂质体的潜能。乙氧基化磷脂稳定的油酸囊泡部分解决了脂肪酸囊泡不够稳定的问题,而且粒径大小易于控制且具有良好的稳定性,因而已经显示在静脉传输药物中的应用潜能。其他脂肪酸油脂囊泡也显示了在透皮药物传输、钙稳定性等方面的良好表现,因此,有望成为一种新型纳米载体,并在日用化学品和洗涤用品中具有应用前景。

