水牛MYF5基因克隆分析及真核表达载体构建
张瑞门,邓彦飞,奉玲丽,崔佳瑜,潘 雨,石德顺,韦英明*,杨素芳*
(1.广西大学动物科学技术学院,亚热带生物资源保护利用国家重点实验室,广西南宁530004;2.广西大学动物科学技术学院,广西南宁530004)
动物骨骼肌发育过程中,生肌因子5(MYF5)被认为是肌源性决定因素之一,诱导祖细胞建立骨骼肌谱系[1-2]。Zammit等[3]研究指出,转录因子MYF5、MYOD、Myogenin和MRF4的肌源性调节因子家族在诱导卫星细胞参与骨骼肌发育方面发挥关键作用。MYF5是胚胎中骨骼肌谱系决定的基本调节剂,敲除该基因将造成卫星细胞失去肌肉分化、再生功能,说明MYF5在肌肉再生中扮演着关键角色[4]。在小鼠胚胎中,MYF5是第1个要表达的肌源性测定基因[5]。MYF5缺失会使肌纤维修复和再生功能受到阻碍[6];MYF5和MYF4同时缺失会使MYOD表达,诱导细胞进入肌源性程序[5];当这3种生肌决定因子同时缺失时,会导致骨骼肌缺失[7-8]。MYF5基因的表达量在猪肌肉组织中显示最高[9-10],五指山猪背部肌肉组织中MYF5基因的mRNA表达水平与年龄呈正比。
综上所述,MYF5及其他肌肉调节因子(MRFs)基因家族在小鼠、猪等物种研究中都取得了相应进展,但在水牛肉质方面的研究尚未报道。因此,本研究对广西沼泽型水牛MYF5基因进行克隆,应用生物信息学方法分析该基因氨基酸序列、蛋白质结构,并构建其真核表达载体,为该基因肌肉发育调控机理及肉质改良研究奠定基础。
1 材料与方法
1.1 组织采集 实验雄性水牛在广西南宁市鲁班路肉联厂屠宰后,用手术器械采集后腿深部肌肉组织,剪成小块放入冻存管后立即置于液氮罐中,1~2 h内送回实验室并保存于-80℃冰箱。
1.2 主要试剂 分子生物学试剂:Trizol试剂购自Invitrogen公司,琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒均购自北京天根化科技有限公司,反转录试剂盒购自大连TaKaRa公司,pEASY克隆载体购自北京全式金生物技术有限公司,去内毒质粒提取试剂盒购自OMEGA公司,LB培养基购自北京金桥科技公司。
细胞生物学试剂:DMEM高糖基础液体培养基(GIBCO)、胎牛血清(FBS,GIBCO)、胰酶和脂质体转染试剂盒(Life3000,Invitrogen)等均购自Life公司。
其他:大肠杆菌DH5α感受态细胞、HEK293T细胞、水牛颗粒细胞、pMXs-IRES-GFP 载体均为广西大学亚热带农业生物保护与利用国家重点实验室保存。
1.3 引物设计 根据GenBank中牛MYF5基因序列(登录号:NM-174116.1),应用Oligo 7.0软件设计MYF5特异性扩增引物,分别用于目的基因扩增(MYF5-CDs)、载体构建(MYF5-MQ),具体信息如表1所示,统一由上海生工生物工程有限公司合成。
1.4 RNA提取和cDNA第1链的合成 采用Trizol法提取肌肉组织的总RNA,检测浓度及纯度后,筛选质量合格的RNA用于cDNA合成。本实验利用两步反转法合成cDNA 第1链。第1步,去除基因组DNA:7 μL RNA,1 μL gRNA Eeaser及 2 μL 相 应 的 Buffer,42℃ 反应2 min;第2步,逆转录反应:在去除基因组产物中分别加入1 μL RT primer Mix(反转录酶),5×Buffer 4 μL,2 μL抑制剂,4 μL dNTP,1 μL随机引物,4 μL RNase-free Water,程序为 37℃ 15 min、85℃ 5 s。反转录得到的cDNA 产物保存于-80℃冰箱。
1.5 RT-PCR反应 扩增MYF5基因序列片段时,PCR反应体系:2×Taq Mix 酶12.5 μL,上、下游引物各 1 μL, 模 板 2 μL(100 ng/μL), 三 蒸 水 8.5 μL;反应程序:95℃预变性4 min;95℃变性30 s,55℃退火30 s,72℃延伸50 s,35个循环;72℃终延伸5 min;4℃结束反应。
1.6 PCR产物的连接与测序 PCR产物通过1.0%琼脂糖凝胶进行电泳分离,将DNA 目的片段回收、纯化后,与克隆载体pEASY®-T1 Cloning Vector连接,连接体系为DNA产物4 μL、克隆载体1 μL,25℃反应30 min;再把连接产物转化感受态大肠杆菌,并在含有氨苄青霉素(Amp+)的LB固体培养基上,37℃培养12~16 h。挑取单克隆后,将其置于含Amp+的LB液体培养基中继续培养,经过Cracking鉴定,用天根普通质粒小提试剂盒获取重组质粒pEASY-MYF5,送至深圳华大基因进行测序。
1.7 生物信息学分析 对水牛MYF5基因进行生物信息学分析:测定结果在NCBI中BLAST程序进行同源序列比对;分子进化树用MEGA6.0软件进行构建;用EXPASY相关在线服务器分析水牛MYF5编码蛋白氨基酸组成、理论分子质量和等电点等;利用SMART程序(http://smart.Embl-heidelberg.de)预测MYF5编码蛋白氨基酸序列可能存在的蛋白结构域;利用TMHMM Server v.2.0程序(http://www.cbs.dtu.dk/services/TMH
MM/)进行蛋白质跨膜区预测;利用DNAStar中的Protean程序预测MYF5蛋白质二级结构;通过SWISSMODEL程序(https://swissmodel.expasy.org/interactive分析预测MYF5蛋白质三级结构。
1.8 真核载体的构建 用MYF5(MQ)引物以pEASYMYF5重组质粒为扩增模板,PCR扩增出带有酶切位点的目的基因DNA片段。将DNA目的片段和pMXs-IRES-GFP 载体分别用BamH I和EcoR I限制性内切酶进行双酶切反应,分别回收酶切产物。利用T4连接酶将DNA目的片段与骨架载体进行连接。连接体系:骨 架 载 体 4 μL、 目 的 片 段 4 μL、T4 连 接 酶 1 μL、10×Buffer 1 μL,混匀后置于16℃环境连接反应8 h以上,转化、质粒鉴定和提取等严格按照本实验室的方法[11]和试剂盒进行;得到pMXs-MYF5 表达载体,进行质粒电泳和质粒双酶切鉴定,并筛选初步鉴定正确的质粒,送至深圳华大基因进行测序。
1.9 细胞培养及转染 将HEK293T细胞和水牛颗粒细胞进行复苏,在37℃、5% CO2环境中培养,待细胞汇合度达70%~85%时,将pMXs-MYF5表达载体利用脂质体转染试剂转染HEK293T细胞和水牛颗粒细胞,同时以未转染外源基因的细胞为对照。36~48 h后,观察绿色荧光蛋白的表达;分别提取转染pMXs-MYF5质粒的HEK293T细胞和对照组HEK293T细胞的RNA,合成cDNA后利用扩增引物进行RT-PCR检测。
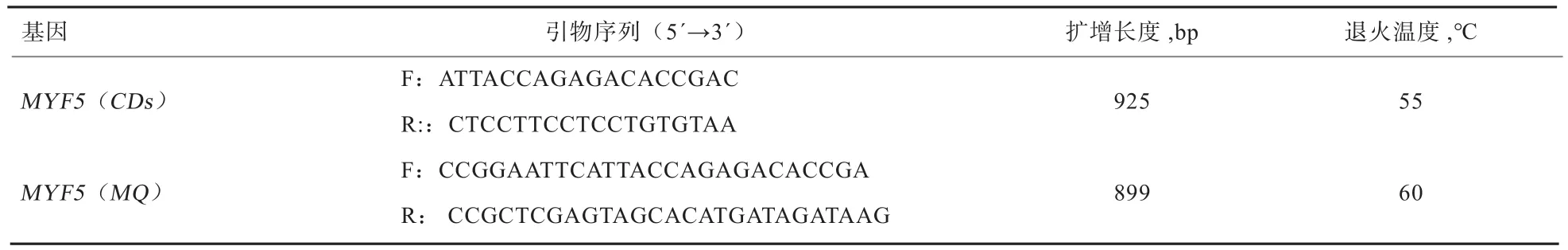
表1 MYF5基因引物合成序列
2 结果与分析
2.1 水牛MYF5基因的克隆与鉴定 通过Trizol法纯化获得水牛肌肉组织总RNA。从图1中可以观察到清晰的28 S和18 S条带,说明获得了的RNA可用于下一步的反转录实验。对水牛MYF5基因CDS序列设计特异性扩增引物,经测序分析,RT-PCR扩增获得925 bp的特异性条带(图2A),其中包括768 bp的CDS序列,预计编码255个氨基酸(图3)。将PCR产物连接克隆到pEASY®-T1 Cloning Vector,载体大小约 4 321 bp,与预期结果一致(图2B)。

图1 水牛后腿部肌肉组织RNA的特异性条带

图2 水牛MYF5基因克隆
2.2 水牛MYF5基因序列分析 对获得的阳性重组质粒进行测序分析,获得水牛MYF5基因序列。应用NCBI的ORF Finder程序分析,发现该基因编码区全长768 bp,可编码255个氨基酸(图3)。 经BLAST软件相似性比对分析显示,水牛MYF5核酸序列与牛、山羊、猪、人、猩猩和狼相应序列的相似性分别为99%、98%、94%、91%、90%和89%,表明MYF5基因在不同哺乳动物中具有较高的序列保守性。

图3 水牛MYF5基因序列及其预测编码氨基酸序列
2.3 水牛MYF5基因系统进化树构建 经过进化树分析得出(图4),水牛与牛的 MYF5基因序列同源性最高,与山羊、猪、马、人等哺乳动物的遗传距离相对较近,而与爪蟾、原鸡和斑马鱼相距较远,进化树的形态与分类学保持了较高的一致性,进一步证明克隆获得了水牛MYF5基因。
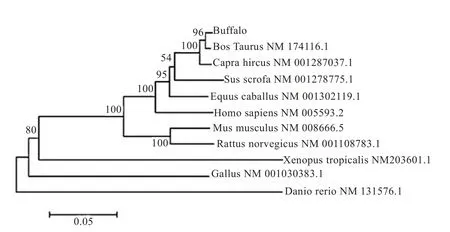
图4 水牛MYF5氨基酸序列与其他物种的系统进化比较
2.4 水牛MYF5蛋白质特性的生物信息分析 通过EXPASY服务器分析水牛MYF5蛋白质的氨基酸组成,该蛋白质含有255个氨基酸(图3和表2),其中丝氨酸含量(12.9%)最高,色氨酸含量(0.8%)最低。MYF5蛋白质理论分子质量为28.27 ku,分子式为C1209H1902N350O397S18,等电点为5.72。MYF5蛋白质跨膜区预测显示,水牛MYF5蛋白质均位于膜外区域,为膜外蛋白;进一步用SMART程序预测MYF5的蛋白质结构域的结果显示,位于第1~88位氨基酸存在1个MYOD家族标志性的MYOD结构域:BASIC(图5)。对水牛MYF5蛋白质的二级结构和高级结构进一步预测分析,结果显示水牛MYF5蛋白质二级结构中包含14个α-螺旋、6个β-折叠、25个T-转角和22个无规则卷曲(图6);在水牛、牛和人3个物种中MYF5蛋白质高级结构显示了极高的相似性(图7)。

表2 水牛MYF5基因编码蛋白质的氨基酸组成
2.5 水牛MYF5基因真核表达载体构建及细胞转染 获得正确重组质粒pMXs-MYF5(图8)后,将重组载体用脂质体转染试剂转染HEK293T细胞和水牛卵巢颗粒细胞,48 h之后,利用荧光显微镜操作系统观察EGFP-MYF5融合蛋白的表达,细胞有明显的绿色荧光(图9)。经RT-PCR检测发现,转染pMXs-MYF5质粒的HEK293T细胞表达MYF5基因,而对照组的HEK293T细胞不表达该基因(图10)。

图5 水牛MYF5蛋白质结构域预测

图6 水牛MYF5蛋白质二级结构预测
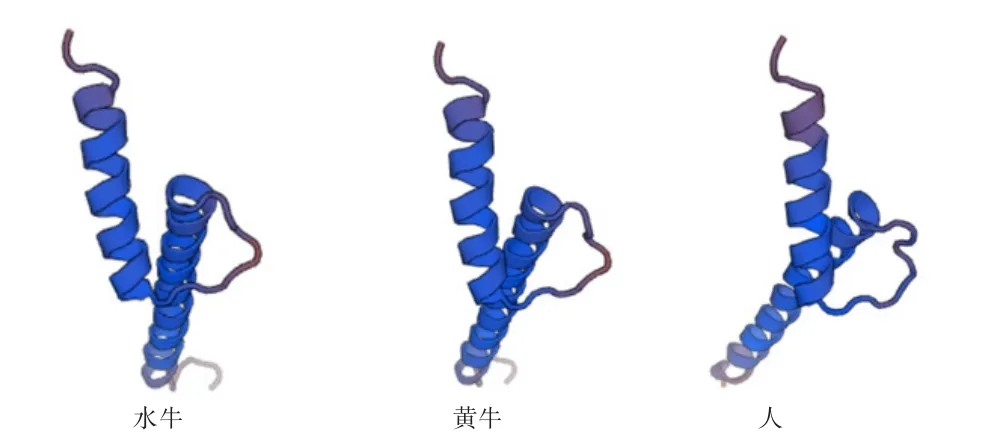
图7 不同物种MYF5蛋白质三级结构预测

图8 水牛MYF5基因表达载体构建

图9 pMXs-MYF5载体转染细胞

图10 HEK-293T细胞中MYF5基因表达情况
3 讨 论
本研究成功克隆了水牛MYF5基因,其编码区序列长度为768 bp,共编码255个氨基酸,核苷酸序列与牛、山羊、猪、人、猩猩和狼相应序列的同源性分别为99%、98%、94%、91%、90%和89%;系统进化树分析表明,水牛MYF5基因在不同物种及进化的过程中具有高度保守性;蛋白质分析结果显示,MYF5蛋白为膜外蛋白,具有MYOD家族标志性MYOD结构域。同时,本实验成功构建了水牛MYF5基因真核表达载体pMXs-MYF5,转染 HEK293T、颗粒细胞后产生的绿色荧光信号,表明能够形成MYF5-EGFP融合蛋白。
广西是水牛养殖大省,但水牛肉质相关研究甚少。MYF5基因与肌纤维的数量和大小均有关系,对畜禽的产肉力、肉质及风味的改善具有十分重要的作用。在其他物种上,MYF5基因表达模式[12-14]、生长性能关联分析[15-16]均有进展。有研究表明,牛MYF5基因具有群体遗传多态性[17],在不同品种中显示出不同的遗传效应,即不同等位基因上基因频率有所不同,这暗示着水牛MYF5基因必然存在群体遗传多态性。Yin等[18]使用DNA测序方法鉴定并分析了雌性家鸽MYF5和Kruppel样因子15(KLF15)基因外显子中的单核苷酸多态性(SNP)。近期,Magli等[19]、Watanabe等[20]探讨多能干细胞衍生肌源性细胞时,认为生肌因子MYF5及其家族基因均具有调控成纤维细胞转化为肌细胞的能力,这有可能与MYF5及其家族基因在组蛋白乙酰化水平[21]、基因转录调控等机制存在联系。一些研究表明,MYOD可以将脂肪组织转化为肌肉组织[22-24],而棕色脂肪细胞来自肌肉干细胞群[24-26]。对于脂肪细胞,MYF5是重新启动脂肪代谢和维持体温的必须参与者[27-28]。此外,lncRNA与生肌调控家族基因在脂肪细胞和肌细胞之间相互转化中发挥调控功能[29]。
MYF5及其家族基因在成肌过程中发挥着重要的作用[30],而它们是否参与牛肌内脂肪发育、是否在脂肪发生过程中发挥作用,如何调控肌肉祖细胞和脂肪祖细胞的分化等方面,值得探讨。因此,牛MYF5及其家族基因在骨骼肌细胞、脂肪细胞分化发育方面仍需要更多的研究。本研究结果为继续研究MYF5基因在水牛骨骼肌发育、肌内脂肪沉积中的调控作用及机制提供了重要的支撑数据,为今后将MYF5基因的真核表达载体转染到体外培养的骨骼肌卫星细胞、前体脂肪细胞研究 MYF5基因在肌肉发育中的作用及对脂肪沉积的影响奠定了基础。

