MRI增强灰度直方图鉴别诊断胶质母细胞瘤、脑淋巴瘤和单发转移瘤
任 琦,程敬亮,马 桢,张 勇
(郑州大学第一附属医院磁共振科,河南 郑州 450052)
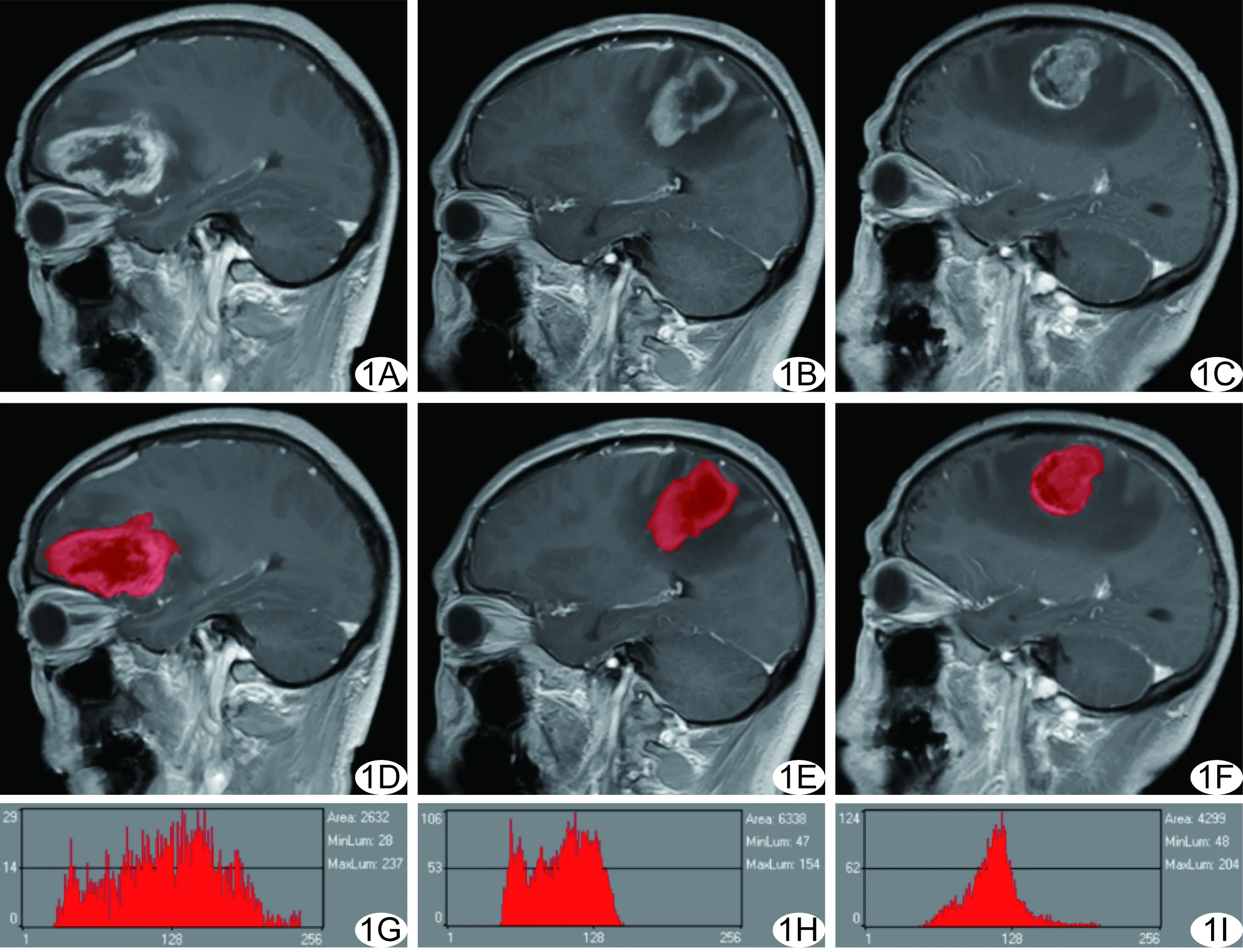
图1 GBM、PCNSL、SMT增强直方图分析 A、D、G.分别为GBM矢状位增强图像、软件勾画ROI图像、ROI灰度分布直方图; B、E、H.分别为PCNSL矢状位增强图像、软件勾画ROI图像、ROI灰度分布直方图; C、F、I.分别为SMT矢状位增强图像、软件勾画ROI图像、ROI灰度分布直方图
胶质母细胞瘤(glioblastoma multiform, GBM)、原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL)和单发脑转移瘤(solitary brain metastasis, SMT)的影像学表现相似,传统MRI鉴别价值存在争议。MRI直方图分析可客观地量化肿瘤MRI内体素的信号强度分布,有助于诊断肿瘤、评估其生物学侵袭性及预测治疗反应[1]。本研究以MR肿瘤全域增强图像为ROI,提取其内灰度值分布情况并进行分析,探讨MRI增强灰度直方图分析鉴别诊断GBM、PCNSL和SMT的价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年5月—2017年10月95例于我院就诊的脑肿瘤患者资料。其中GBM 29例(GBM组),男17例,女12例,年龄10~69岁,平均(51.2±14.5)岁;PCNSL 38例(PCNSL组),男17例,女21例,年龄33~81岁,平均(57.1±12.5)岁;SMT 28例(SMT组),男15例,女13例,年龄36~76岁,平均(59.8±10.3)岁。PCNSL组包括弥漫性大B细胞淋巴瘤37例,淋巴浆细胞性淋巴瘤1例,均无获得性免疫缺陷。28例SMT中,原发肿瘤包括肺癌24例(腺癌18例,神经内分泌癌4例,鳞癌2例)、乳腺癌2例(浸润性导管癌1例、病理类型不明1例)和胃腺癌2例。纳入标准:①术前于我院接受颅脑MR检查,图像质量佳;②MR检查前无任何影响肿瘤形态学特征的医疗行为,如穿刺活检、放化疗等;③术后病理确诊为GBM、PCNSL或SMT。
1.2 仪器与方法
1.2.1 仪器 采用Siemens Skyra 3.0T MR仪,32通道标准头颈联合线圈。扫描序列及参数:轴位T1WI,TR 240 ms, TE 2.5 ms;轴位T2WI,TR 5 000 ms,TE 117 ms;轴位T2 FLAIR,TR 6 500 ms,TE 85 ms。增强扫描采用高压注射器注射对比剂Gd-DTPA,剂量0.2 mmol/kg体质量,流率2 ml/s,之后按0.5 ml/kg体质量生理盐水以同速率进行注射冲洗;再行轴位、矢状位、冠状位T1WI增强扫描,TR 240 ms,TE 2.5 ms;FOV 24 cm×24 cm,矩阵256×256,层厚5 mm,层间距1.65 mm。
1.2.2 图像分析 以BMP格式导出所有病例注射对比剂107 s后的矢状位增强T1WI,保持图像窗宽、窗位一致。由1名具有2年以上中枢神经系统诊断经验的影像学医师在高年资医师指导下采用盲法勾画ROI,并于1周后重复勾画1次。利用MaZda软件在所有层面图像沿肿瘤边缘手动勾画ROI(包括囊变、出血、坏死区域)。软件自动生成ROI灰度均值、方差、偏度、峰度、第1、10、50、90、99百分位数(Perc.01%、Perc.10%、Perc.50%、Perc.90%和Perc.99%)等参数。见图1。
1.3 统计学分析 采用SPSS 21.0统计分析软件。以组内相关系数(intraclass correlation coefficient, ICC)评估观察者内一致性。以Kolmogorov-Smirnov进行正态性检验,符合正态分布的计量资料用±s表示,非正态分布的计量资料用中位数(上下四分位数)表示。多组样本间比较采用单因素方差分析或Kruskal-WallisH检验,对差异有统计学意义的参数采用LSD-t检验或Dunn-Bonferroni检验进行多重比较。采用MedCalc软件分析ROC曲线,获得鉴别诊断GBM、PCNSL、SMT的直方图参数ROC曲线的AUC、诊断阈值、敏感度和特异度。以P<0.05为差异有统计学意义。
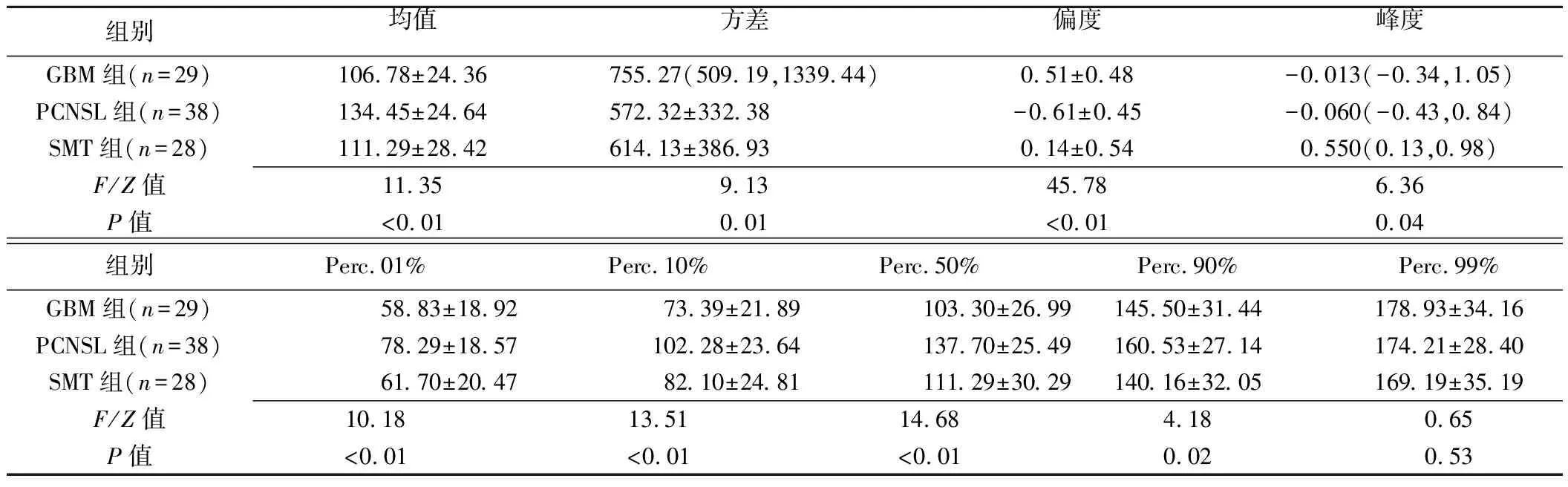
表1 3组增强MRI直方图参数比较

表2 3组多重比较结果(P值)
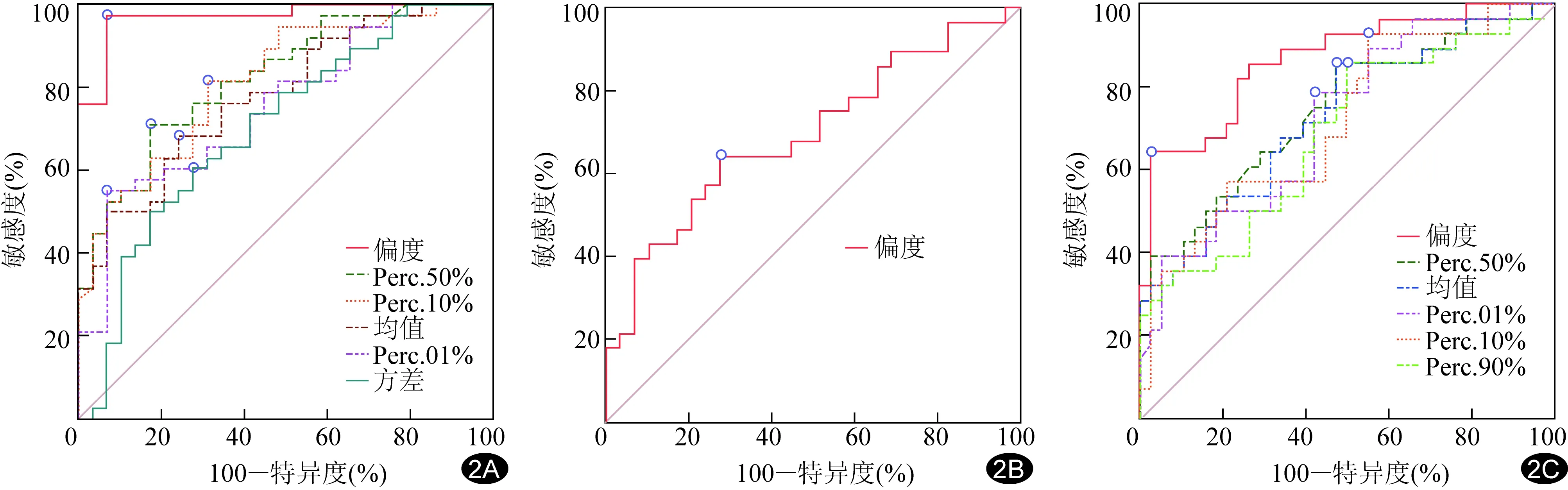
图2 灰度直方图参数鉴别GBM、PCNSL、SMT的ROC曲线 A.鉴别GBM与PCNSL的ROC曲线; B.鉴别GBM与SMT的ROC曲线; C.鉴别PCNSL与SMT的ROC曲线
2 结果
2.1 一致性评价 同一医师2次勾画ROI的灰度均值、方差、偏度、峰度、Perc.01%、Perc.10%、Perc.50%、Perc.90%、Perc.99%的ICC分别为0.991、0.993、0.980、0.968、0.977、0.989、0.983、0.998和0.994,一致性均较好。
2.2 3组增强MRI直方图参数比较 3组肿瘤间均值、方差、偏度、峰度、Perc.01%、Perc.10%、Perc.50%、Perc.90%差异有统计学意义(P均<0.05),见表1。两两比较,GBM与PCNSL组间均值、方差、偏度、Perc.01%、Perc.10%、Perc.50%、Perc.90%差异均有统计学意义(P均<0.05),GBM与SMT组间仅偏度差异有统计学意义(P<0.05),PCNSL与SMT组间均值、偏度、峰度、Perc.01%、Perc.10%、Perc.50%、Perc.90%差异均有统计学意义(P均<0.05),见表2。
2.3 ROC曲线分析 偏度鉴别GBM与PCNSL的AUC(0.97)最大,敏感度(97.37%)、特异度(93.10%)均最高,见表3;偏度鉴别GBM与SMT的阈值为0.18,AUC为0.70,敏感度、特异度分别为64.29%、72.41%;偏度鉴别PCNSL与SMT的AUC(0.87)最大、特异度(97.37%)最高,Perc.10%鉴别PCNSL与SMT的敏感度(92.86%)最高,见表4、图2。
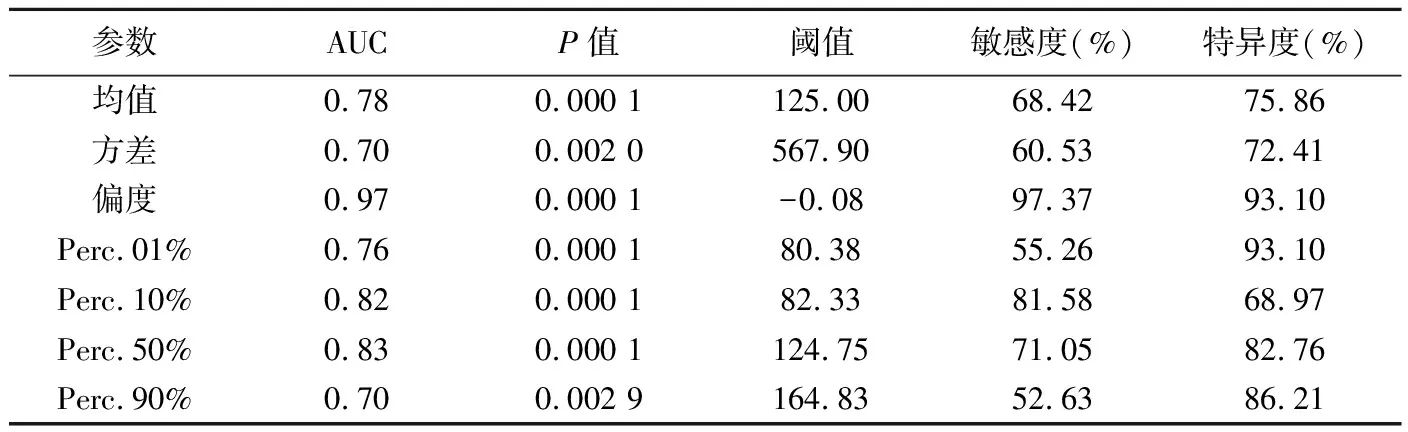
表3 灰度直方图参数鉴别GBM与PCNSL的ROC分析结果
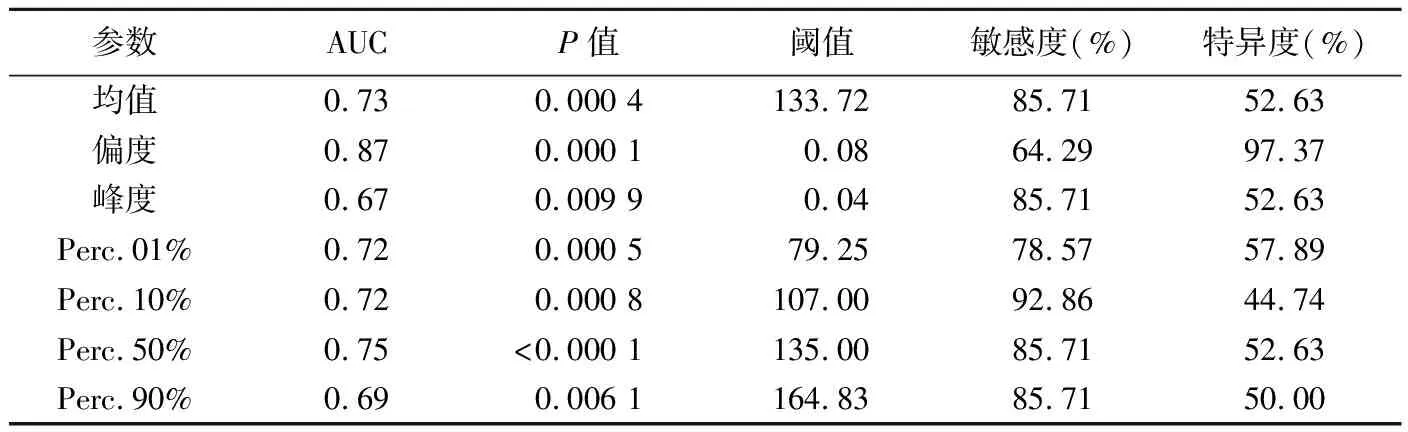
表4 灰度直方图参数鉴别PCNSL与SMT的ROC分析结果
3 讨论
手术辅以放化疗是目前常用于治疗GBM的方案。对于PCNSL患者,术后生存获益少,且神经功能缺陷风险增加[2],因此手术不作为治疗首选,通常在穿刺确诊后使用高剂量联合放化疗[3]。PCNSL活检前常使用类固醇激素降低颅内压,由此可能干扰病理诊断结果[4]。病史是诊断SMT的重要线索,对于SMT患者,需要进行系统的临床及影像学检查,以确定原发肿瘤及其远处转移位置。由于GBM、PCNSL和SMT的治疗方案、手术计划及预后不同,对其鉴别具有重要临床意义。
纹理分析可量化显示人眼察觉不到的细微差异[3],描述的是医学图像中像素灰度的空间分布,可用于数字图像分析,反映病变的组织类型和病理特征[5],已在人工智能医学影像领域中引起越来越多的关注。作为图像纹理的一级特征[5],灰度直方图描述的是肿瘤内每个灰度级出现的频率,而非像素的相对空间位置,与局部脑血容量、局部脑血流量等血流动力学灌注参数不同,灰度直方图分析无直接的生理意义,然而这些描述性特征是MR扫描仪将组织结构和功能特征具体可视化的结果。
既往基于MRI的纹理分析涉及鉴别放射性治疗所致坏死和复发肿瘤[6]、GBM患者生存预测[7]、脑胶质瘤分级[8]、鉴别不同类型肺肿瘤患者的脑转移瘤[9]及预测髓母细胞瘤复发风险[10]等方面,目前基于增强MRI鉴别GBM、PCNSL和SMT的灰度直方图分析研究较少。本研究中的灰度直方图分析针对GBM、SMT、PCNSL增强MRI中ROI内不同灰度出现的频率直方图及相关参数。
本研究中PCNSL组均值显著高于GBM、SMT组,而GBM组与SMT组间均值差异无统计学意义,Perc.01%、Perc.10%、Perc.50%、Perc.90%也保持了上述特征,增强MRI中PCNSL组灰度均值明显高于GBM组和SMT组,可能是由于GBM多伴有坏死无强化区、SMT常为环形强化导致强化时灰度均值较低;结合PCNSL强化时灰度均值的负偏分布,提示PCNSL总体强化均值虽较高,但强化灰度均值趋于低值,可能与PCNSL新生血管形成少及血管结构异常导致摄取对比剂能力受限有关[11]。
方差反映数据的离散程度。本研究中GBM组灰度直方图的方差值显著高于PCNSL组(P<0.05),提示GBM增强时灰度分布变异较大,可能与GBM常伴出血、坏死有关,而PCNSL组方差值较低,即强化程度更为均匀。灰度直方图分析参数量化了这些传统的主观性概念。
偏度表示分布形态的对称性,表明数据分布相对平均值的不对称程度[12],范围为[-1,1]。在MaZda获得的灰度直方图中,正值表明分布集中于右侧并趋向于较大值(灰度偏白);负值相反。偏度绝对值越大,分布形态越偏离正态分布。本研究GBM和SMT的灰度分布直方图趋于正偏,PCNSL则为负偏,且绝对值较GBM和SMT明显增大。GBM正偏程度较大,提示GBM强化时ROI内灰度高值出现频率较多,且其方差较大,表明GBM强化后灰阶之间对比度更大(图1)。
峰度表示灰度值总体分布形态的平坦程度,反映该图像灰度频数分布形态比正态分布更为尖锐或平坦,尖锐者峰度值为正,相反为负[12]。本研究SMT组峰度显著高于PCNSL组,而其方差差异无统计学意义,提示在离散程度无显著差异的情况下,SMT增强时灰度分布更为尖锐。脉管系统特征的不同可能造成增强后图像灰度直方图分布参数峰度的差异。Li等[9]发现,纹理分析可有效鉴别不同类型肺肿瘤来源的脑转移瘤。由于SMT的脉管系统与原发肿瘤相似[13],本研究中SMT多为肺腺癌转移瘤(18/28),可能导致增强图像上SMT某些灰度值频数的显著增多,峰度较高可能反映原发肿瘤组织学起源较为单一。
本研究中偏度除在鉴别GBM与SMT时AUC(0.70)相对较低之外,其鉴别GBM与PCNSL、PCNSL与SMT的AUC(0.97、0.87)均高于既往研究[2,13-16]。ROC曲线分析确定的偏度诊断阈值有适当重叠,但由于GBM与SMT的直方图参数中仅偏度有统计学意义,使其成为唯一能同时鉴别这3种肿瘤的参数,对于鉴别GBM与PCNSL诊断效能最高。可能是GBM和PCNSL不同的血液灌注程度和血管渗透性[2]导致了这一结果。
本研究的局限性:①属回顾性分析,选择偏倚不可避免;②缺少直接的病理学证据验证直方图参数与病理组织学的相关性;③所获结果的实用性和准确率尚需大样本量前瞻性研究证实。
综上所述,灰度直方图参数有助于鉴别GBM、PCNSL和SMT,偏度鉴别诊断效能高,尤其在鉴别GBM和PCNSL时效能出色,有望成为使患者受益的辅助诊断方法。

