低剂量地西他滨治疗骨髓增生异常综合征疗效评价
黄婷

摘 要 目的:探讨小剂量地西他滨治疗骨髓增生异常综合征(MDS)的疗效。方法:收集2015年4月至2018年1月收治的MDS患者40例,随机分为观察组和对照组各20例。对照组采取高剂量地西他滨(25 mg·m-2·d-2)治疗,观察组采取低剂量地西他滨(10 mg·m-2·d-2)治疗。两组均每周治疗5 d,共3个月。观察两组疗效、白细胞介素(IL)-13、IL-18、IL-32水平及不良反应发生情况。结果:观察组和对照组的疗效分别为80%(16/20)和75%(15/20),组间差异无统计学意义(P>0.05)。观察组治疗后IL-13水平高于治疗前和对照组,IL-18和IL-32水平低于治疗前和对照组(P<0.05)。观察组不良反应发生率为15%(3/20),对照组为55%(11/20),组间差异有统计学意义(P<0.05)。结论:小剂量地西他滨治疗MDS疗效与高剂量相同,而患者IL-13、IL-18、IL-32水平改善较好,不良反应较少,临床应用价值较高。
关键词 骨髓增生异常综合征;地西他滨;疗效
中图分类号:R575.2 文献标志码:A 文章编号:1006-1533(2018)18-0017-03
Efficacy evaluation of low-dose decitabine in the treatment of myelodysplastic syndrome
HUANG Ting
(Department of Hematology of Xiangyaping Mine Cooperation Hospital of Pingxiang, Jiangxi 337000 China)
ABSTRACT Objective: To investigate the efficacy of low-dose decitabine in the treatment of myelodysplastic syndrome(MDS). Methods: Forty cases of MDS patients admitted from April 2015 to January 2018 were collected and randomly divided into an observation group and a control group with 20 cases each. The control group was treated with high-dose decitabine(25 mg?m-2?d-2) and the observation group was treated with low-dose decitabine(10 mg?m-2?d-2). Both groups were treated 5 days a week for 3 months. The curative effect, IL-13, IL-18, IL-32 level and adverse reactions were observed. Results: The efficacy of the observation group and the control group were 80%(16/20) and 75%(15/20), respectively, and the difference between the groups was not statistically significant(P>0.05). The level of IL-13 in the observation group was higher than that before treatment and in the control group, and the levels of IL-18 and IL-32 in the observation group were lower than those before treatment and in the control group(P<0.05). The incidence of adverse reactions was 15%(3/20) in the observation group and 55%(11/20) in the control group, and the difference between the two groups was statistically significant(P<0.05). Conclusion: The effect of low dose dicitabine in the treatment of MDS is the same as high dose one. The levels of IL-13, IL-18 and IL-32 of the patients are improved well, the adverse reactions are less, and the clinical application value is higher.
KEY WORDS myelodysplastic syndrome; decitabine; curative effect
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是常见血液系统恶性疾病,以老年人群为多发群體,患者临床表现为白细胞异常、骨髓造血功能下降等,高危患者发展成急性髓性白血病的概率增加[1]。临床治疗MDS方案较多,一般为联合用药。老年患者因免疫力下降,且多合并基础疾病,对于常规治疗剂量耐受性差,还容易发生出血、感染等情况。目前,尚未发现治疗MDS的特效药物,因此,在治疗时主要考虑提高患者的生存质量、延长患者的生存时间[2]。地西他滨是一种胞嘧啶核苷类似物,有去甲基化作用,其治疗MDS效果已经得到肯定[3]。但最佳剂量一直是研究热点。本文报道采用手小剂量地西他滨治疗MDS的效果。
1 资料与方法
1.1 一般资料
收集2015年4月至2018年1月萍乡湘雅萍矿合作医院血液科收治的MDS患者40例,采用随机号码表抽取样本,分为观察组和对照组各20例。观察组中男性13例,女性7例,年龄50~70岁,平均(59.78±4.65)岁;难治性血细胞减少伴多系病态造血12例,难治性贫血伴原始细胞增多4例,难治性贫血伴环形铁粒幼细胞增多4例。对照组中男性12例,女性8例,年龄51~70岁,平均(59.96±4.77)岁;难治性血细胞减少伴多系病态造血12例,难治性贫血伴原始细胞增多5例,难治性贫血伴环形铁粒幼细胞增多3例。两组患者的基线资料差异无统计学意义(P>0.05)。排除脏器功能不全者、精神异常者、合并其他恶性肿瘤者、妊娠期和哺乳期女性。本研究经我院伦理学委员会批准同意,患者均签署知情同意书。
1.2 方法
观察组给予小剂量地西他滨(正大天晴药业集团股份有限公司)治疗,10 mg·m-2·d-2,每周治疗5 d,治疗3个月。对照组给予大剂量地西他滨治疗,25 mg·m-2·d-2,每周治疗5 d,治疗3个月。治疗期间使用止吐剂、保肝药物支持治疗,并严密监测患者IL-13、IL-18、IL-32水平(ELISA法)及不良反应发生情况。
1.3 疗效评价
显效:患者临床症状完全消失,骨髓原始细胞低于5%,骨髓增生程度恢复正常。有效:患者临床症状明显减轻,骨髓原始细胞5%~20%。无效:患者临床症状未改善,骨髓原始细胞超过20%。总有效率为(显效例数+有效例数)/总例数×100%。
1.4 统计学分析
2 结果
观察组显效8例,有效8例,无效4例,总有效率为80%,对照组显效7例,有效8例,无效7例,总有效率为75%,组间差异无统计学意义(P>0.05)。
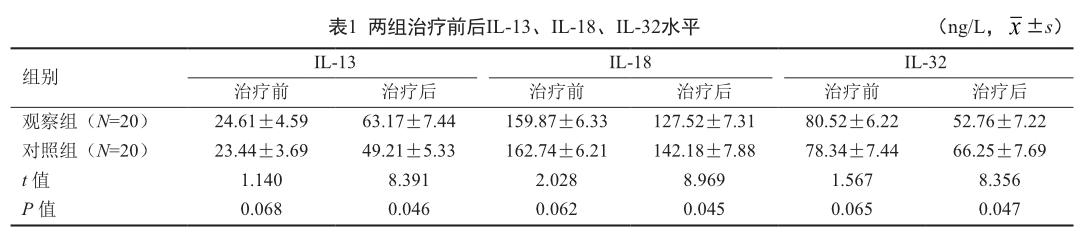
2.1 两组IL-13、IL-18、IL-32水平
观察组治疗后IL-13高于治疗前和对照组,IL-18和IL-32低于治疗前和对照组(P<0.05,表1)。
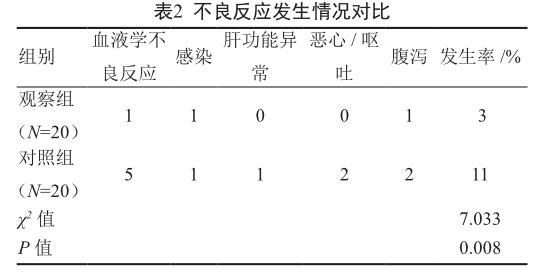
2.2 两组不良反应发生情况
观察组3例发生不良反应,发生率为15%,对照组11例发生不良反应,发生率为55%,组间差异有统计学意义(P<0.05,表2)。
3 讨论
MDS以老年患者为主,而且多有合并症,临床治疗方案尚不统一[4-6]。多数患者采用广谱抗生素、血细胞输注治疗,以改善患者的生活质量。在MDS患者中,DNA的过度甲基化会使控制细胞生长、凋亡的基因失活,其中,甲基化转移酶发挥重要作用[7]。地西他滨是2-脱氧胞苷类似物,能抑制DNA的甲基化过程,激活沉默基因[8]。已有研究显示,地西他滨在高浓度状态下,有一定的细胞毒作用,而在低浓度状态时,则具备去甲基化的作用[9]。
临床关于地西他滨的用药剂量,一直是研究重点。本研究显示,低剂量疗效与高剂量相当,而且患者IL-13、IL-18、IL-23水平改善较好,不良反应相对较少,提示低剂量治疗疗效较好,而且安全性高。分析原因,IL-13是由活化的T细胞分泌产生的一种细胞因子,能抑制单核细胞释放炎症因子和化学因子,诱导B细胞增殖分化,MDS的发病机制则与增殖有关;IL-18、IL-23在机体免疫中有着重要作用,能够介导机体的免疫反应,发挥抗肿瘤作用[10]。高剂量地西他滨影响了IL-18、IL-23的细胞毒性,而低剂量则不良反应少,IL-18、IL-23水平改善较好。
总之,低剂量地西他滨治疗MDS疗效与高剂量相同,而且患者IL-13、IL-18、IL-32水平改善较好,不良反应较少,临床应用价值较高。
参考文献
[1] 贾利敏, 张景丹. 细胞形态学观察在骨髓增生异常综合征中的诊断价值[J]. 现代中西医结合杂志, 2014, 23(31): 3504-3506.
[2] 文敏, 余卫. 骨髓增生异常综合征的MRI研究进展[J]. 国际医学放射学杂志, 2018, 41(1): 77-80.
[3] 刘艳芬, 刘欣, 冯志刚, 等. HAG联合地西他滨治疗骨髓异常增生综合征对患者血管内皮生长因子和生存质量的影响[J]. 河北医药, 2018, 40(1): 99-103.
[4] 孟祥永, 许洪志, 李英, 等. 骨髓增生异常综合征239例病例分析[J]. 临床血液学杂志, 2018, 31(1): 19-23.
[5] 彭莉. 地西他滨联合预激方案治疗老年骨髓增生异常综合征的临床效果分析[J]. 中国当代医药, 2017, 24(18): 25-27.
[6] 彭勇泉. 骨髓细胞学、病理学联合检查在低增生性骨髓增生异常综合征中的诊断价值[J]. 上海医药, 2017, 38(1): 50-51, 68.
[7] 张晓南. 骨髓增生异常综合征70例临床治疗分析[J]. 中国现代药物应用, 2016, 10(12): 172-173.
[8] 初晓丽. 地西他滨治疗骨髓增生異常综合征的疗效分析[J]. 中国医药科学, 2015, 5(18): 185-187.
[9] 王继芳, 魏秀丽. 小剂量地西他滨对骨髓增生异常综合征患者的疗效及对IL-13、IL-18和IL-32的影响[J]. 药物评价研究, 2018, 41(2): 283-286.
[10] 吴秋华, 王俊丽, 孙红霞. 骨髓增生异常综合征患者医院感染的危险因素分析与预防[J]. 中华医院感染学杂志, 2014, 24(18): 4543-4544, 4547.

