通腑泄热法对大鼠肝脏缺血再灌注损伤的保护作用
李伟涛 翟淑萍 章小兵 苑伟 张北平 王百林
缺血再灌注损伤(ischemia reperfusion injury, IRI)指在一定条件下,缺血后疏通血管或再造血管使组织得到血液的再灌注不仅不能迅速恢复正常的代谢机能,反而引起更严重的损伤,表现为组织充血、水肿、组织功能障碍等。其病理生理过程复杂, 迄今尚未完全研究清楚。在复杂的肝脏外科手术中,肝脏均会不可避免地、不同程度地IRI,是导致肝切除和肝移植术后肝功能异常的重要原因[1]。通腑泄热法是中医下法的一种,属于祛邪法范畴。可调畅脏腑气机、给邪气以出路,达到泄热祛邪、恢复脏腑生理功能的作用[2]。本研究通过建立肝脏缺血再灌注损伤(liver ischemia reperfusion injury, HIRI)大鼠模型,通过检测大鼠血清中白细胞介素6(interleukin 6,IL-6)含量及肝组织匀浆中髓过氧化物酶(myeloperoxidase ,MPO)、过氧化氢酶(catalase,CAT)活性,探讨通腑泄热法中药对肝脏缺血再灌注损伤的保护作用及机制,为HIRI的保护提供理论基础。
材料与方法
一、材料
1.实验动物 6周龄Sprague-Dawley大鼠(体重250~300 g)150只,雌雄不限,由广州中医药大学实验动物中心提供,动物合格证编号SCXK(粤)2013-0020,饲养于清洁级实验室,室温(22±2)℃,湿度50%~70%,自由进食、饮水,适应新环境1周。
2.用药 通腑泄热法方剂以茵陈蒿汤加减为主,购于广州市红十字会医院:茵陈20 g,金银花15 g,柴胡15 g,黄芩10 g,栀子10 g,大黄10 g,延胡索10 g,白芍10 g,桂枝10 g,黄芪15 g,蒲公英10 g,猪苓10 g,泽泻15 g,芒硝5 g,每日一剂,水煎100 ml。
3.试剂 IL-6 ELISA试剂盒(批号CSB-E04640r,武汉华美生物工程有限公司); CAT测试盒(批号A007-1)、MPO测试盒(批号A044),均购于南京建成生物工程研究所。
4.仪器 酶标仪(美国BIO-RAD,型号:iMark);低温离心机 (丹麦Labogene,型号:Scanspeed 1730R);电热恒温培养箱(上海精宏,型号:DNP-9162);可见分光光度计(上海佑科,型号:UV752);电热恒温水槽(国产上海一恒,型号:DK-8D)。
二、方法
1.分组 根据随机分组原则,将150只大鼠分为缺血再灌注通腑泻热方中药组(TCM组,75只),缺血再灌注对照组(Control组,75只),再分成缺血再灌注后1、3、6 h 3个亚组,每个亚组25只大鼠。自由进食、进水,适应1周。
2.建立模型与取材 造模开始,每日早8点、晚8点两次予对照组大鼠5 ml生理盐水灌胃,TCM组5 ml通腑泄热法中药灌胃,连续3 d,灌胃后禁食不禁水。将每组大鼠进行编号、称重。配制1%水合氯醛按照1 ml/100 g剂量进行腹腔内注射麻醉。麻醉成功后,参照余淑珍等[3]改良大鼠急性全肝缺血再灌注模型制备方法制备模型。取腹部正中纵切口,上起剑突,显露肝门,两组均以无损伤血管夹阻断肝门,观察到肝脏组织颜色由鲜红逐渐转变为暗红,完成30 min阻断时间后,松开血管夹。用4-0丝线分两层关腹。术后予以电热毯加热复温。于缺血再灌注后1、3、6 h这3个时间点,分别对25只大鼠取材。各亚组每只大鼠每次抽取下腔静脉血1 ml,取适量肝组织标本,制备肝组织匀浆液,离心20 min(3 000 r/min),收集上清,置于-80 ℃冰箱保存待检测。
三、检测指标
分别以酶联免疫吸附试验(ELISA)用IL-6试剂盒定量检测大鼠血清IL-6含量、以比色法用CAT试剂盒和MPO试剂盒检测肝脏组织匀浆中CAT和MPO含量(严格按照试剂盒说明操作)。
四、统计学处理
结 果
一、两组大鼠血清中IL-6含量变化
Control组1 h、3 h和6 h各时间点IL-6含量明显高于TCM组,差异有统计学意义(P<0.05,表1)。
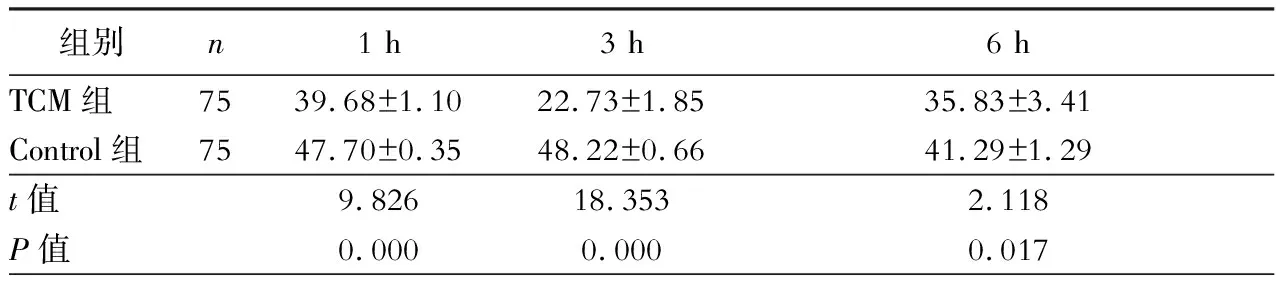
表1 各组大鼠肝脏缺血再灌注IL-6含量变化(ng/L)
二、各组大鼠肝脏组织匀浆液中CAT含量变化
Control组大鼠肝脏组织匀浆液中CAT含量在1 h、3 h和6 h时间点明显低于TCM组,差异具有统计学意义(P<0.05,表2)。
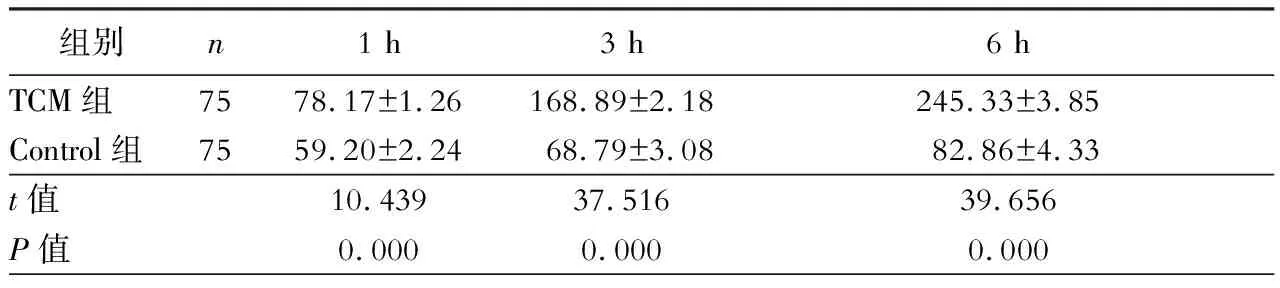
表2 大鼠肝脏缺血再灌注后CAT含量变化(U/mgprot)
三、两组大鼠肝脏组织匀浆液中MPO含量变化
Control组1 h、3 h和6 h各时间点MPO含量明显高于TCM组,差异有统计学意义(P<0.05,表3)。
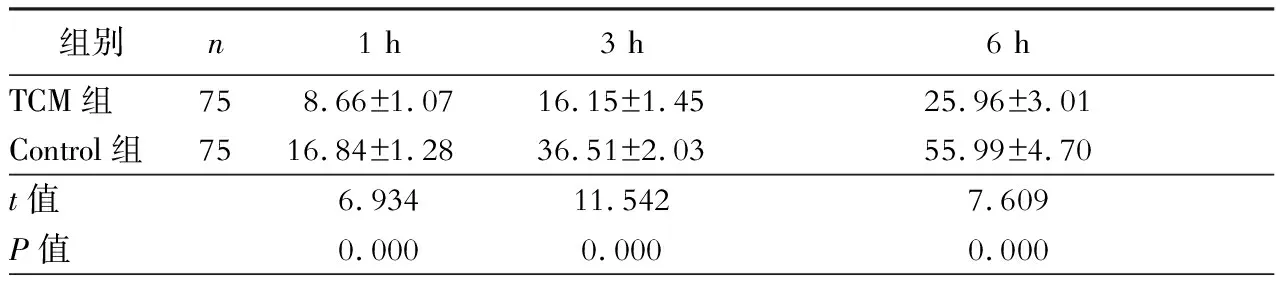
表3 大鼠肝脏缺血再灌注后MPO含量变化(U/克组织湿重)
讨 论
HIRI仍然是肝脏外科的主要问题之一,尤其是复杂的肝脏切除或肝脏移植手术,需要在控制出血与尽量减少缺血再灌注损伤间寻求平衡。
HIRI是导致肝部分切除术和肝移植术后肝功能衰竭的主要原因,减轻术中HIRI有助于降低手术对肝功能的影响[4],其病理生理过程复杂,迄今尚未完全研究清楚。
有研究显示,缺血再灌注损伤有两个阶段,即早期阶段和晚期阶段[5]。早期阶段出现在再灌注后6 h内,这一阶段被认为是肝组织快速氧化还原反应的结果[6]。由肝细胞、库普弗细胞、肝窦内皮细胞介导。而晚期阶段主要是由于肝组织中淋巴细胞的浸润和细胞因子和趋化因子的产生[7]。
目前预防HIRI的方法主要可以归纳为机械性干预和药物干预,前者主要包括缺血预处理和缺血后处理[8]。
药物干预方面,近年来,蛋白酶抑制剂、自由基清除剂、钙通道阻滞剂、某些激素或中药等均已被证实可从多种途径有效抑制HIRI。我们的前期研究证实中药对肝细胞线粒体内氧化应激所导致的损伤具有修复作用,其机制与修复肝细胞mtDNA的表达有关[9-11]。
一些中药具有抗炎和钙通道阻滞作用,因此也能减轻缺血再灌注损伤中的炎症反应[12],不过许多中药制剂使用时必须要浓度较高还要延长中药预处理的时间[13],这在一定程度上限制了中药的临床推广使用。
本课题通腑泄热法方剂以茵陈蒿汤加减为主,茵陈蒿汤出自医圣张仲景的《伤寒论》,不仅可以消退黄疸,而且具有抗肝损伤和肝纤维化的作用[14]。目前临床上在治疗阻塞性黄疸、急性黄疸型肝炎中均有使用,疗效良好[15-16]。
茵陈蒿汤的主要有效成分包括芦荟大黄素、大黄素、大黄酚、大黄素甲醚等[17]。芦荟大黄素的化学结构和大黄素相似,能显著抑制肝细胞及细胞膜脂质过氧化产物丙二醛水平的升高,对肝损伤具有保护作用[18],大黄酚可显著抑制过氧化脂质的生成,减少组织丙二醛含量[19],大黄素甲醚能减少氧自由基的产生,减少炎症性细胞因子的产生,均可表现出对损伤的保护作用。
IL-6既是促炎细胞因子也是抗炎肌动蛋白,在人体中由IL-6 基因编码[20]。IL-6由T细胞和巨噬细胞分泌以刺激免疫应答,在多种急慢性炎症中,如创伤、烧伤、癌症和感染等情况,体内IL-6均会升高[21]。
MPO是中性粒细胞的功能标志和激活标志,其水平及活性变化代表着嗜中性多形核白细胞的功能和活性状态。
检测血清中IL-6和肝组织匀浆中MPO的含量,可反映出机体炎症反应程度。本研究结果显示:Control组在术后不同时间点IL-6和MPO水平显著高于TCM组(P<0.05),表明通腑泄热法中药对大鼠HIRI的保护作用机制可能与抑制多种炎症因子释放、中性粒细胞黏附和过度活化有关。
氧自由基的生成是已知HIRI中最重要的因素之一,有效清除氧自由基,成为减轻缺血再灌注损伤的重要途径,为减轻氧化应激反应,目前有多种办法,一些方法已经应用于临床[22]。
CAT可促使H2O2分解为分子氧和水,清除体内的过氧化氢,防止过氧化氢在铁螯合物的作用下与O2反应产生破坏性大的羟基自由基,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。
CAT存在于所有已知动物的各个组织中,特别在肝脏中以高浓度存在。通过检测肝脏组织匀浆中CAT的活性,可以间接获知机体清除过氧化氢的效率,本研究结果显示:Control组在术后不同时间点CAT含量与TCM组相比明显下降,实验结果具有统计学意义(P<0.05),提示通腑泄热法中药可提高CAT含量,加速对氧自由基清除,减轻HIRI。
总之,HIRI发生机制复杂,与肝脏缺血再灌注损伤后多种炎症因子过度表达和氧自由基损害有关,通腑泄热法中药能够降低HIRI炎症介质释放,加速氧自由基清除,保护肝脏损伤。

