多切口入路坏死组织清除术治疗重症急性胰腺炎的临床分析
郭佐铭 孙备
尽管医疗水平有了大幅度的提高,但坏死型胰腺炎的整体病死率仍然超过10%[1]。疾病存在二个死亡高峰[2]:第一高峰发生在2周内,主要由全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)造成;第二高峰发生在4周后,主要由坏死组织继发感染造成,迁延不愈的感染是导致死亡的主要原因,此时病人可能处于代偿性抗炎症反应状态(couteractive anti-inflammatory response syndrome,CARS)状态[3],即使残余少量感染,机体也无法有效控制,进而发展为脓毒症。而广泛坏死病例由于累及范围过大,坏死发育速度不平均,因而感染组织更难以完全清除,增加了后期病人的死亡风险。因此提高重症胰腺炎病人的生存率,除前期有效控制SIRS外,更关键是后期尽可能完全地清除坏死感染组织。
手术治疗是清除坏死组织的重要手段,超过60%的感染病人需要接受手术治疗[4]。腹膜后广泛坏死就范围而言,病变累及了上腹部的胰周和小网膜囊,以及下腹部的肾周间隙和结肠旁沟(图1)[5];就发展进度而言,病灶中各部位的成熟速度并不统一[6],这意味着要完全清除坏死组织需要经历多次手术。传统的“开放式胰腺坏死组织清除术”具有术野广的特点,但该术式不便于重复,因为手术要从前方贯穿腹膜腔后到达腹膜后病灶,初次术后即出现严重的腹腔粘连,使再手术的入路变得十分艰难;同时此类病人通常一般情况较差,开放手术的巨大损伤可能超过病人的承受能力。而“腔镜下腹膜后坏死组织清除术”虽然损伤小、可重复,但术野无法达到上腹区域,尤其是胰腺和小网膜囊所在平面[7]。
考虑到腹膜后广泛坏死的病变特点,我们设计出一种新型术式——联合肋缘下后腰入路的胰腺坏死组织清除术,并将其列为“创伤递进(step-up approach)”治疗策略的手术环节。我们回顾性地分析了2015年1月到2017年12月在哈尔滨医科大学附属第一医院胰腺胆道外科接受多切口入路手术的8例病人,并重点讨论手术指征、术后并发症和预后,从而论证多切口入路手术在治疗腹膜后广泛坏死型胰腺炎病例方面具有安全性和高效性。

图1 重症胰腺炎坏死部位分区 A.胰腺实质及胰周脂肪;B.肾周脂肪;C.小网膜囊(主要包括横结肠系膜脂肪组织);D.结肠旁沟及肾下极以远腹膜后脂肪
资料与方法
一、一般资料
因“广泛坏死性重症胰腺炎”入院病人8例,所有病人72 h内检查CT,均诊断Balthazar CT 分级中C级或D级。所有病人在治疗过程中均经历多切口入路手术。病人平均年龄为46.2岁(24~73岁),男性5例,女性3例,无妊娠期病例。胆源性胰腺炎3例,酒精性胰腺炎1例,高脂血症性胰腺炎1例,胆源性伴酒精性胰腺炎2例,酒精性伴高脂血症性胰腺炎1例。
二、治疗策略
(一)常规重症急性胰腺炎基础治疗
遵循Van Santvoor HC“step-up approach”治疗策略[4],并根据实际情况作出相应调整。对胆道梗阻病例除黄疸持续加重或出现胆管炎建议经内镜逆行性胰胆管造影术(endoscopic retrograde cholangio-pancreatography,ERCP)外,其他病人保守治疗。对胆囊结石病人如出现积脓或坏疽等严重并发症建议急诊手术,其他病人待胰腺炎痊愈后胆囊切除[8]。消化道耐受病人尽早肠内营养[9]。首次CT检查于发病后48~72 h内进行,住院期间平均每10 d复查一次。由于感染风险与坏死面积呈正相关[10],因此预防性应用抗生素,常规应用喹啉及头孢菌素。
(二)腹膜后坏死病灶外科治疗
腹膜后病灶穿刺引流遵循如下指征:①腹腔间隔室综合征(abdominal compartment syndrome,ACS)或MODS保守治疗无效,同时伴随腹膜后积液;②腹膜后感染导致脓毒症,病人不具备手术条件;③术前遵循引流管引导明确手术入路。
(三)手术适应证及手术方法
早期非手术治疗无法阻止器官功能进行性恶化;后期经皮置管引流(percutaneous catheter drainage,PCD)治疗无法彻底引流腹膜后感染,是手术适应证。坏死引起严重并发症如腹腔出血和消化道瘘等,如果非手术治疗失败也是急诊手术的适应证。
肋缘下屋脊切口处理上腹部病变,腋后线切口处理下腹部病变,切口位置依病灶位置调整(图2)。肋缘下切口距肋弓2 cm,过远可能入腹后损伤横结肠,长度5 cm。入腹后单纯切断胃结肠韧带进入小网膜囊,不触及粘连于腹前壁的大网膜和腹膜腔其他部位(图3),经此入路治疗胰周病变;对十二指肠后的病变我们还可以作Koch氏口入路。腰部切口长5 cm,避开腹膜腔直接到达腹膜后病灶;必要时切开肾筋膜可以进入肾脂肪囊,向下扩展切口可进入髂窝。
术中只清除成熟的坏死组织,液态脓肿直接吸引清除,固态坏死通过卵圆钳钳夹震荡分离(图4);当残余组织出现明显渗血时终止手术,此平面是正常组织和坏死组织的分界线。由于再次手术时,需经过原入路拓展到新病灶,因此切口并不缝合,而在脓腔内充分留置引流管,经手术通道自切口引出体外(图5)。
术后如引流液为脓性,则滴水负压冲洗引流(图6);如再次发热,则选用敏感抗生素并定期复查,条件允许后再次手术。
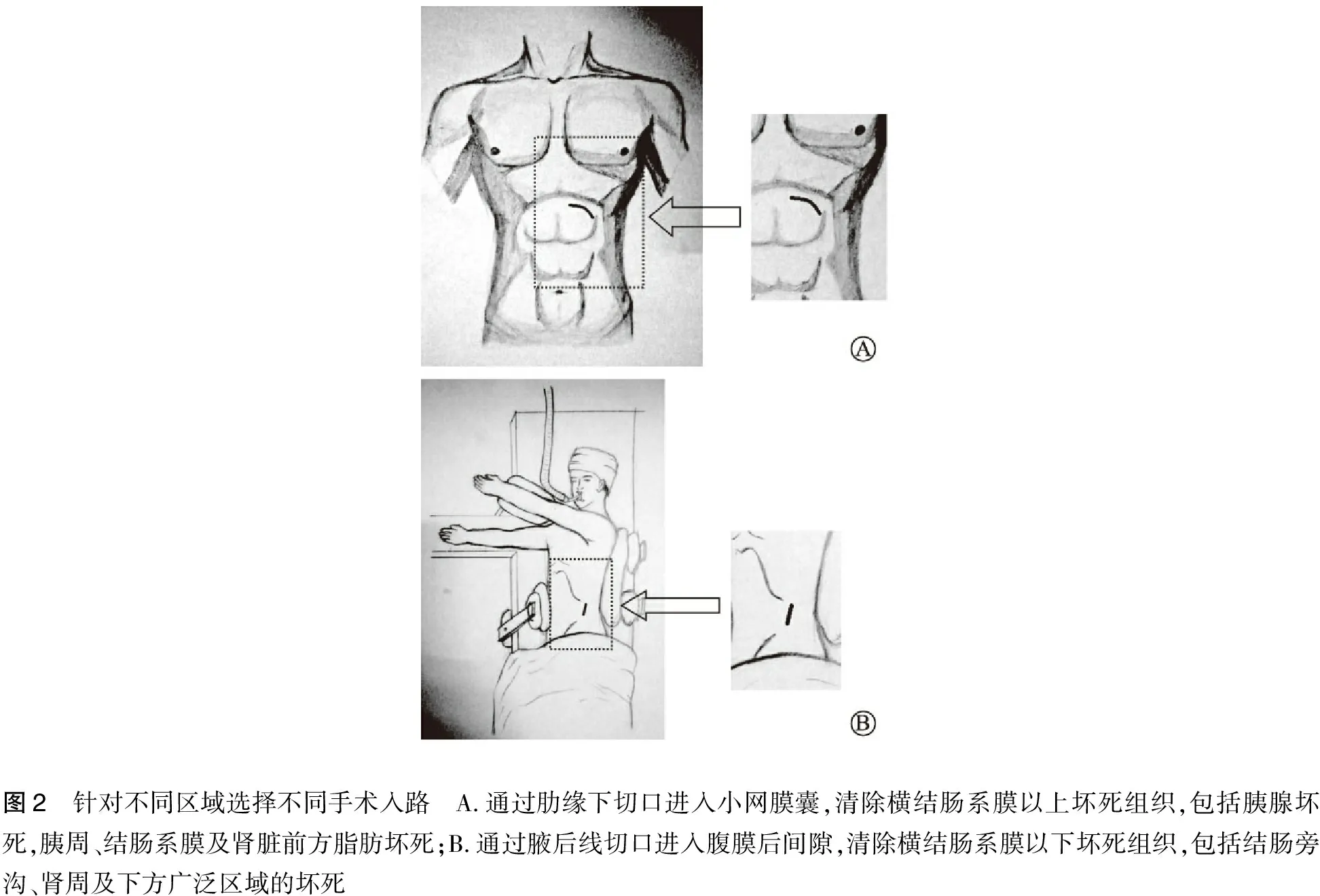
图2 针对不同区域选择不同手术入路 A.通过肋缘下切口进入小网膜囊,清除横结肠系膜以上坏死组织,包括胰腺坏死,胰周、结肠系膜及肾脏前方脂肪坏死;B.通过腋后线切口进入腹膜后间隙,清除横结肠系膜以下坏死组织,包括结肠旁沟、肾周及下方广泛区域的坏死
三、出院标准
维持以下状态:①发热、腹胀症状消失;②完全脱离肠外营养;③切口引流管数目少于2枚。
结 果
一、坏死组织的部位
8例病人中2例累及胰腺实质及左结肠旁沟;2例累及胰腺实质及右结肠旁沟;其余4例病变较严重,累及胰腺实质和双侧结肠旁沟(表1)。
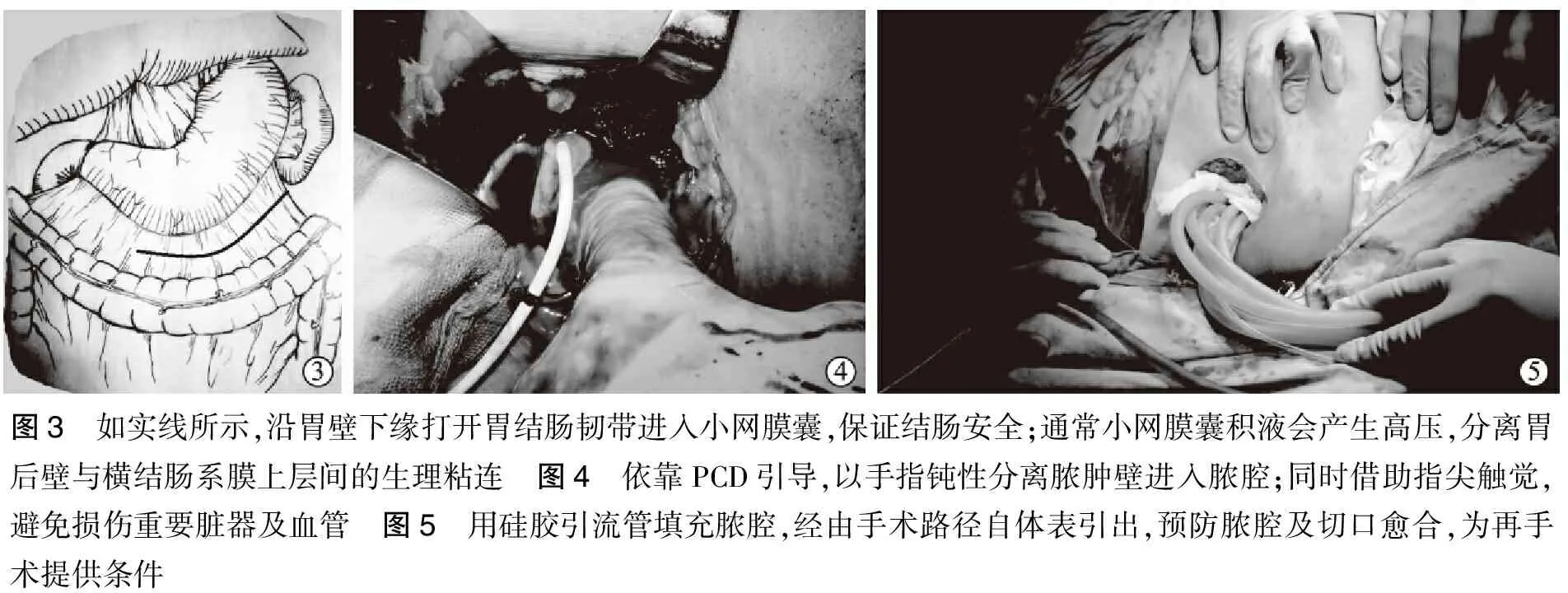
图3 如实线所示,沿胃壁下缘打开胃结肠韧带进入小网膜囊,保证结肠安全;通常小网膜囊积液会产生高压,分离胃后壁与横结肠系膜上层间的生理粘连 图4 依靠PCD引导,以手指钝性分离脓肿壁进入脓腔;同时借助指尖触觉,避免损伤重要脏器及血管 图5 用硅胶引流管填充脓腔,经由手术路径自体表引出,预防脓腔及切口愈合,为再手术提供条件

图6 腋后线入路治疗下腹部病变示例 A.腋后线切口长约5 cm;B.箭头显示腰部引流管置于腹膜后间隙,保护了腹膜腔的完整性
二、感染部位
除例7病人外,均确诊腹膜后感染。其中例4病人发病16 d后因MODS接受坏死组织清除术,术前漏诊腹膜后感染,术后组织培养证明感染存在;该病人术前已经确诊胸腔感染和泌尿系感染,因腹膜后病灶缺乏典型CT表现而造成漏诊(表1)。
三、手术时间
中位手术时间为发病后26 d(16~76 d)。例4病人因急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)控制无效于发病后16 d急诊手术。例7病人发病13 d出现腹腔出血,保守治疗后血红蛋白持续下降,在出血后第7天进行手术,该病人同时伴随肾功能障碍,接受连续性肾脏替代疗法(continuous renal replacement therapy,CRRT)治疗。其余病人初次手术时间均超过24 d(表2)。
四、PCD
腹膜后PCD的指征是腹膜后感染或可疑感染及进行性MODS的经验治疗,置管时间为保守治疗无效后48 h。例2和例7病人因MODS和ACS分别在发病后5 d和6 d接受腹膜后PCD,最初2例病人的引流液均为无菌性,数日后例2病人转为感染性(表1)。
五、手术治疗及结果
(一)手术指征
例4因MODS恶化急诊手术。例7因腹腔出血急诊手术。其余6例因腹膜后持续感染接受手术(表2)。
(二)再手术指征
6例病人因残余感染接受再手术治疗,其中例1、例5和例8病人经历了3次手术。其他的再手术原因主要是出现了严重的并发症,如胆囊坏疽和结肠瘘(表2)。
(三)术后并发症
例1病人出现十二指肠瘘,造影提示引流管压迫所致,调整引流管后治愈(十二指肠瘘并非手术直接造成,且未引起预后不良,因而未计入手术并发症中)。例2病人后期出现脓毒症,此前已多次手术清除可能病灶,最终感染来源未明,因MODS于发病后80 d死亡。例4因MODS急诊手术,术后证实腹膜后存在感染,末期出现脓毒症,因MODS于发病后40 d死亡。例6继发结肠瘘行回盲部造瘘,6个月后瘘口还纳,痊愈。例7腹腔出血复发,该病人术前即因腹腔出血接受急诊手术,术中未发现出血点,本次出血血管造影未发现出血点,提示静脉出血,最终术区填塞加压痊愈(表2)。
(四)预后
2例病人分别于发病后40 d、80 d死亡,其余6例痊愈(表2)。

表1 病人术前情况
注:胰周组织:炎症累及全部胰腺并导致周围组织坏死;胰头、胰体、胰尾:炎症累及相应胰腺部位并导致周围组织坏死;None:无感染或未行腹膜后穿刺;PCD时间:自胰腺炎发病至腹膜后穿刺的间隔时间,其他部位穿刺未计入其中
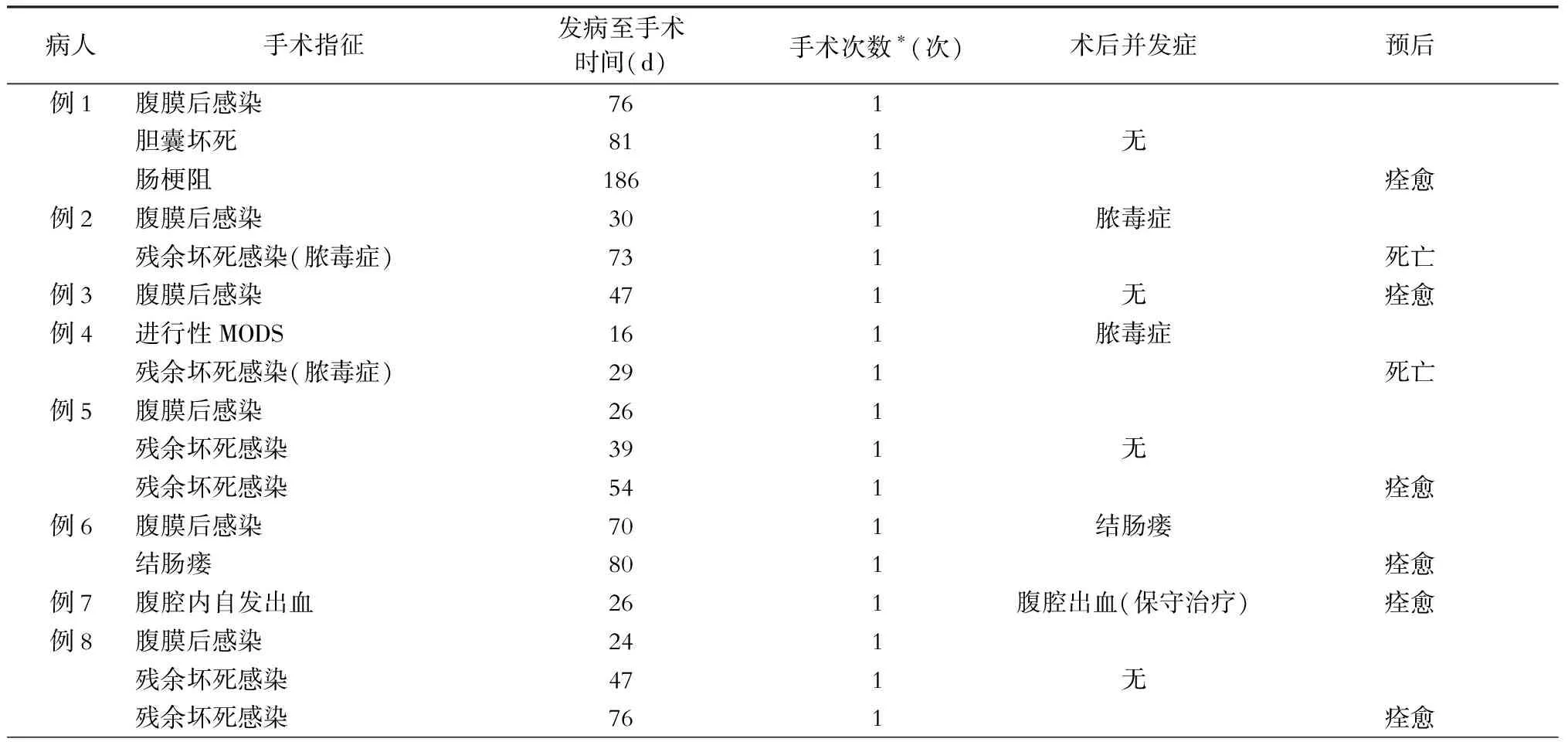
表2 病人手术情况
注:*经历胰腺坏死组织清除术次数,床旁清创未计入其中
讨 论
腹膜后感染是外科介入的适应证,尤其在疾病进入感染期以后。“step-up approach”方案中,经皮穿刺引流是手术清创的先行手段,但所有腹膜后感染病例中,只有30%可以在CT上出现“气泡征”从而确诊感染[4],其余70%并无直接证据证明腹膜后合并感染。对这70%的病人,我们是否应该冒腹膜后穿刺导致无菌坏死感染的风险,进行诊断性穿刺呢?这种情况下,我们首先排除其他感染源,如呼吸道感染、泌尿道感染和静脉导管相关的感染;如果保守治疗48 h后一般状态仍然没有缓解则进行腹膜后PCD。PCD疗效的观察时间为14 d,如果坏死面积的缩小程度不足原始面积的50%,且感染症状持续存在,则考虑手术清创[11];此外如果胰腺炎病程超过4周也建议手术。14 d是临床观察的结果,并未写进指南;在Horvath和Marek的实验中[12-13],如果病人14 d后坏死面积减少不足50%,那么罕有通过非手术治疗获得痊愈的病例。当病情超过4周我们也认为没有必要继续延迟手术,因为4周后坏死组织已发育成熟,正常组织与坏死组织的界限已经分界明显[14],此时进行坏死组织清除术不会造成过大的损伤,同时长时间应用抗生素会打破免疫平衡并诱发二重感染。
我们选择两条手术入路清除坏死组织,肋缘下入路和髂腰部腋后线入路,前者可进入小网膜囊清除胰周坏死组织,后者可到达腹膜后广泛区域;对腹膜后广泛坏死的病例,选择肾下极作为两条入路的会师点,因为肾下极位于横结肠系膜之下,可以避免强行突破小网膜囊造成的出血。肋缘下切口打开腹膜腔前壁进入小网膜囊,虽然这种入路破坏了腹膜腔完整性,但未严重影响腹膜腔内环境:首先5 cm切口有效控制损伤程度;更重要的是,胰腺炎症可以引发大网膜水肿并在横结肠水平粘连于腹前壁上;肋缘下入路只切断胃结肠韧带,不过多破坏大网膜,从而保证横结肠以下腹膜腔的完整性,保护了腹膜腔的内环境。同时减轻了手术对消化道功能的影响,病人在术后2 d即可肠内营养。
每次手术只清除成熟的坏死组织,这种“点到为止”的原则有效控制了手术损伤,术后也未出现新发的脏器功能障碍,尽管病人一般状态较差,但足以耐受多次手术。术中“小心谨慎、速战速决”,初次手术耗时30 min,再手术时间更短。
本组死亡2例。例4因MODS未得到有效控制死亡,属于重症胰腺炎常见死因。引起我们关注的是死于脓毒症的例2病人,因为多次手术完全清除了可能的感染组织,从CT或者术中均无坏死组织残留,而且其他感染源如呼吸道和消化道感染也已被排除,但感染症状依然存在。对感染原因,我们提出两点设想:①疾病长期发展,免疫系统可能处于代偿性抗炎症反应(CARS)状态,即使少量残余感染依然可以诱发脓毒症。②也可能发生肠源性感染[15],消化系统已经失去功能,表现为病人经胃、经空肠营养均持续呕吐,而且多日无排便,同时在无任何营养补充的情况下依旧无饥饿感;这些恶病质表现使我们联想到病人可能出现肠源性感染。对此我们没有明确的解释,对于疑难病例的讨论或许正是提高现有治疗水平的关键。
腹膜后广泛坏死型胰腺炎与其他类型的胰腺炎相比,病人一般状态差,多数需手术治疗,病死率高。传统的手术方式在治疗广泛坏死型胰腺炎病例方面具有诸多限制,我们结合实际情况设计一种改良的手术方案。本研究证实了,在“step-up approach”原则下,“联合肋缘下、髂腰入路的胰腺坏死组织清除术”可以减少术后并发症,允许病人多次手术,降低病死率。因此该术式在治疗腹膜后广泛坏死型胰腺炎方面具有有效性且安全。

