加速康复外科对腹腔镜胃癌根治术病人应激及营养状况的影响
周建刚 邵荣 杨波
我国男性胃癌世界标化死亡率为30.8/10万,女性胃癌世界标化死亡率为13.8/10万,均高于世界平均水平[1]。胃切除术是胃癌最有效的治疗方法。大量研究已证实[2-4],腹腔镜胃癌根治术的预后与开腹手术相当,且具有手术切口小、出血少、术后疼痛轻、减轻炎症反应等优势,所以在临床上得到广泛应用。但腹腔镜胃肠道手术操作时间长、长时间的气腹、高碳酸血症、特殊体位等均不利于病人的术后恢复。2001年丹麦外科医生Kehlet[5]等首次提出加速康复外科(enhanced recovery after surgery, ERAS)概念,ERAS是指在围手术期采用以循证医学为依据的一系列措施,减少手术应激及其并发症,加快病人术后的康复。腹腔镜联合ERAS已成功应用于结肠癌的病人,并取得很好的临床效果,但在胃癌病人中是否有实际的益处目前尚无可靠的定论。因此,本研究通过收集更加全面的评价指标,探讨ERAS应用于腹腔镜对胃癌根治术病人术后应激反应和营养状态的影响。
资料与方法
一、一般资料
本研究通过本院伦理委员会批准实施,纳入研究的所有病人均签署知情同意书。收集2015年2月至2017年2月本院胃肠外科收治的66例接受胃癌腹腔镜手术病人。腹腔镜手术均按照“腹腔镜胃癌手术操作指南+胃癌D2根治术标准清扫淋巴结”执行[6]。按入院顺序抽签分为对照组(腹腔镜+传统方法),ERAS组(腹腔镜+ERAS),每组各33例。纳入标准:①经胃镜病理确诊为胃癌者;②术前未进行放化疗;③术前病人一般情况可,无手术禁忌证;④手术均有同一组医师完成。排除标准:①年龄>75岁;②既往恶性肿瘤史;③急诊手术、无腹部手术而无法建立气腹以及术中转开腹者;④术前辅助检查发现远处转移者(Ⅳ期胃癌);⑤营养不良、合并消化道出血以及术前心、肝、肺、肾等器官功能严重异常者。存在以下任意1项可被视为营养不良:体质量指数(body mass index, BMI)<18 kg/m2;血清白蛋白<30 g/L;体重在近3个月内下降超过10%;主观综合营养评估评分为C级及日摄入量小于正常需要量的60%超过10 d[7]。
二、围手术期处理方式
1.ERAS处理方式 ①术前营养评估及健康宣教,向病人及家属介绍ERAS理念并普及胃癌手术相关知识;嘱严格禁烟,肺功能锻炼,控制基础疾病;术前1 d正常饮食,术前禁食6 h、禁水2 h,术前2 h再服10%葡萄糖500 ml;不常规灌肠或服用泻药,不常规留置鼻胃管;全身麻醉后放置导尿管;采用全身麻醉+硬膜外麻醉方式;术中控制性输液,输液速度<500 ml/h,总输液量<1 500 ml。②术中注意保温(如合适的室温、温水冲洗);不常规留置引流管(如放置,于术后1~2 d拔除)。③术后予非甾体类药物镇痛;术后静脉输液控制在1 500 ml以内,清醒后可少量饮水;术后可在床上翻身活动并鼓励尽早下床活动;尿管于术后24 h内拔除。
2.传统处理方式 ①术前仅接受普通健康宣教,无专门教育;术前夜应用缓泻剂口服灌肠;术前禁食10 h和禁水8 h;常规留置胃管、导尿管;采用全身麻醉方式。②术中无控制性输液,不强调术中保温,常规放置引流管。③术后予阿片类止痛药,术后静脉补液3 000 ml左右;肛门排气后拔出胃管,开始流质饮食并逐渐过渡到正常饮食;导尿管3~4 d后,锻炼膀胱功能后拔出;1~2 d后动员病人下床活动;引流管根据情况拔出。
三、观察指标及出院标准
1.观察指标 ①术后恢复情况:首次排气时间,术后住院时间,治疗费用;②手术应激反应:肿瘤坏死因子α(tumor necrosis fator-α,TNF-α),C反应蛋白(C-reactionprotein,CRP);白细胞介素6(interleukin-6, IL-6),白细胞计数;③营养状态:前白蛋白,血清白蛋白,淋巴细胞计数。
2.出院标准[8]①无疼痛或者口服止痛药可控制疼痛;②胃肠道功能恢复正常,完全耐受经口饮食;③无恶心呕吐,排气排便规律;④可自由活动到卫生间;⑤满意的家庭支持。
四、术后并发症和出院随访
所有术后并发症的诊断和分类参照Clavien-Dindo分级标准[9]。随访分为:①出院后1~2 d第一次电话回访;②出院7~10 d来院复诊;③以后每周回访一次,连续1个月;④病人如有不适可随时主动电话联系专门的联络员或者直接住院。
五、统计学处理
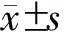
结 果
一、两组病人基本资料的比较
两组病人的性别、年龄、BMI、手术方式和肿瘤分期均具有可比性,差异无统计学意义(P> 0.05),见表1。
二、观察指标的比较
1.术后恢复情况 与对照组相比,ERAS组病人首次排气时间早、住院时间短及住院费用低,差异均有统计学意义(均P<0.05),见表2。

表2 两组病人术后恢复情况的比较±s)
2.手术应激反应和营养状态 ①检测CRP、IL-6、TNF-α和白细胞计数评估手术应激反应。通过组内比较,除了TNF-α外,其余指标均先应激上升后逐渐恢复。ERAS组与对照组相比,术后3 d CRP、IL-6上升幅度较低(P<0.05),白细胞计数上升幅度差异无统计学意义(P>0.05),而TNF-α无明显改变(P>0.05)。②检测前白蛋白、血清白蛋白和淋巴细胞计数评估营养状态。通过组内比较,这些指标均先应激下降后逐渐恢复;ERAS组与对照组相比,此3项指标术后3 d下降幅度较低(P<0.05),并在术后7 d恢复接近术前水平。
三、术后并发症及随访情况
所有病人均在全身麻醉下顺利行腹腔镜胃癌根治术,无中转开腹病例。对照组术后并发症包括级别≥2级的并发症3例,其中吻合口漏1例,肺炎2例;ERAS组术后并发症包括级别≥2级的并发症2例,其中肺炎1例,短暂性脑缺血发作1例。两组并发症发生率之间差异无统计学意义(P>0.05)。经电话随访及门诊随诊,术后1个月内部分病人出现阵发性腹痛、腹胀、恶心、便秘等,通过合理调节饮食、通便药物等处理好转。
讨 论
近年来,随着ERAS在国内外的发展与推广,其理念已于外科多个领域的多种疾病中成功应用。手术损伤的大小是影响手术效果和术后康复的重要因素,腹腔镜手术以微创为特色与ERAS理念不谋而合。但对于腹腔镜胃癌手术结合ERAS的临床效果仍存在诸多争论。江志伟等[10]首次发现与ERAS理念下的开放手术相比,ERAS的腹腔镜胃癌手术可加快胃肠道功能恢复、缩短住院时间,但优势并不明显。与上述研究不同的是,我们比较的是腹腔镜胃癌手术下的ERAS与传统理念产生的临床效果。本研究结果提示ERAS组在首次排气时间、住院时间及住院费用方面均明显优于对照组,与既往国内外文献报道[11-12]一致。
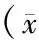
表1 两组病人临床资料的比较±s)
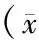
表3 两组病人手术应激反应及营养状态指标的比较±s)
注:同组内与术前比较aP<0.05;与对照组同时间点比较bP<0.05
应激是机体受到创伤引起的神经、内分泌及内稳态改变。对于腹腔镜胃癌根治术的病人而言,术前禁食水、 肠道准备、血糖状态、麻醉、手术创伤、输血输液对血液的影响、消化道的重建、内脏神经的破坏、术后疼痛刺激、术后禁食水等均可引起机体应激反应[13]。应激信息可通过激活下丘脑-脑垂体-肾上腺轴,引起糖皮质激素和儿茶酚胺增加,从而导致机体高分解代谢、过度炎性反应等。CRP、IL-6、TNF-α为非常重要的急性炎症反应指标,其水平与应激反应程度呈正相关[14-15]。我们通过检测CRP、IL-6、TNF-α、白细胞计数进一步证实应用ERAS可降低机体的应激反应。除了TNF-α,其余指标均先应激上升后逐渐降低,且ERAS组上升幅度较对照组低。ERAS组与对照组相比,术后3 d CRP、IL-6上升幅度较低(P<0.05)。此结果与Hildebrandt等[16]研究结果相似。由此可见,ERAS理念可使病人术后炎症反应更轻微,加速免疫恢复,从而降低手术应激反应。
营养状态评估及调整是ERAS程序中的重要内容。术后短期营养状态不仅受手术应激反应的影响,同时也取决于术前营养状态和术后能量摄入。胃肠道肿瘤的病人中,就诊时多处于肿瘤进展期,且在未得到根治前具有进行性消耗倾向。近年的研究报道[17]认为积极纠正术前营养不良,既可以为手术创造有利的条件,又能防止手术风险及其他并发症。本研究中所有病人术前均未出现恶病质,营养状态可,根据ERAS程序尽量控制病人术后每日经口摄入量一致。本研究通过检测前白蛋白、血清白蛋白和淋巴细胞计数评估营养状态。研究认为体重变化与外周血总淋巴细胞计数相关,故将淋巴细胞计数作为评估营养状态的指标[18]。本研究结果提示ERAS组术后水平均高于对照组,且一直维持在较高水平,说明ERAS理念有助于病人术后维持较为稳定的营养状态。此结果与ERAS组术后低应激状态相呼应。本研究中,两组术后并发症及随访结果差异无统计学意义,可能与观察例数少和随访时间短有关,有待于大样本、长期随访进一步验证。
本研究还存在一些不足之处:①本研究存在选择性偏倚和混杂性偏倚,我们遵循随机、对照原则来尽可能降低这些偏倚;②样本量太小还不能得出决定性结论;③本研究中手术应激反应和术后营养指标水平的评估不够准确,我们只选择了3个节点进行检测,各个指标的峰值水平不清楚,不能反映ERAS组能否降低炎症指标峰值水平以及促进提前恢复的作用;④评估手术应激反应和营养状态的指标过于局限,如IL-1、皮质醇激素、儿茶酚胺等均与其相关。
综上所述,ERAS在腹腔镜胃癌根治术中的应用有利于病人术后肠道功能恢复,缩短住院时间,减少住院费用,术后应激反应更轻,营养状态更稳定,促进术后康复,值得临床应用推广。

