菲律宾蛤仔外套膜液含氮物 分布特性及贮藏变化
张 晴,冷寒冰,徐美禄,周晏琳,于 笛,田元勇,刘俊荣,*
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023; 2.辽宁省海洋水产科学研究院,辽宁大连 116023)
菲律宾蛤仔(Ruditapesphilippinarum)是我国重要的海水养殖经济贝类。2016年,我国蛤类养殖总产量为417.3万吨,占海水贝类养殖产量的29.4%[1]。菲律宾蛤仔的突出特点是产量大且抗胁迫能力强,其活品及各种传统或现代加工品深受消费者喜爱。国内外学者对菲律宾蛤仔的研究一直处于热潮,研究方向一方面以产业化养殖为主,包括繁殖、养殖和遗传等[2-3];另一方面作为一种环境检测物,探究菲律宾蛤仔对一些重金属类(Hg、Pb等)环境污染物的富集作用[4-7];而从食品的角度出发,菲律宾蛤仔的相关研究主要在其捕后品质变化[8]、营养分析及加工利用等方面[3]。
菲律宾蛤仔是一种软体部分全部可食的贝类,传统工艺和现代工业化生产中大多选用软体部分来制作产品,而菲律宾蛤仔中被忽略掉的外套膜液部分也占有很高的含量,菲律宾蛤仔蒸煮液中,蛋白含量和总糖含量占到干物质的80%以上[9]。因此,研究者逐渐把注意力转移到对菲律宾蛤仔外套膜液的加工利用上。张龙等[10]对菲律宾蛤仔软体各组织的一般化学组成和蛋白组成进行了系统的研究,而对于外套膜液的相关研究几乎没有。因此,本研究主要以菲律宾蛤仔外套膜液为原料,对外套膜液含氮物分布进行较为系统的分析,并对不同贮藏条件下外套膜液的主要组成物质进行分析,为提升菲律宾蛤仔经济利用价值做出贡献。
1 材料与方法
1.1 材料与仪器
活品菲律宾蛤仔 于2017年10月购于辽宁省丹东市大鹿岛;标准牛血清蛋白 中国北京索莱宝科技有限公司;三氯乙酸、甲基红、溴甲酚绿 上海麦克林生化科技有限公司;CuSO4、K2SO4分析纯(AR),国药集团化学试剂有限公司;H2SO4、NaOH、HCl、硼酸、乙醚 分析纯(AR),中国天津市科密欧化学试剂有限公司;苯酚 天津市凯信化学工业有限公司;以上化学试剂 均为分析纯。
高速冷冻离心机 德国HERMLE Labortechnik GmbH公司;AE-6500垂直电泳槽 日本ATTO公司;UV-1800PC 紫外-可见分光光度计 上海美谱达仪器有限公司;101-1型电热鼓风干燥机 上海实验仪器厂有限公司;日立L-8900全自动氨基酸分析仪 天美(中国)科学仪器有限公司;BS224S型精密电子天平 北京赛多利斯仪器系统有限公司;IMS-40全自动雪花制冰机 常熟市雪科公司。
1.2 实验方法
1.2.1 原料处理及贮藏 采捕上岸后低温干藏6 h运至实验室后,立即进行分选剔除破损死亡个体后进行贮藏处理。蛤仔样本分为原料组和三个处理组,即原料组(Raw)、室温湿藏组Wa(Ambient Wet Storage)、室温干藏组Da(Ambient Dry Storage)及冷却干藏组Dc(Chilled Dry Storage),具体贮藏方式如表1所示。原料组为分选后立即取样;室温湿藏组为分选后的蛤仔放置于盐浓度为2.7 mg/L的海水中净化48 h后,进行取样,期间于24 h时进行一次换水;室温干藏组和冷却干藏组是将蛤仔放置于浸湿海水的毛巾上,同时盖上一条同样处理的毛巾,分别于室温和4 ℃层析柜放置48 h后进行取样。本试验原料选取的是刚刚采捕上岸的菲律宾蛤仔,处于状态较好的时期,刘慧慧等[8]对菲律宾蛤仔保藏的研究中发现,湿藏暂养48 h后,蛤仔的存活率明显下降,为了更贴近产品的加工利用,所以本实验选择48 h贮藏期。
活品贮藏中的菲律宾蛤仔采样后直接进行处理,手工将壳、软体组织以及外套膜液分离;外套膜液通过双层纱布过滤收集,并分装到50 mL离心管中,随即置于-40 ℃保藏;全部软体组织立即匀浆成肉糜,并在干冰速冻后于-40 ℃保藏。
1.2.2 一般化学组成测定 所用原料为各个处理组在-40 ℃保藏的蛤仔外套膜液及经过干冰速冻后的软体组织匀浆。以净化后的样品即室温湿藏组为例,对菲律宾蛤仔的外套膜液及软体匀浆进行一般化学组成的测定。样品经4 ℃解冻后直接进行一般化学组成的测定,采用国标提供的方法测定水分(GB 5009.3-2016第一法 直接干燥法)、灰分(GB 5009.4-2016 第一法 食品中总灰分的测定)、粗蛋白质(GB 5009.5-2-16 第一法 凯氏定氮法)、粗脂肪(GB 5009.6-2016第一法 索氏抽提法)和总糖(GB/T 9695.31-2008第一法 分光光度法),并进行三次重复实验。
1.2.3 蛋白质含量测定 采用双缩脲比色法[11]进行蛋白含量的测定。双缩脲标准曲线采用牛血清蛋白为标准蛋白,将标准蛋白稀释至蛋白浓度为2、4、6、8、10 mg/mL,以稀释蛋白∶双缩脲为1∶4的比例混合均匀,同时进行3组平行实验,室温放置30 min后用紫外可见分光光度计于540 nm下测吸光度值,可得出采用紫外可见分光光度计测定,蛋白浓度的标曲为y=0.0448x,R2=0.9998,可以较为精确地测定蛋白浓度。
将各个处理组在-40 ℃保藏的外套膜液样品在4 ℃下解冻后均质(10000 r/min,30 s)三次,采用双缩脲法比色法,根据标准曲线计算蛋白浓度。
1.2.4 含氮物分离 采用热水浸提法进行分离。将各个处理组在-40 ℃保藏的外套膜液样品在4 ℃下解冻后,于沸水浴中均匀加热1 min,使蛋白质受热变性,冷却后离心(12000×g,10 min),上清液为非蛋白态氮抽提物用于游离氨基酸分析,沉淀物则为蛋白态氮,用于氨基酸组成分析[12]。
1.2.5 游离氨基酸测定 将抽提物与10% TCA(三氯乙酸)按体积比1∶1混匀,离心(10000×g,10 min),用3% TCA稀释样品,吸取上清通过0.45 μm的(水系)针孔过滤膜,滤液采用全自动氨基酸分析仪进行游离氨基酸的测定[13]。
1.2.6 氨基酸组成测定 采用酸水解法(GB 5009.124-2016)测定样品中氨基酸含量。取0.5 g经热水浸提后的沉淀物于水解管中,加入10 mL浓度为6 mol/L的HCl、2滴苯酚,-20 ℃放置5 min,取出后吹入氮气封瓶,于110 ℃放置24 h,冷却后过滤,滤液定容至50 mL,蒸发除去盐酸,用0.02 mol/L HCl稀释样品,通过0.45 μm的(水系)针孔过滤膜,滤液采用全自动氨基酸分析仪进行游离氨基酸的测定。
1.3 数据分析
采用SPSS软件进行单因素方差分析,显著性水平为p<0.05。
2 结果与分析
2.1 菲律宾蛤仔外套膜液的一般化学组成特点
以室温湿藏组为例,对菲律宾蛤仔的软体组织和外套膜液的一般化学组成进行了分析对比。结果如表2所示,软体组织水分含量为81.14 g/100 g,外套膜液为95.70 g/100 g。从干物质组分来看,软体组织的主要成分为粗蛋白55.28 g/100 g,外套膜液主要成分则为灰分69.41 g/100 g,而软体组织的灰分为13.65 g/100 g;外套膜液的粗蛋白虽然明显低于软体组织,但也高达15.82 g/100 g;此外,软体组织的粗脂肪含量高于外套膜液,分别为6.07 g/100 g及3.19 g/100 g;值得关注的是,软体组织与外套膜液的总糖含量差异不大,分别为15.84 g/100 g及15.11 g/100 g。外套膜液的高灰分含量主要有两个原因,一是外套膜液中的无机盐离子成分,另一方面,则由于残留在外套膜液中的泥沙成分所致。

表2 菲律宾蛤仔软体组织与外套膜液一般化学组成分析Table 2 Proximate compositions in soft body and mantle cavity fluid of Ruditapes philippinarum
分析结果还发现,菲律宾蛤仔外套膜液抽提氮含量达0.47 g/100 g,占外套膜液总氮含量即粗蛋白质含量的近70%;相比之下,根据研究报道,菲律宾蛤仔的软体组织的非蛋白氮含量则不到总含氮量的30%[10]。菲律宾蛤仔的外套膜液中含有丰富的以抽提氮为主的蛋白质和碳水化合物,由此,进一步对活品贮藏方法及贮藏过程中外套膜液含氮物和总糖含量进行分析比较。
2.2 活品贮藏对外套膜液含氮物及总糖的影响
2.2.1 外套膜液抽提氮原料组及室温湿藏组、室温干藏组和冷却干藏组的蛤仔外套膜液的抽提氮变化分布 如图1所示。从图1中可以看出,原料蛤仔的外套膜液抽提氮含量显著低于贮藏组(p<0.05),在经过贮藏之后含氮量均有所升高;冷却干藏组含氮量显著高于室温下的湿藏及干藏(p<0.05)。

图1 活品贮藏48 h后的外套膜液抽提氮含量(湿基)Fig.1 Contents of extractive nitrogenin mantle cavity fluid after 48 h live storage(wet basis)注:不同字母表示组别间差异显著(n=3,p<0.05)。图2、图3同。
此外,双缩脲蛋白含量分析结果呈现相同趋势(图2)。原料组蛋白含量最低,外套膜液中仅为4.87 mg/mL,在经过贮藏之后蛋白浓度均显著增高(p<0.05),其中变化最为明显的是冷却干藏组,浓度高达11.37 mg/mL,几乎为原料组的三倍,室温湿藏组和室温干藏组相比原料组也有所升高,蛋白浓度分别为6.81和8.69 mg/mL。总体来看,在不同的贮藏条件下,原料组蛋白质含量显著低于贮藏组(p<0.05),且冷却组的蛋白质含量显著高于室温下的干藏组和湿藏组(p<0.05)。双缩脲法测蛋白浓度具有一定的局限性,因此,双缩脲法对外套膜液进行的蛋白含量测定只能粗略的显示出蛋白含量变化的趋势,而不用于具体分析。
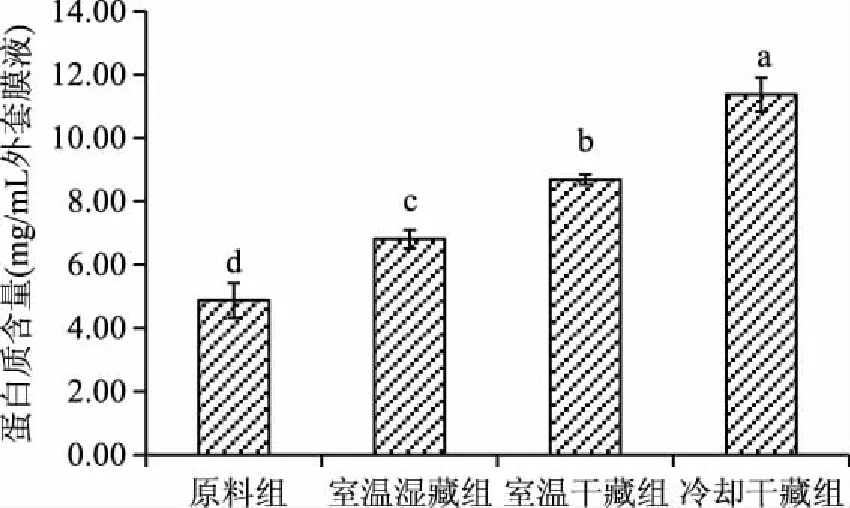
图2 活品贮藏48 h后的外套膜液蛋白含量(湿基)Fig.2 Contents of protein in mantle cavity fluid after 48 h live storage(wet basis)
2.2.2 外套膜液总糖分布 原料组及室温湿藏组、室温干藏组和冷却干藏组的外套膜液总糖含量分析结果如图3所示。总体上来看,原料组的总糖含量最低,但与室温湿藏组相比,并未出现显著差异(p>0.05);在经过干藏处理之后,总糖含量均显著升高(p<0.05),而冷却干藏处理的总糖含量显著高于室温干藏处理(p<0.05)。外套膜液的总糖含量与抽提氮及蛋白态氮的含量测试结果显示出相似的趋势。
与原料组相比,各处理组的外套膜液抽提氮、蛋白质以及总糖的含量(图1~图3)均有所升高,
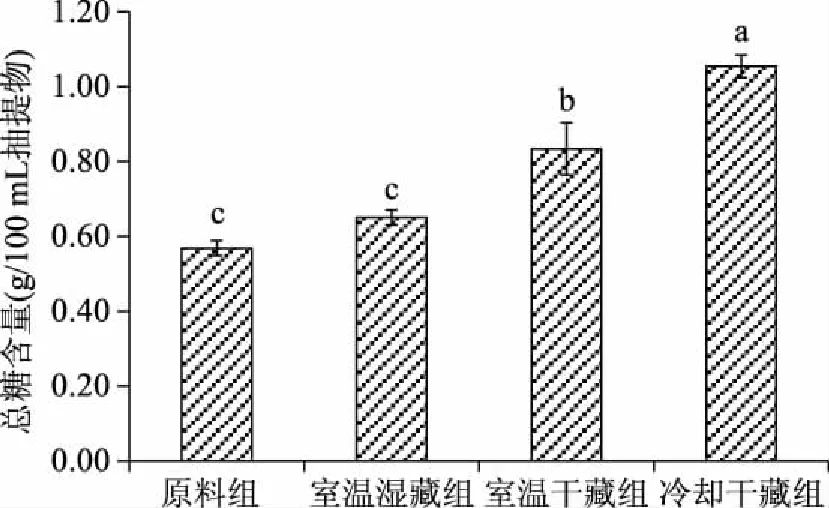
图3 活品贮藏48 h后的外套膜液总糖含量(湿基)Fig.3 Contents of carbohydrates in mantle cavity fluid after 48 h live storage(wet basis)
分析原因,可能是为活品状态的蛤仔外套膜液的含量因蛤仔生命代谢发生了变化,即外套膜液水分降低,导致化学组成成分的不同程度浓缩。进一步分析发现,干藏处置下的各个组分高于湿藏处置,冷却条件高于常温条件,由此来看,冷却干藏更促进外套膜液水分流失。
2.3 活品贮藏对外套膜液氨基酸组成的影响
2.3.1 外套膜液抽提氮的游离氨基酸分布 表3为菲律宾蛤仔外套膜液抽提氮的游离氨基酸分析结果。原料组、室温湿藏组、室温干藏组以及冷却干藏组游离氨基酸总量依次为58.25、77.48、83.47、134.14 mg/100 mL。各组间均存在差异,其中冷却干藏组含量最高,其次为室温干藏组和室温湿藏组,原料组最低。
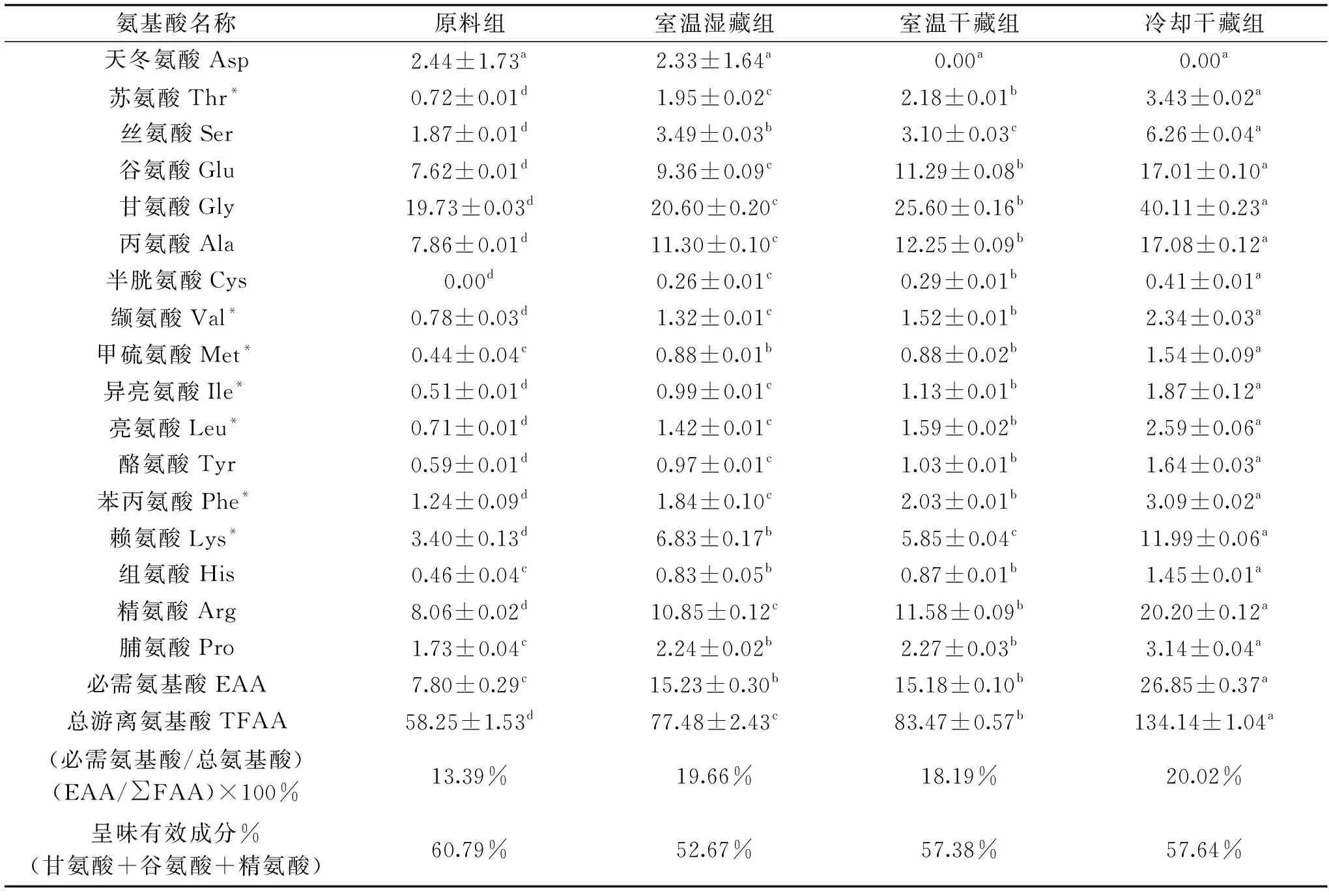
表3 外套膜液抽提氮游离氨基酸含量(mg/100 mL抽提物)Table 3 Contents of free amino acids in mantle cavity fluid extracts(mg/100 mL extracts)
在贻贝的蒸煮液研究中发现其呈味物质丰富[14],在蛤仔中氨基酸有效呈味物质为甘氨酸、L-谷氨酸和L-精氨酸,甘氨酸呈现甜味,谷氨酸可以提供鲜味,精氨酸被认为是多数无脊椎动物的呈味成分,可以提高风味[15]。在表3中可以发现,这三种氨基酸在外套膜液中的含量很高,原料组、室温湿藏组、室温干藏组及冷却干藏组甘氨酸含量分别为19.73、20.60、25.60、40.11 mg/100 mL,谷氨酸含量为7.62、9.36、11.29、17.01 mg/100 mL,精氨酸含量为8.06、10.85、11.58、20.20 mg/100 mL,在不同贮藏条件下,三种氨基酸总含量均占到总游离氨基酸的50%以上。除了这三种氨基酸外,丙氨酸的含量也相对较高,分别为7.86、11.30、12.25、17.08 mg/100 mL,丙氨酸也是一种常见的能使人感到甜味的氨基酸,因此,菲律宾蛤仔的外套膜液在开发海鲜调味料方面极具开发潜力[16]。
此外,除了分析方法所限(色氨酸),其它7种必需氨基酸包括苏氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸及赖氨酸均有检测,其中赖氨酸含量最高,原料组、室温湿藏组、室温干藏组及冷却干藏组赖氨酸含量分别为3.40、6.83、5.85、11.99 mg/100 mL。从表3可知,原料组、室温湿藏组、室温干藏组和冷却干藏组必需氨基酸占总游离氨基酸的比值,在不同活品状态的蛤仔之间存在一定差异,换言之,贮藏方式和条件对外套膜液的化学组成特性有一定影响。此外,游离氨基酸分析表明,菲律宾蛤仔外套膜液不仅具有调鲜功能,而且还可以提供人体所需的必需氨基酸,尤其是赖氨酸。
2.3.2 外套膜液蛋白氮的氨基酸组成 表4为菲律宾蛤仔外套膜液蛋白态氮的氨基酸组成分析结果。由表4可知,室温湿藏组及冷却干藏组整体无显著差异(p>0.05),且这两个处理组均显著高于原料组及室温干藏组(p<0.05);各组必需氨基酸含量占总氨基酸的百分比结果表明,原料组、室温湿藏组、室温干藏组以及冷却干藏组比值为25.54%、37.46%、27.13%、28.84%。对原料组及不同贮藏组必需氨基酸含量进行比较,发现室温湿藏组的必需氨基酸含量占总氨基酸的比值达到37.46%,而其他三组均未达到30%以上。室温湿藏组高于其它组的原因,与活品生命代谢关系不大,可能是由于生物样本自身的个体差异所致。
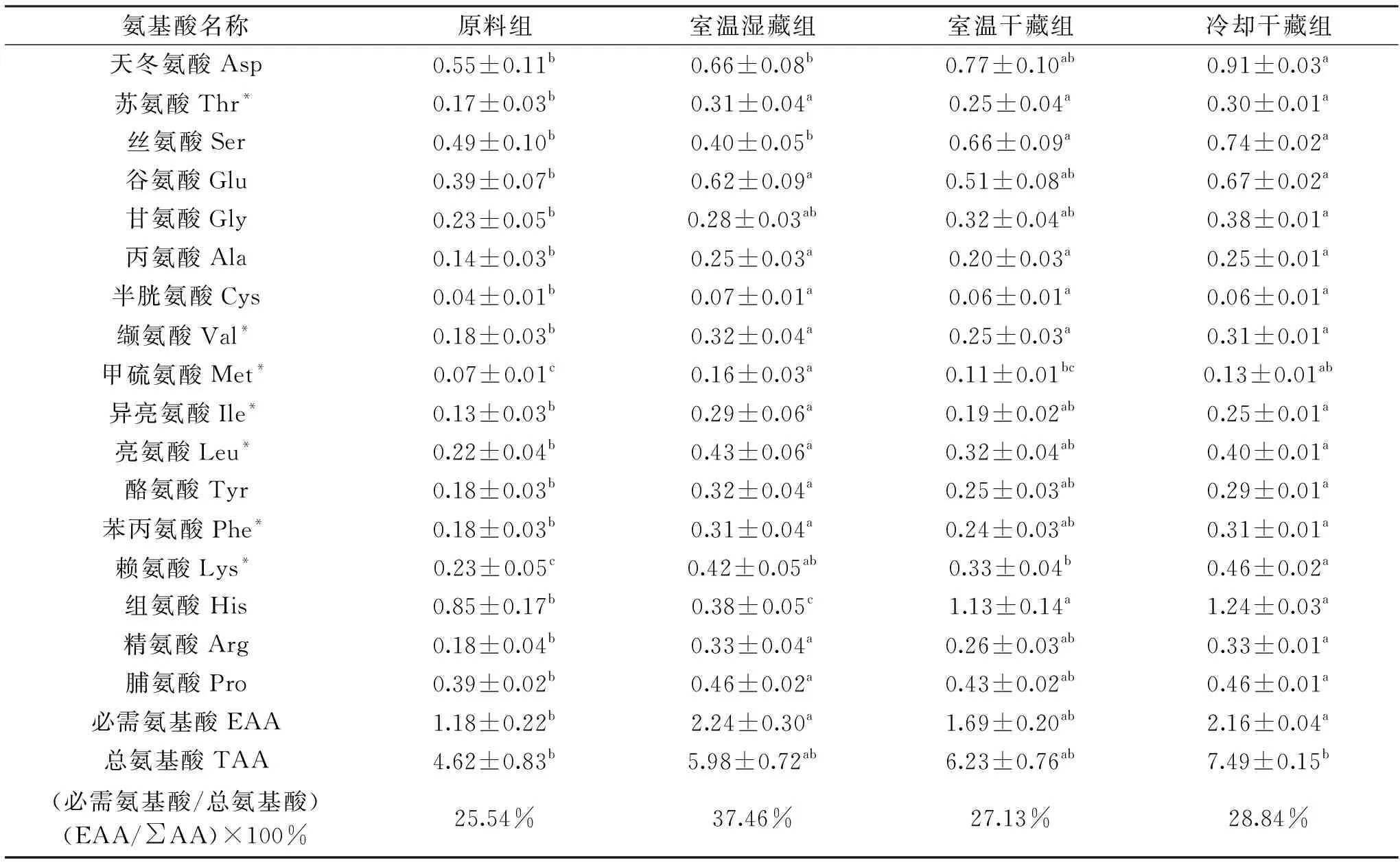
表4 外套膜液蛋白态氮氨基酸组成(g/100 g沉淀物)Table 4 Composition of amino acids in protein nitrogen of mantle cavity fluid(g/100 g precipitate)
3 结论
菲律宾蛤仔外套膜液中水分含量高达95.70 g/100 g;干物质中主要由灰分、粗蛋白及总糖组成,含量分别为69.41、15.82及15.11 g/100 g;含氮物中70%左右为非蛋白态即抽提氮。与原料组相比,三个贮藏组的总氮、抽提氮、游离氨基酸和总糖有明显升高趋势,生命代谢及水分流失是产生波动的主要原因,且冷却干藏组受到的影响最显著(p<0.05)。各个处理组氨基酸含量虽然存在明显差异,其中有效呈味氨基酸(甘氨酸、谷氨酸和精氨酸)占总游离氨基酸的50%以上,呈甜味的氨基酸丙氨酸含量也较高;蛋白态氮和抽提氮中均检测到了人体所需要的必需氨基酸(苏氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸及赖氨酸),而且在蛋白态氮中含量较高,其中赖氨酸含量最高。菲律宾蛤仔外套膜液的美味和营养优势,为开发高附加值鲜味剂提供参考。本文仅对菲律宾蛤仔氨基酸呈味物质进行了分析,其他呈味物质如无机盐、多肽、核酸、有机碱和糖等还有待进一步研究。

