桉叶精油对水产品中4种微生物的 抑菌效果及抑菌机理
昝春兰,汤海青,欧昌荣,*,李亚敏,张梦思,苏文华
(1.宁波大学食品科学与工程系,浙江宁波 315211; 2.浙江医药高等专科学校食品学院,浙江宁波 315100)
微生物是造成食品腐败的主要因素,水产品因其较高的水分和蛋白质含量更易腐败。新鲜水产品中栖息的微生物复杂多样,主要是一些革兰氏阴性杆菌,如希瓦氏菌(Shewanellasp.)、弧菌(Vibriosp.)、假单胞菌(Pseudomonassp.)、不动杆菌(Acinetobactersp.)、发光杆菌(Photobacteriumsp.)、莫拉氏菌(Moraxellasp.)和黄杆菌(Flavobacteriumsp.)[1],但其中只有少数微生物能够适应后续贮藏环境,并快速生长繁殖而逐渐成为优势菌群,占据主导地位,这些少数微生物即特定腐败菌(Specific spoilage organisms)[2]。腐败希瓦氏菌是大多数水产品中的优势腐败菌,特别是在有氧冷冻或冷冻状态下[3]。副溶血性弧菌是海产品中的主要致病菌。金黄色葡萄球菌和大肠杆菌是自然界中分布最广泛的微生物,在水产品加工过程中最易繁殖[3-4]。过去常用化学防腐剂来消除或减少微生物的影响,但是研究发现,使用化学防腐剂对食品或环境均有不利的影响,近年来,随着“绿色”消费理念深入人心,绿色、天然抑菌剂尤其是植物精油受到广泛关注[5]。
植物精油,亦称植物挥发油,是从芳香植物中提取的具有挥发性和浓郁香味的脂溶性天然化合物[6]。近年来,由于植物精油具有高效抗菌作用,被用于水产品中致病菌和腐败菌的控制,如红鼓鱼(Sciaenopsocellatus)、金头鲷(Sparusaurata)、扁鲹(Pomatomussaltatrix)和剑鱼(Xiphiasgladius)等[7]。桉叶精油是从桃金娘科植物蓝桉或其同属其他植物的叶和嫩枝中提取而来的挥发油,其主要化学成分为小分子的萜类物质,且多为极性较弱或无极性的小分子物质[8]。大量的研究表明,桉叶精油对细菌、真菌等均有不同程度的抑制作用,且被广泛应用于食品、医药、化工等各个行业,具有很大的开发前景和应用价值[9]。Hao Lu等[10]研究发现,桉叶精油对假单胞菌属具有较强的抑制作用。岳淑丽等[11]发现,桉叶精油对真菌和霉菌均有一定的抑制效果。但是有关桉叶精油对水产品常见微生物的抑菌效果及抑菌机理等方面的研究鲜有报道。
本实验通过滤纸片法和倍比稀释法,研究桉叶精油对水产品中4种微生物(大肠杆菌、金黄色葡萄球菌、腐败希瓦氏菌和副溶血性弧菌)的抑菌活性,进一步以腐败希瓦氏菌和金黄色葡萄球菌为实验对象,通过扫描电镜、透射电镜、电导率、核酸含量、细胞内ATP含量分析植物精油的抑菌机理,旨在为桉叶精油更好地运用于水产品行业提供新的理论依据。
1 材料与方法
1.1 材料与仪器
大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、腐败希瓦氏菌(Shewanellaputrefaciens)、副溶血性弧菌(Vibrioparahaemolyticus) 宁波大学海洋学院微生物实验室提供;桉叶精油(纯度为82.3%)、丁香精油(纯度为85.3%)、薄荷精油(纯度为98.2%) 江西鑫森天然植物油有限公司;茶树精油(纯度为100%) 福州美乐莲生物科技有限公司;60 g/L氯化钠蛋白胨水 青岛海博生物技术有限公司;LB肉汤、LB琼脂、吐温-80、PBS缓冲液、50%戊二醛、丙酮等试剂 均为分析纯,国药集团化学试剂有限公司;锇酸、环氧丙烷、环氧树脂 SPI-Chem公司;ATP含量测定试剂盒 南京建成生物工程研究所。
MDF-U548D-C医用低温箱 大连三洋冷链有限公司;LDZX-30KBS型立式压力蒸汽灭菌锅 上海申安医疗器械厂;BCD-201ED冰箱 海尔集团;H1850冷冻离心机 湖南湘仪实验室仪器开发有限公司;UV-5200紫外-可见分光光度计 上海元析仪器有限公司;20 nm E-1010真空离子溅射镀金膜机、S-3400N扫描电子显微镜、JEM-1230透射电子显微镜 日本日立公司;Infinite 200酶标仪 瑞士TECAN公司。
1.2 实验方法
1.2.1 菌悬液的制备 取甘油保藏的大肠杆菌、金黄色葡萄球菌和腐败希瓦氏菌,均在LB肉汤中于37 ℃、150 r/min条件下活化24 h,吸取1 mL活化的菌悬液,在100 mL LB肉汤中,于37 ℃、150 r/min条件下扩大培养24 h;取副溶血性弧菌,在60 g/L氯化钠蛋白胨水中,于30 ℃、150 r/min条件下,活化及扩大培养24 h;用平板计数法测定最终菌悬液浓度为107cfu/mL,备用。
1.2.2 抑菌圈的测定 参考Bektas Tepe[12]的方法并略作修改,采用滤纸片法测定抑菌圈大小。吸取100 μL菌液,均匀涂布于相应菌种的培养基表面。其中大肠杆菌、腐败希瓦氏菌和金黄色葡萄球菌所需培养基为LB琼脂,副溶血性弧菌所需的培养基为添加有琼脂的60 g/L氯化钠蛋白胨水。无菌镊子夹取已干燥的滤纸片(直径约6 mm)置于培养基中央,取5 μL植物精油于滤纸片上,将含有菌液和植物精油的平板置于恒温培养箱中,大肠杆菌、金黄色葡萄球菌和腐败希瓦氏菌分别在37 ℃下培养24 h,副溶血性弧菌于30 ℃下培养24 h。用游标卡尺来测定抑菌圈直径大小,每种细菌做三个重复,取平均值。同时每组实验中,以放置无菌滤纸片的培养皿作为对照。
1.2.3 最低抑菌浓度(MIC)的测定 参考王芳等[13]的方法并略作修改。对于滤纸片法初步筛选到的具有较好抑菌效果的植物精油,采用倍比稀释法测定其对供试菌的最低抑菌浓度(MIC)。精油溶解在1.0%(v/v)吐温-80中,倍比稀释法调整浓度范围为0.1%~2.0%,分别加入含有5 mL液体培养基的试管中,其中大肠杆菌、腐败希瓦氏菌和金黄色葡萄球菌所需培养基为LB肉汤,副溶血性弧菌所需的培养基为60 g/L氯化钠蛋白胨水,使其最终浓度为0.05%、0.063%、0.075%、0.100%、0.125%、0.150%、0.200%和0.250%。然后加入50 μL已制备好的107cfu/mL的菌悬液,充分摇匀,大肠杆菌、金黄色葡萄球菌和腐败希瓦氏菌分别于37 ℃下培养24 h,副溶血性弧菌于30 ℃下培养24 h。明显抑制细菌生长(无浊度表示)的最低桉叶精油浓度为最低抑制浓度值。以不添加精油的菌液作为对照组。
1.2.4 扫描电镜(SEM)和透射电镜(TEM)观察 参考Hao Lu等[10]的方法并略作修改。分别在制备好的浓度为107cfu/mL的腐败希瓦氏菌和金黄色葡萄球菌菌悬液中,加入浓度为MIC的桉叶精油,充分摇匀后,在37 ℃培养3 h,离心(5000 r/min,15 min,4 ℃),弃去上清液,用PBS缓冲液(0.1 mol/L,pH=7.4)漂洗三次,将菌体于2.5%的戊二醛固定液中,-4 ℃条件下固定,备用。
1.2.4.1 扫描电镜观察 用PBS缓冲液(0.1 mol/L,pH=7.4)冲洗3次,每次15 min,然后经系列乙醇(30%、50%、70%、80%、90%、100%)逐级洗脱样品,每次脱水3 min,间隔10 min,其中100%乙醇脱水2次。叔丁醇与无水乙醇逐级(1∶3、1∶1、3∶1)洗脱样品,每次脱水10 min,最后用纯叔丁醇洗脱1次。再经过-40 ℃下真空冷冻干燥24 h,粘样、镀膜后于S-3400N型SEM下观察、拍照。取两个平行进行观察。
1.2.4.2 透射电镜观察 用PBS缓冲液(0.1 mol/L,pH=7.4)冲洗3次,每次15 min。用1%锇酸固定2 h,PBS冲洗3次,后经系列乙醇(体积分数为30%、50%、70%、90%)逐级脱水,再用现配90%丙酮和无水丙酮分别洗脱1次、3次,每次15 min。环氧丙烷和环氧树脂1∶1(v/v)混合后,作为浸透剂浸透样品1 h,之后用纯环氧树脂包埋,置于37、45 ℃下分别聚合24 h,最后转入60 ℃温箱过夜。待样品块凝固后,修块,经铀、铅双染后,于JEM-1230型TEM下观察、拍照。取两个平行进行观察。
1.2.5 电导率的测定 参考Suxia Shen等[14]的方法并略作修改。分别将已制备好的浓度为107cfu/mL的腐败希瓦氏菌和金黄色葡萄球菌菌悬液离心(5000 r/min,10 min,4 ℃),用PBS(0.1 mol/L,pH=7.0)漂洗、重悬后加入浓度为MIC的桉叶精油,混匀后立即取出5 mL,离心(5000 r/min,10 min,4 ℃)取上清液,稀释10倍,用电导率仪测定电导率。菌悬液续培养3 h,按上述方法测定上清液的电导率。以不添加精油的菌液为对照组。
1.2.6 核酸含量的测定 参考Evandro Leite de Souza[15]的方法并略作修改。分别将已制备好的浓度为107cfu/mL的腐败希瓦氏菌和金黄色葡萄球菌菌悬液离心(5000 r/min,10 min,4 ℃),用PBS(0.1 mol/L,pH=7.0)漂洗、重悬后加入浓度为MIC的桉叶精油,混匀后立即取出2 mL,离心(5000 r/min,10 min,4 ℃)取上清液,在260 nm波长下测定吸光值,计算菌液中核酸的含量。以不添加精油的菌液为对照组。
1.2.7 三磷酸腺苷(ATP)含量的测定 参考Bajpai[16]的方法并略作修改。分别将已制备好的浓度为107cfu/mL的腐败希瓦氏菌和金黄色葡萄球菌菌悬液离心(5000 r/min,10 min,4 ℃),用PBS(0.1 mol/L,pH=7.0)漂洗、重悬后加入浓度为MIC的桉叶精油,混匀后立即取出2 mL,离心(5000 r/min,10 min,4 ℃)取其沉淀,用南京建成生物工程研究所ATP含量测定试剂盒测定。
1.2.8 数据统计与分析 试验结果用平均值±标准差表示。采用SAS 8.0中one-way ANOVA的Duncan’s Multiple Range Test模型进行统计学分析,p<0.05为显著性差异水平,使用Origin Pro 8.5作图。
2 结果与分析
2.1 4种植物精油的抑菌活性
通过抑菌圈的直径大小,能够初步评价植物精油的抑菌效果[17]。一般而言,革兰氏阴性菌对植物精油的耐受性要优于革兰氏阳性菌,这是因为,革兰氏阴性菌细胞壁外侧含有一层脂多糖,能够阻止疏水性的化合物进入到菌体细胞体内,从而降低了抑菌效果[18]。植物精油(桉叶精油、薄荷精油、茶树精油、丁香精油)对四株供试菌种(大肠杆菌、金黄色葡萄球菌、腐败希瓦氏菌、副溶血性弧菌)的抑菌活性测定结果如表1所示。植物精油作用于革兰氏阳性菌金黄色葡萄球菌所得的抑菌圈直径最大,说明4种植物精油对金黄色葡萄球菌均有最强的抑制作用。同时,桉叶精油对四种供试菌的抑菌圈直径显著大于其他三种植物精油的抑菌圈直径(p<0.05),说明桉叶精油对四种供试菌种的抑菌活性最强,其次是丁香精油、茶树精油、薄荷精油。Gilles等[19]发现桉叶精油具有较强的抗菌活性,其中最丰富的成分为1,8-桉叶素。Lis-Balchin等[20]发现富含1,8-桉叶素的植物精油比不含1,8-桉叶素的植物精油具有广谱的抗菌性。因此,选定桉叶精油作为研究对象进行后续的实验。

表1 4种植物精油对供试菌的抑菌圈直径Table 1 The inhibition zone diameters of four essential oils against bacterial tester strains
2.2 桉叶精油的最低抑菌浓度(MIC)
最低抑菌浓度(MIC)是评价植物精油抑菌效果的常用指标,植物精油的MIC值越小,说明其抑菌效果越好[21]。表2列出桉叶精油对不同供试菌种的MIC值,由表可知,4种供试菌均对桉叶精油较敏感。研究表明,丁香精油对金黄色葡萄菌的MIC值为1.25 μL/mL[22],茶树精油对金黄色葡萄球菌的MIC值为0.78 μL/mL[23],薄荷精油对金黄色葡萄球菌的MIC值为2.5 μL/mL[24],均高于本文中桉叶精油对金黄色葡萄球菌的MIC值0.63 μL/mL,说明桉叶精油对金黄色葡萄球菌的抑菌效果均强于其他三种精油,且桉叶精油对革兰氏阴性菌的MIC值均高于革兰氏阳性菌,说明革兰氏阴性菌对桉叶精油的敏感性低于革兰氏阳性菌,这与本文抑菌圈的研究结果一致。
此外,抑菌物质的抑菌圈大小和MIC值存在相关性,抑菌圈越大,MIC值越小[21]。结合表1、表2可知,桉叶精油作用于腐败希瓦氏菌的抑菌圈直径最小,而作用于腐败希瓦氏菌的MIC值最大,这与本文研究的结果一致。但也有例外,S Pattnaik等[25]研究植物精油对绿脓假单胞菌的抑菌效果时发现,其抑菌圈直径和MIC值均较大,可能是由于精油发挥作用时的状态不同,也可能是由于植物精油各种成分之间存在协同作用[26]。

表2 桉叶精油对供试菌种的最低抑菌浓度(MIC)Table 2 Minimal inhibitory concentration(MIC)of eucalyptus oil against bacterial tested strains
2.3 桉叶精油对腐败希瓦氏菌和金黄色葡萄球菌细胞形态和超微结构的影响
选定腐败希瓦氏菌和金黄色葡萄球菌作为水产品中常见微生物的革兰氏阴性菌和阳性菌的代表,进行抑菌机理的研究。扫描电镜图可以从形态学方面来说明桉叶精油的抑菌机理[27]。桉叶精油对细菌细胞形态影响如图1所示。对照组细菌细胞表面平整、光滑,形态较完好;经桉叶精油处理3 h后,菌体形态遭到破坏,部分菌体发生扭曲变形,表面出现明显的凹陷、褶皱或空洞。由此可知,桉叶精油对革兰氏阴性菌和革兰氏阳性菌的细胞形态均有一定的破坏作用。
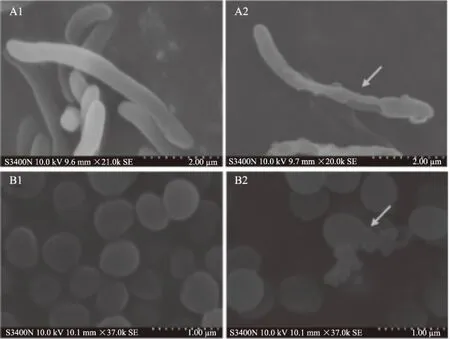
图1 腐败希瓦氏菌(A1、A2)和金黄色葡萄球菌(B1、B2)的扫描电镜图Fig.1 Pictures of the scanning electron microscopy of S. putrefacens(A1,A2)and B. cereus(B1,B2)注:A1(腐败希瓦氏菌)、B1(金黄色葡萄球菌)分别为对照组;A2(腐败希瓦氏菌)、B2(金黄色葡萄球菌)分别为处理组。
透射电镜图可以从超微结构方面来说明桉叶精油的抑菌机理[27]。桉叶精油对细菌超微结构的影响如图2所示。对照组细菌细胞饱满,结构清晰,细胞膜较完整,细胞质分布较均匀。经桉叶精油处理3 h后,细胞壁出现变形,发生质壁分离现象,细胞膜褶皱,细胞质浓缩,细胞内物质分布不均匀。可见,桉叶精油对细菌细胞的超微结构也产生了一定的破坏作用,这与扫描电镜的结果一致。由于桉叶精油具有疏水性,其首先作用于细菌细胞膜,使其通透性增加,导致细胞内小分子物质泄露,细胞代谢紊乱以及细胞不可逆损伤,从而造成细胞的裂解和死亡[28]。此外,桉叶精油内的活性成分能够阻止细胞分裂,改变细胞分裂周期,对细菌细胞造成不利的影响[29]。

图2 腐败希瓦氏菌(A1、A2)和金黄色葡萄球菌(B1、B2)的透射电镜图Fig.2 Pictures of the transmission electron microscopy of S. putrefacens(A1,A2)and B. cereus(B1,B2)注:A1(腐败希瓦氏菌)、B1(金黄色葡萄球菌)分别为对照组;A2(腐败希瓦氏菌)、B2(金黄色葡萄球菌)分别为处理组。
2.4 桉叶精油对腐败希瓦氏菌和金黄色葡萄球菌电导率的影响
电导率的变化可以反映桉叶精油对细菌细胞膜通透性的影响[30]。如图3所示,桉叶精油作用于细菌3 h后,实验组菌液上清液中电导率显著增加(p<0.05),实验组腐败希瓦氏菌的初始值为869.00 μs/cm,处理3 h后,增加到878.33 μs/cm,对照组菌液电导率变化幅度较小,金黄色葡萄球菌组也呈现类似的变化结果,说明桉叶精油作用于细菌后使得细菌细胞膜的通透性增大,这与吕飞[30]的研究结果一致。菌体细胞膜形成一道屏障,其选择性透过 K+、Na+、H+等小分子物质,可维持适合细菌生存的稳定内环境,并在维持胞膜功能、酶活性和菌体正常代谢方面起到至关重要的作用[31]。桉叶精油作用于细胞膜后,使这种离子稳态遭到破坏,电解质的大量泄漏瓦解了细胞质膜的屏障,影响菌体的代谢,最终导致菌体死亡。同时,胞内离子对维持细胞内外渗透压有重要的作用,胞内离子的流失会影响胞内外渗透压的调节,使得细胞吸胀、破裂而死亡[32]。

图3 桉叶精油对腐败希瓦氏菌 和金黄色葡萄球菌电导率的影响Fig.3 Effect of eucalyptus oil on the electric conductivity of S. putrefacens and B. cereus注:A:腐败希瓦氏菌,B:金黄色葡萄球菌;不同小写字母 代表同种菌间差异显著(p<0.05);图4~图5同。
2.5 桉叶精油对腐败希瓦氏菌和金黄色葡萄球菌核酸含量的影响
菌体内核酸等内容物的释放可反映桉叶精油对菌体细胞膜完整性的影响,通过测定上清液在260 nm处的吸光值的变化来推测细胞膜完整性的变化[16]。由图4可知,经过MIC处理的细菌在260 nm处的吸光度值大于对照组,随着处理时间的延长,其吸光值有所上升,这与电导率的实验结果一致,表明桉叶精油破坏了菌体细胞膜完整性。核酸类大分子物质贯穿于整个胞膜和胞质当中,是重要的单位结构物质,核酸的释放则表明细胞膜完整性遭到了破坏[33]。桉叶精油可以作用于菌体细胞膜而对细胞造成不可逆损伤,引起细胞核酸等内容物的释放,导致细胞死亡。

图4 桉叶精油对腐败希瓦氏菌 和金黄色葡萄球菌核酸含量影响Fig.4 Effect of eucalyptus oil on the nucleic acid content of S. putrefacens and B. cereus
2.6 桉叶精油对腐败希瓦氏菌和金黄色葡萄球菌细胞内ATP含量的影响
ATP在细胞膜物质运输工作中起着很重要的作用,因此,通过分析细胞内ATP含量的变化可以分析其抑菌机理[29]。由图可知,对照组样品细胞内ATP含量变化很小,而处理组样品经过桉叶精油的处理后细胞内ATP含量显著降低(p<0.05)。这可能是因为桉叶精油作用于细菌后导致细胞膜损伤,从而对细菌的生理活性有不利影响,导致样品细胞内ATP含量的下降[34]。另外,细胞内ATP含量的降低也可能是由于电解质的损失导致细胞内ATP合成速率与水解速率重新转化,从而保持原来的电化学梯度[35]。因此,桉叶精油的抑菌作用可能也是抑制其质子动力机制、电子传递链以及三羧酸循环等。总之,电解质的泄露、A260 nm的降低以及细胞内ATP含量的降低等综合现象表征桉叶精油作用于细菌细胞后导致细胞的裂解、死亡。

图5 桉叶精油对腐败希瓦氏菌 和金黄色葡萄球菌细胞ATP含量的影响Fig.5 Effect of eucalyptus oil on the ATP content of S. putrefacens and B. cereus
3 结论
本文研究了四种植物精油(桉叶精油、薄荷精油、茶树精油和丁香精油)对水产品中4种常见微生物(大肠杆菌、腐败希瓦氏菌、金黄色葡萄球菌和副溶血性弧菌)的抑菌活性,结果发现桉叶精油的抑菌圈最大,说明桉叶精油对这4种微生物均具有最强的抑菌特性,因此桉叶精油可以作为水产品中常见微生物的潜在抑菌物质。选择腐败希瓦氏菌和金黄色葡萄球菌为代表,进一步阐述了桉叶精油的抑菌机理,扫描电镜图和透射电镜图显示,桉叶精油改变了菌体细菌的形态和超微结构,电导率和核酸含量的升高,细胞内ATP含量降低,表明桉叶精油造成细胞内电解质和核酸等物质的泄露以及ATP含量的减少,说明桉叶精油改变了细胞膜的通透性和完整性,使其受到不可逆损伤,从而进一步导致其质子动力机制等的改变,影响细菌的正常代谢活动,造成细胞的裂解和死亡。本实验为桉叶精油作为一种天然抑菌物质应用于水产品行业提供了理论依据。

