外源ABA喷施提高番茄幼苗抗旱性研究
许向阳,陈小玉,赵婷婷,杨欢欢,张 贺,李景富
(东北农业大学园艺园林学院,哈尔滨 150030)
番茄是重要的蔬菜作物之一,产量高且营养丰富。干旱导致植物光合电子还原链过度还原,其线粒体及叶绿体内产生过量活性氧,损坏植物细胞膜系统[1],影响番茄正常生长发育,产量和品质下降。番茄品种对干旱表现敏感,特别是发芽、幼苗阶段。采取一定措施减轻干旱对幼苗伤害,提高幼苗抗旱性,对番茄栽培、生产具有重要意义。
近年来,选用类似脱落酸(ABA)等外源化学物质处理植物以提高其抗逆性(干旱、低温、高盐)研究取得重大进展[2]。ABA广泛分布于高等植物体内,不仅调节植物生长发育且的干旱等非生物逆境也有一定调节作用。当植物遭受逆境胁迫时,ABA在植物体内含量不断累积[3],可缓解干旱等逆境对植物伤害,定向增强作物的环境适应能力,提高作物抗逆性[4],ABA也被称为植物“胁迫激素”。近年,ABA抗旱作用备受关注。植物在缺水环境下,叶片ABA含量增加,促使保卫细胞K+外渗,促进孔隙封闭,减少蒸腾和水分流失,使叶片细胞保持一定水分条件,提高植物干旱耐受性[5]。在甘蔗[6]、棉花[7]、大豆[8]、小麦[9]、玉米[10-11]等主要农作物研究中发现,ABA可不同程度减轻干旱对作物的影响。李长宁等和姚满生等发现干旱胁迫下ABA处理可降低甘蔗幼苗和棉花幼苗细胞膜上结构骨架磷脂分子氧化,增强抗氧化酶活性,减少过氧化物产生,一定程度上保护细胞膜,提高甘蔗及棉花幼苗抗旱性[6-7]。
目前,关于ABA减缓番茄幼苗干旱胁迫,提高抗旱性研究尚无报道。ABA亦称S-抗诱素,是启动植物体内抗逆基因表达的信号分子,可诱导某些抗逆基因表达[12-13]。本研究对4叶期番茄幼苗作适量ABA喷施和干旱处理,分析其生理生化指标变化,通过cDNA-AFLP技术筛选ABA诱导后干旱胁迫下番茄幼苗差异表达基因表达模式上调的抗旱相关候选基因片段,利用实时荧光定量PCR技术验证基因表达量模式,为外源喷施ABA提高番茄幼苗抗旱性研究奠定基础。
1 材料与方法
1.1 供试材料与处理
试验材料为番茄栽培品种Moneymaker,试验于2017年8~11月在东北农业大学园艺站连栋温室内完成。采用苗盘育苗,两叶时分苗于10 cm×10 cm营养钵中,常规培养。苗长至四叶一心时,每天早上8点喷施处理叶片。设置4组处理,处理1:清水+干旱处理(CK);处理2:清水(CK1);处理3:300μL·L-1ABA处理(CK2);处理4:300μL·L-1ABA+干旱处理(A),20株为1个处理组。连续4 d对叶片药物喷施处理,喷施时以叶片表面附着1层液珠为准,处理期间以见干见湿为原则对幼苗浇水,第4天喷施后营养钵浇透水,进入干旱处理不再浇水,记当天为0 d。
于1、3、5、7 d分别对CK和A处理叶片取样,测定生理指标;同时分别在0、12、24、36、48、72 h时对CK、CK1、CK2、A所有处理组取适量叶片,液氮速冻存放在-80℃冰箱中,提取RNA用于cDNA-AFLP分析及实时荧光定量PCR验证。作3次生物学重复。
1.2 测定项目及方法
参照李合生常规饱和、烘干称量方法测定叶片相对含水量,抽气法测定叶片相对电导率[14]。以氮蓝四唑光化还原法测定超氧化物歧化酶(SOD),过氧化氢酶还原法测定过氧化氢酶(CAT),愈创木酚法测定过氧化物酶(POD)活性,硫代巴比脱酸法测定丙二醛(MDA)含量[14],结合高俊凤[15]方法稍加改动。
Trizol法从叶片中快速提取总RNA。由Ndrop 2000微量分光光度计测定260 nm吸收值计量总RNA浓度,以260 nm/230 nm及260 nm/280 nm吸收值比值衡量其纯度。采用1%琼脂糖凝胶电泳和溴化乙啶染色分析RNA完整性。选用TaKaRa(大连生物工程公司)cDNA Synthesis kit(Clontech)双链试剂盒合成双链cDNA。按试剂说明书步骤操作,采用紫外分光光度法测定双链cDNA浓度。
选取Eco RⅠ和MseⅠ两种内切酶酶切双链cDNA,待产物与接头(见表1)连接后用于预扩增。以BLAST对提交到NCBI数据库中差异目的基因片段序列比对基因相似性,推测与之相关功能。采用荧光染料嵌合法,对内参基因(番茄actin基因)和目的基因片段作实时荧光定量PCR(iQ5 Real Time PCRDetection System),目的基因相对表达量分析采用 2-ΔΔCt法。
1.3 数据分析
运用Microsoft Excel 2013和SPSS 17.0软件分析数据差异显著性。

表1 cDNA-AFLP接头和引物序列信息Table 1 cDNA-AFLPadapter and primer sequences
2 结果与分析
2.1 干旱胁迫下外源ABA对番茄幼苗叶片相对电导率和相对含水量的影响
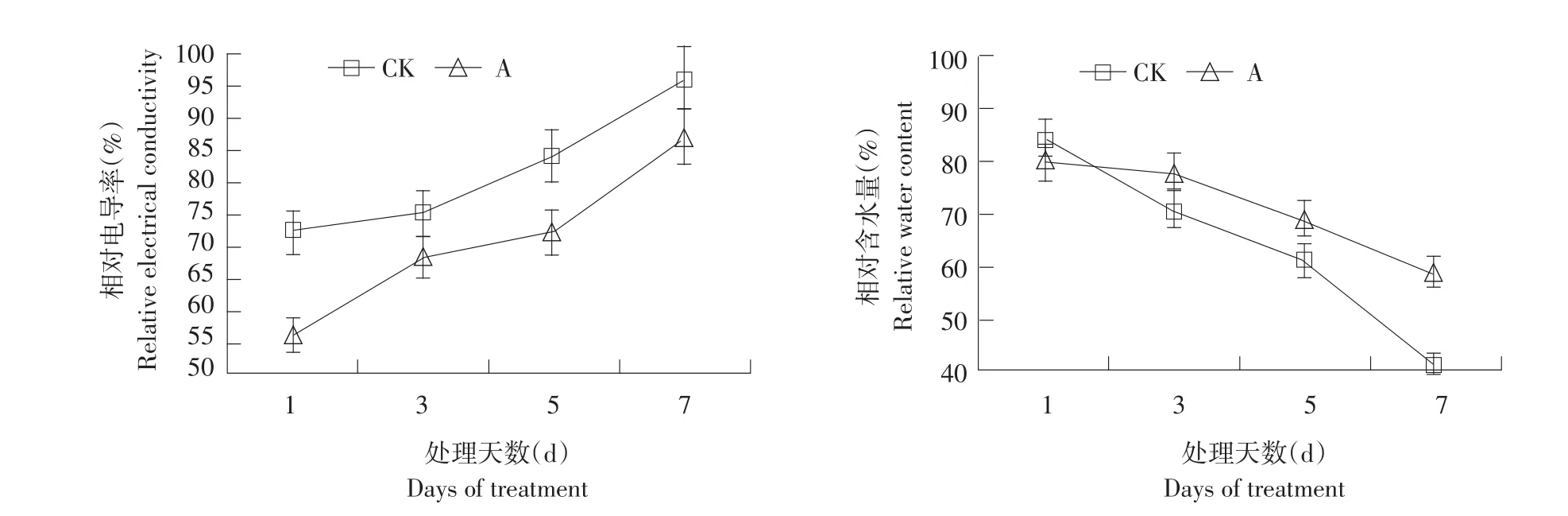
图1 干旱胁迫下ABA对番茄幼苗叶片相对电导率与相对含水量的影响Fig.1 Influence of ABA on relativeelectrical conductivity and relativewater content of tomato seedling leaves under drought stress
如图1可知,干旱第1天,CK相对电导率明显高于A处理,后期A处理和CK均呈上升趋势,但A处理相对电导率始终小于CK,且差异显著。相反,干旱初期,CK相对含水量稍高于A处理,经干旱处理后,CK叶片含水量直线下降,第5天后,下降趋势更加显著,A处理前3 d虽略有下降但趋势平缓,3 d后才明显下降,但相对含水量始终高于CK,差异显著。
2.2 干旱胁迫下外源ABA对番茄幼苗抗氧化酶活性和丙二醛含量的影响
由图2可知,干旱第1天,CK和A处理SOD、CAT、POD活性值差异较小,随干旱时间延长,3种抗氧化酶活性值均呈明显上升趋势,但SOD活性值第3天达峰值后下降,第5天又稍有上升,CAT活性值第5天达峰值后下降,而POD活性值始终呈上升趋势。A处理抗氧化酶活性较CK上升更明显,干旱后期活性值较初期差异显著。相反,丙二醛含量CK始终高于A处理,干旱前3 d,CK和A处理丙二醛含量变化小,3 d后,CK丙二醛含量显著上升,A处理稍有升高,CK与A处理差异显著。

图2 ABA对番茄幼苗干旱胁迫下抗氧化酶活性及丙二醛含量的影响Fig.2 Influence of ABA on antioxidant activitiesand MDA content of tomato seedlings under drought stress
2.3 干旱胁迫下外源ABA对番茄幼苗基因表达的影响
2.3.1 差异表达TDFs分离
利用64对引物组合对CK2和A3处理叶片cDNA选择性扩增,共筛选得到112条差异表达TDF(见图3)。根据条带有无和扩增条带强弱,TDF表达模式可归为以下几类:①干旱诱导或增强表达,这类TDF仅在干旱处理的两组中特异表达或亮度增加;②ABA诱导型基因,部分TDF仅在ABA处理组中特异表达或亮度增加;③ABA抑制基因,此类TDF仅在非ABA处理组中表达;④干旱和ABA同时诱导或ABA加强诱导,TDF仅在ABA+干旱处理组中表达或亮度增加;⑤ABA+干旱抑制表达,少数TDF仅ABA+干旱下不表达;⑥干旱或ABA抑制表达,仅在无任何处理CK1中表达;⑦干旱抑制表达,在非干旱处理下表达。本试验中,干旱下ABA加强基因表达均属于本研究需获得基因类型。

图3 部分cDNA-AFLP特异性引物筛选结果Fig.3 Result of somescreen special cDNA-AFLPprimers
2.3.2 序列比对和功能分析
为了解干旱胁迫下外源ABA对番茄幼苗分子调控机理,在已有112条差异表达基因片段中挑选87条,二次PCR扩增、回收、克隆并测序,最终得到51个有效序列。
对51个有效序列作BLAST比对,序列结果表明22个有效序列与已知功能基因具有高度同源性,18个与未知功能基因及假定基因具有高度同源性,重复序列11个。22个同源基因生物学功能主要包括信号转导、转录调控、逆境响应、细胞代谢与代谢途径相关酶基因。如片段TDF33与番茄转录因子CBF1同源性值为94%,差异片段TDF71又与ABC转运蛋白相似,其比对E值为0.083,参与响应逆境胁迫(见表2)。
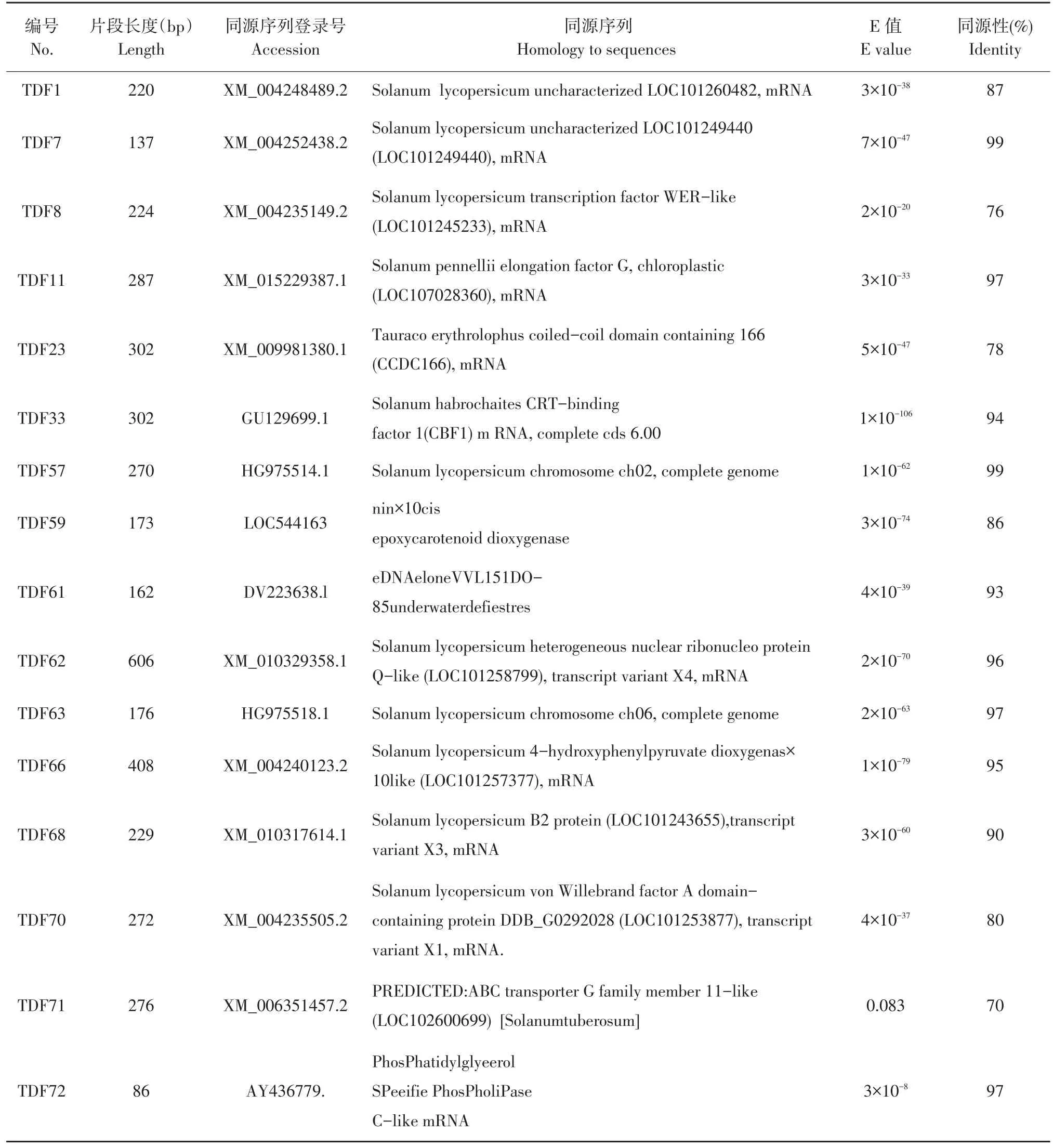
表2 部分差异表达片段序列同源性比对结果Table 2 Homology comparison results of partial differentially expressed fragment(TDF)sequences
2.3.3 四个抗旱相关基因差异表达模式荧光定量PCR分析
为验证cDNA-AFLP结果准确性并进一步探究番茄抗旱差异表达基因片段在不同干旱时间点表达情况,选取4个干旱胁迫下受ABA诱导上调表达的基因片段(TDF23、TDF56、TDF62、TDF72)作荧光定量PCR分析。
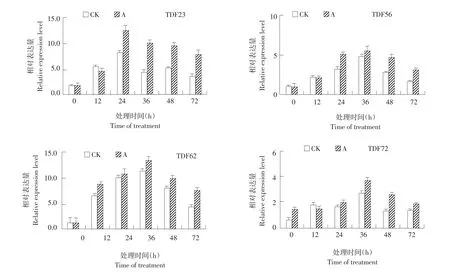
图4 干旱胁迫下ABA预处理番茄幼苗及对照抗旱相关基因相对表达Fig.4 Relative expression of drought-resistant genes in tomato seedlings pretreated with ABA and control under drought stress
由图4可知,4种不同抗旱相关基因随干旱时间增加,基因表达量均较初期明显增加,基本呈先升后降趋势。但表达量上升到最大值时间点不同,TDF23在24 h,而TDF56、TDF62、TDF72在36 h。其次,四个不同基因相同时间点基因表达量为A处理高于CK,仅有TDF23和TDF72在12 h时CK表达量稍高于A处理。
3 讨论
植物经干旱处理后,植株抗旱性越强,叶片抗脱水能力越强,叶片RWC含量越高[16]。干旱胁迫时,RWC含量降低,破坏自由基平衡代谢,产生大量自由基,自由基作用于脂质发生过氧化反应,得到具有毒性的氧化终产物MDA,加剧膜系统损伤[17];质膜渗透性增加,电解质外渗,电导率增强。本研究发现,随干旱胁迫时间延长,叶片RWC含量显著降低,而MDA含量明显增加,相对电导率显著上升,与陈青奇等研究结果一致[18-19]。此外,番茄幼苗叶片在喷施ABA预处理后,相对电导率始终低于对照,与尹松松等研究结果一致[20],相对水含量下降趋势也较对照相对平缓。一定程度上说明外源ABA预处理可减轻膜系统在干旱胁迫下的损伤。
SOD是生物体内关键的抗氧化酶,亦称自由基清除剂,其活性可作为判断植物抗逆性指标,可催化有毒超氧自由基反应生成无毒O2和H2O2,存在于植物体叶绿体、线粒体、内质网中CAT和过氧化物酶体中POD可进一步清除有毒害作用H2O2,生成无害O2,减少自由基对膜的伤害。因此,SOD、CAT、POD活性可衡量植物抗旱能力[21]。本试验中,ABA预处理后,不同程度增加抗氧化酶活性,与郭贵华等[22]和赵宏伟等[19]研究一致,但郭贵华等研究中,3种酶在干旱及ABA处理后始终呈上升趋势。本试验中,后期SOD和CAT酶活性有所下降,可能是不同作物不同生长期导致的差异。
植物抗逆性均是多基因控制的复杂数量性状[23],许多基因在逆境环境下不同程度表达,其产物蛋白或RNA作用于植物细胞,响应干旱等非生物逆境以提高其抗逆性[24]。本研究中,干旱胁迫下部分TDF差异性表达,说明干旱胁迫不同程度影响基因表达,差异表达片段调控植物抗旱性。为明确植物抗旱性分子调控机制,学者鉴定和分析大量干旱胁迫诱导基因,在模式植物如水稻和拟南芥上研究更深入,已鉴定数百个抗旱相关诱导基因[25]。本研究中有22个cDNAs对应的TDF与已鉴定的干旱胁迫相关功能基因具有高度同源性,某种程度上表明不同植物对干旱胁迫耐受性具有相似分子基础。
ABA是启动植物体内抗逆基因表达“第一信使”,可诱导某些抗逆基因表达,调控抗逆代谢反应。在干旱、低温、高盐等逆境中有重要作用且受ABA诱导的基因已被相继克隆,如番茄SINAC41、玉米MAPK等[26-27]。本试验中,四种抗旱相关TDF在干旱胁迫期间,基因表达量均高于初期,说明其对干旱胁迫产生应答反应。尽管4种片段基因表达量均先升后降,但初始CK和A处理中TDF23、TDF56和TDF72表达水平相似,后期差异性较为明显,可能因TDF在后期受ABA诱导更为明显。TDF62的CK和A处理基因表达量趋势相同,但表达量A处理始终高于CK,可能是TDF62片段基因较其他3个TDF受干旱影响更强烈,而ABA对其表达起促进作用。因此推测ABA预处理番茄幼苗对干旱高抗性与抗旱相关基因较高表达紧密相关。为更全面揭示ABA诱导基因表达与逆境胁迫之间联系,其机理尚需深入研究。
4 结 论
ABA预处理可有效缓解干旱胁迫对番茄幼苗生理生化及代谢功能损伤,一定程度减轻干旱对幼苗影响。结合cDNA-AFLP及实时荧光定量验证经ABA预处理的番茄幼苗可促进抗旱基因相关表达并提高其抗旱性。

