miR-222促进家兔骨骼肌卫星细胞增殖
刘卜玮,杨 雪,2,毛旭东,梁小虎,郑天豪,何洪炳,赖松家 *
(1. 四川农业大学畜禽遗传资源发掘与创新利用四川省重点实验室,四川 成都 611130; 2. 成都市农林科学院,四川 成都 611130)
【研究意义】高等动物中,骨骼肌卫星细胞(skeletal muscle satellite cells,SMSCs)附着在肌纤维的底膜上,正常情况下是静止的单核细胞,当肌肉受到损伤后,能通过增殖和分化与原有的肌纤维融合形成新的肌纤维,对肌肉进行修复。SMSCs的增殖和分化受复杂的基因网络多重调控,例如成肌调节因子(MRFs)家族的成肌分化因子D(MyoD)、MyoG、Myf4、Myf5和Myf6;它们和肌细胞增强因子2(MEF2)家族成员共同激活和肌肉特异性的基因转录,其中MyoG对骨骼肌卫星细胞分化的作用尤为突出,是分化的关键调控因子[1-2]。
MicroRNAs(miRNAs)是真核生物中长度18~24 bp的一类短链非编码RNA,通过与靶基因的3端UTR区互补配对结合,不完全靶向可抑制该mRNA发挥作用,完全靶向则会降解该mRNA,从而实现在转录后水平抑制靶基因的表达[3]。【前人研究进展】miRNAs在肌肉的生长发育过程中也起着重要作用,如miR-1,miR-133a和miR-206是横纹肌特异的miRNAs,在成肌细胞增殖分化过程中,miR-1、miR-133a和miR-206表达量升高,miR-1通过靶向组蛋白去乙酰化酶4(HDAC4)从而促进MEF2的表达,而MEF2又可以促进miR-1的表达,形成一个正反馈环,从而促进成肌细胞的分化和抑制成肌细胞的增殖[4]。而miR-133a和miR-206分别通过抑制血清应答因子(SRFs)和成肌抑制素基因(myostatin)的表达促进SMSCs增殖[5-6]。miR-222参与调控多种生物学过程,例如,在小鼠的心脏中过表达miR-222,可以通过激活mTOR信号通路抑制心肌的凋亡,同时抑制P27的表达从而诱导心脏心力衰竭[7];在平滑肌中,miR-222可以通过靶向PTEN/Akt通路中的关键因子抑制血管平滑肌自噬[8];miR-222能通过靶向P21和P27促进气管平滑肌的增殖[9-10]。此外,更多的研究主要集中在miR-222对肿瘤的调节作用,研究表明miR-222能够促进黑色素瘤[11]、宫颈癌[12]、结直肠癌[13]等肿瘤的增殖或转移。有研究表明,在小鼠的成肌细胞系(C2C12细胞系)中,miR-222过表达可以促进成肌细胞的增殖和抑制成肌细胞的分化[14]。然而,目前没有研究报道miR-222是否参与调控家兔骨骼肌卫星细胞的增殖。
我国是养兔大国,也是兔肉出口大国。家兔是一种十分重要的经济动物,它既可以食用,也可以作为工业原料、观赏动物、医用模型等,因此家兔具有很大的研究价值。【本研究切入点】本试验采用刚出生新西兰兔骨骼肌卫星细胞为实验材料,研究miR-222对SMSCs增殖的影响。【拟解决的关键问题】结果表明miR-222过表达促进SMSCs的增殖,miR-222抑制表达抑制SMSCs的增殖。
1 材料与方法
1.1 组织的采集和RNA的提取
所有的实验动物均由四川农业大学科研兔场提供,分别采集6只(公母各3只)84日龄新西兰兔的心、肝、脾、肺、肾、回肠和腿肌(半腱肌)组织样各1 g左右,迅速放入液氮中保存。将样品在液氮中研磨后,用Trizol法(TaKaRa,宝生物)提取出各样本的总RNA备用。
1.2 RNA的抽提与反转录
总RNA和miRNAs的纯度采用OD260nm/OD280nm和OD260nm/OD230nm比值测定,其完整性通过1.5 %琼脂糖凝胶电泳评估。参照反转录试剂盒(Takara,Mir-XTM miRNA First-Strand Synthesis Kit 货号:1604342A和Takara, PrimeScriptTM RT reagent Kit with gDNA Eraer 货号AK4002)进行miRNA和mRNA的反转录,得到各自的cDNA,保存于-20 ℃冰箱。
1.3 实时萤光定量PCR(RT-qPCR)
miR-222的定量用U6(microRNA反转录试剂盒自带)作为处理数据的内参基因,miR-222引物序列5’-agctacatctggctactgggt-3’,每个样本3个重复孔;RT-qPCR定量程序:预变性95 ℃ 30 s;40个循环:95 ℃ 5 s,60 ℃ 25 s,熔解曲线:95 ℃ 10 s,65 ℃ 5 s,95 ℃ 5 s。mRNAs的定量体系:5 μl SYBR green I,0.4 μl上游引物,0.4 μl下游引物3.2 μl的去RNA,1 μl cDNA。本试验所用引物均由成都擎科生物有限公司合成。
1.4 功能富集分析
使用TargetScan(http://www.targetscan.org/vert_71/)、miRBase(http://www.mirbase.org/)和miRWalk(http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/generetsys-self.html)对miR-222进行靶基因预测,选择3个网站的预测交集作为miR-222潜在的靶基因,然后使用DAVID 6.8工具(https://david.ncifcrf.gov/)进行靶基因功能富集分析。
1.5 原代细胞培养
新生1 d的新西兰兔脱颈处死后,取后腿半腱肌放入PBS中,仔细去除肌肉上面筋膜等组织,将肌肉块剪碎后放入0.1 %的胶原蛋白Ⅰ中37 ℃水浴消化2 h,每10 min摇晃混匀1次;离心后用胰蛋白酶消化10 min,用生长培养基(含10 % FBS,1 %双抗的DMEM高糖培养基)(GM)终止消化并用40 μm细胞筛网过滤,将滤液1000 r/min离心5 min,再将细胞重悬接种在培养瓶中。
1.6 miR-222过表达和抑制表达效率检测
miR-222 mimics、miR-222 NC、miR-222 inhibitor和inhibitor NC由上海生工生物工程股份有限公司合成,序列如表1。
表1miR-222mimics、miR-222NC、miR-222inhibitor和inhibitorNC序列信息
Table 1 The sequence information of miR-222 mimics, miR-222 NC, miR-222 inhibitor and inhibitor
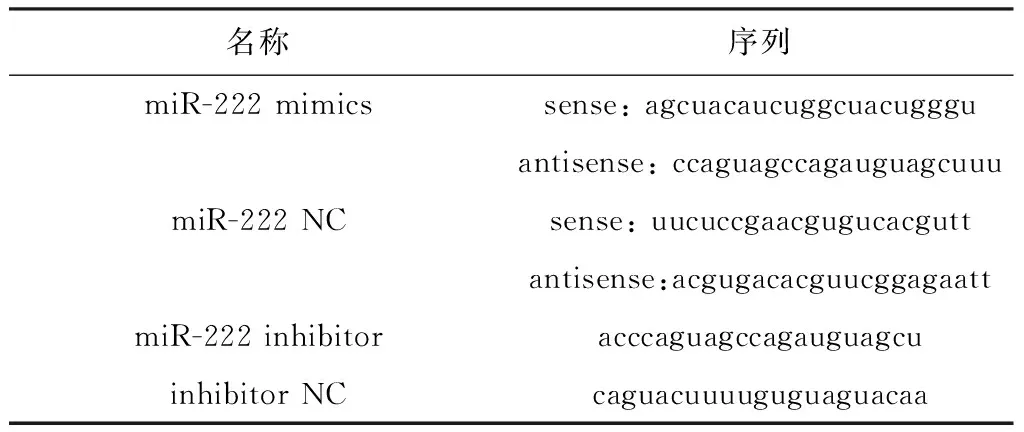
名称序列miR-222 mimicssense: agcuacaucuggcuacuggguantisense: ccaguagccagauguagcuuumiR-222 NCsense: uucuccgaacgugucacguttantisense:acgugacacguucggagaattmiR-222 inhibitoracccaguagccagauguagcuinhibitor NCcaguacuuuuguguaguacaa
将SMSCs培养在6孔板中,当细胞密度达到80 %左右时,根据lipo3000(Thermo,货号:L3000015)说明书将miR-222 mimics(浓度:50 nM)、miR-222 NC(浓度:50 nM)、miR-222 inhibitor(浓度:100 nM)和inhibitor NC(浓度:100 nM)进行转染,每组3个重复孔,24 h后换液,48 h后,提取RNA进行反转录和定量分析miR-222的表达量,确定过表达和抑制表达效率。
1.7 细胞增殖检测
CCK-8增殖检测:将SMSCs按照1×104个/孔的密度接种进96孔板,待细胞密度达到80 %左右,根据lipo3000说明书将miR-222 mimics(浓度:50 nM)、miR-222 NC(浓度:50 nM)、miR-222 inhibitor(浓度:100 nM)和inhibitor NC(浓度:100 nM)进行转染,每组8个重复,24 h后换成100 μl GM培养基,之后每48 h换液;检测转染后第24、48、74、96和120小时的细胞增殖情况,简述如下,每个孔提前2 h加入10 μl CCK-8试剂(同仁,货号ck04)放入37 ℃培养箱中孵育2 h,在450 mm处测定出吸光度,重复3次。
EdU增殖检测:按照CCK-8增殖检测步骤进行转染,转染48 h后进行EdU增殖检测;将培养基换成100 μl 50 μM 浓度的EdU(锐博生物,广州)GM培养基,37 ℃培养箱中孵育2 h,其他操作步骤按照说明书进行。倒置萤光显微镜观察并采集萤光图片,每孔至少采集5组图片。
1.8 数据分析
采用2-ΔΔct分析定量数据,使用imageJ 1.50e软件对细胞进行计数和计算百分比,使用SPSS 22对所有数据进行单因素方差分析,统计结果用平均数±标准差(S.E.M)表示,P<0.05表示组间差异显著,P<0.01表述组间差异极显著。
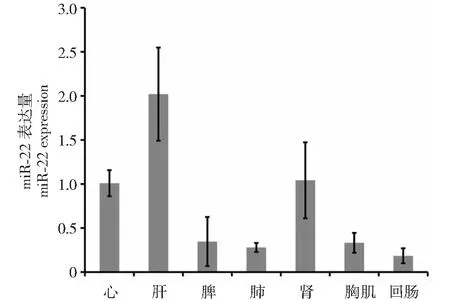
图1 miR-222在新西兰兔各组中表达量Fig.1 The expression of miR-222 in New Zealand rabbit different organizations
2 结果与分析
2.1 miR-222在各组织中的表达谱
对心、肝、脾、肺、肾、腿肌和回肠中miR-222进行了定量检测,发现miR-222在肝脏中的表达量最高,回肠中表达量最低,在腿肌中中度表达。结果如图1。
2.2 靶基因功能富集分析
使用TargetScan、miRBase和miRWalk 3个在线预测软件进行靶基因预测,由于这3个数据库上家兔的基因组不全,选择在分类学上相近的小鼠基因组作为miRNA—mRNAs预测,筛选出了908个靶基因(3个预测结果取交集),使用DAVID 6.8对靶基因进行GO聚类分析和KEGG通路分析。这些靶基因参与转录、转录调控、细胞内信号转导、神经系统发育和调节细胞凋亡和迁移等生物学过程,参与细胞膜、细胞质、神经元投射,细胞核等细胞构成,参与蛋白质结合、金属离子结合、DNA结合、核苷酸结合,转录激活、转录因子激活和激酶激活等分子功能(图2)。此外,miR-222的靶基因富集在以下几个通路,包括癌症通路、PI3K-Akt信号通路、MAPK信号通路、人类嗜T细胞病毒Ⅰ型感染、Ras信号通路、催产素信号通路、趋化因子信号通路和CAMP信号通路(表2),这些数据表明,miR-222在生物体内可能调控多种生物学功能。
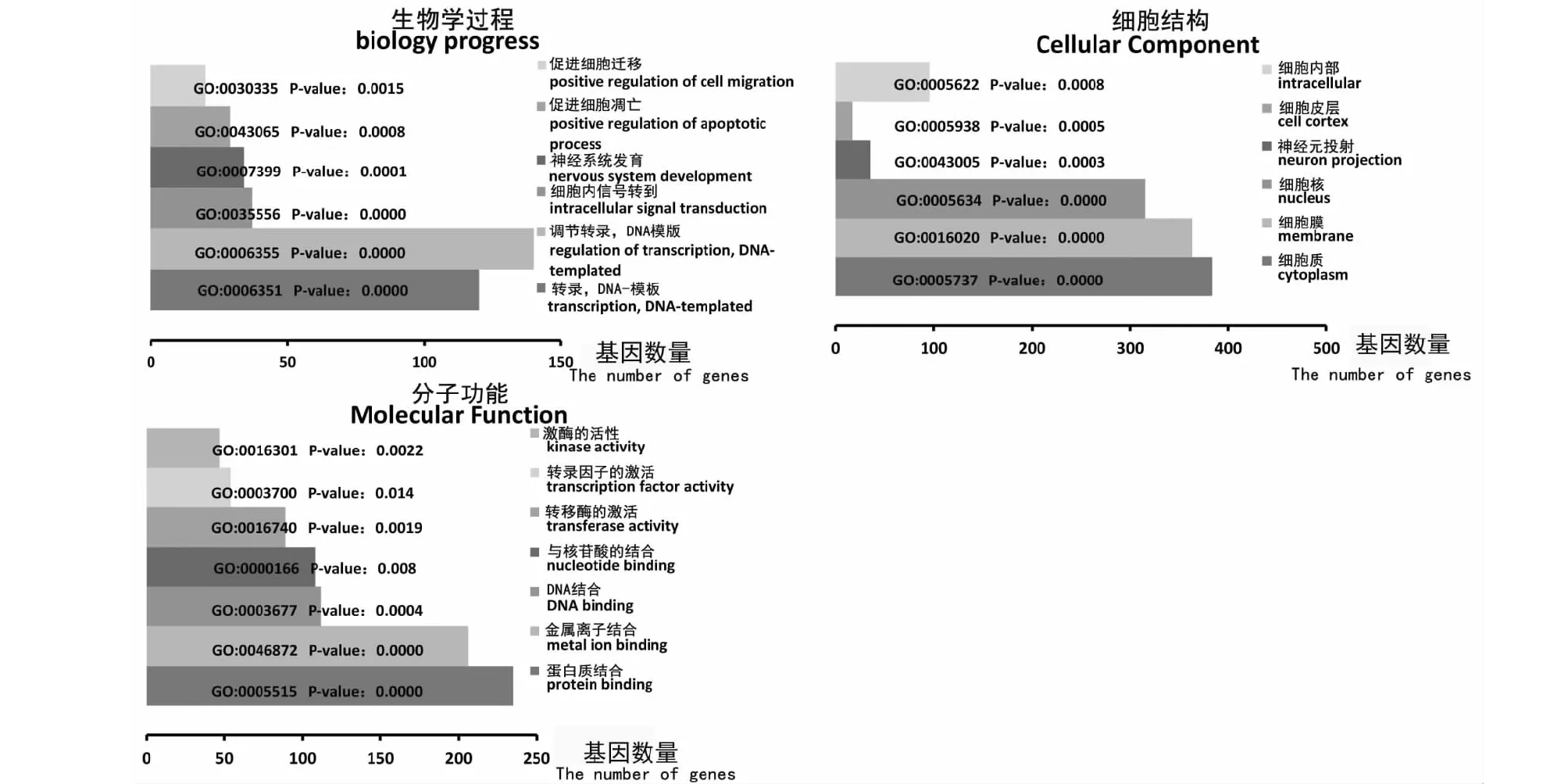
图2 GO分析预测miR-222的生物学功能Fig.2 Analysis of miR-222 biological function by GO terms

通路名称相关基因P-ValuePathways in cancerE2F3, ADCY1, GNAI3, GNAI2, ADCY7, XIAP, LPAR2, GNG12, KIT, CXCL12, FOS, KRAS, CASP9, RASGRP1, GNG2, RUNX1, AXIN2, COL4A3, RET, BRAF, TGFBR1, RUNX1T1, SKP2, RAF1, IGF1, MAPK10, FZD5, STAT1, KITL, MAPK1, CBLB, 4930544G11RIK, MAPK90.0000PI3K-Akt signaling pathwayOSMR, LPAR2, GNG12, KIT, ITGB3, CDC37, KRAS, CASP9, GNG2, PRKAA2, MLST8, GHR, COL4A3, PKN2, YWHAB, IGF1, RAF1, KITL, IRS1, BCL2L11, MAPK1, YWHAG, CC-ND2, CHRM1, TSC2, RELN, PPP2R3C, EIF4E20.0005MAPK signaling pathwayPTPN7, CACNA2D1, NTF3, BRAF, TAOK1, TGFBR1, MAP2K4, PPP3R1, RAF1, MAPK10, CACNB4, GNG12, MAP3K7, FOS, MAPK1, KRAS, PAK2, MAP3K2, RASGRP1, MAPK9, ST-MN1, MAP3K13, NFATC30.0003HTLV-I infectionCRTC3, ADCY1, E2F3, XIAP, ADCY7, CRTC1, TGFBR1, MAP2K4, PPP3R1, NFYB, FZD5, CANX, ATF1, FOS, POLE4, KRAS, CCND2, ETS1, XBP1, ETS2, TRP53INP1, NFATC30.0024Ras signaling pathwayIGF1, RAF1, KIT, GNG12, MAPK10, KITL, RGL1, MAPK1, KRAS, PAK2, GAB2, TIAM1, ETS1, RASGRP1, ETS2, 4930544G11RIK, MAPK9, GNG2, RASA30.0032Oxytocin signaling pathwayADCY1, CACNA2D1, GNAI3, ADCY7, GNAI2, PPP3R1, RAF1, CACNB4, FOS, MAPK1, KRAS, CAMK4, 4930544G11RIK, GUCY1A3, CAMK2B, PRKAA2, NFATC3, CAMK1D0.0097Chemokine signaling pathwayADCY1, GNAI3, BRAF, ADCY7, GNAI2, PREX1, RAF1, GNG12, STAT1, CXCL12, CCL6, MAPK1, KRAS, TIAM1, 4930544G11RIK, CX3CR1, GNG2, WASL0.027cAMP signaling pathwayADCY1, GNAI3, BRAF, ADCY7, GNAI2, RAF1, ATP1A1, GRIA4, MAPK10, FOS, MAPK1, CAMK4, TIAM1, CHRM1, 4930544G11RIK, MAPK9, CAMK2B0.041
2.3 过表达和抑制表达效率
用miR-222、miR-222 mimics、miR-222 inhibitor和inhibitor NC分别转染SMSCs,48 h后,监测miR-222的表达量。过表达miR-222后,miR-222表达量升高了610倍,mimics组极显著高于mimics NC组(图3,P<0.01);抑制表达miR-222后,表达量降低到约55 %,inhibitor组显著低于inhibitor NC组(图3,P<0.05)。结果显示,过表达miR-222和抑制表达miR-222实验成功。
2.4 miR-222促进SMSCs增殖
用CCK8试剂盒检测SMSCs在24、48、72、96和120 h时的增殖情况。发现过表达miR-222后,在72、96和120 h时,mimic组的增殖速度显著高于mimic NC组(图4A,P≤0.05)。同时,miR-222 inhibitor组在72、96和120 h的增殖速度显著低于NC组,如图4B。结果表明,过表达miR-222可以促进家兔骨骼肌卫星细胞增殖,抑制表达miR-222可以抑制家兔骨骼肌卫星细胞增殖。
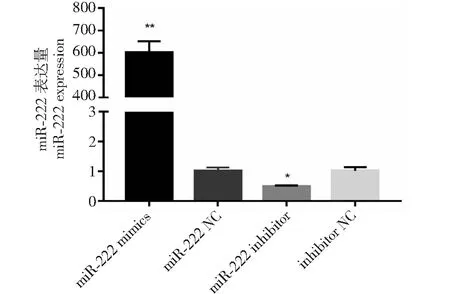
*P≤0.05,**P<0.01,下同*P≤0.05,**P<0.01, the same as below图3 转染效率检测Fig.3 Detection of transfection efficiency
EdU试验结果表明miR-222能促进SMSCs增殖,与miR-222 NC组相比,miR-222 mimics组EdU阳性细胞数量多36.4 %(P=0.008);与inhibitor NC组相比,inhibitor组EdU阳性细胞数量少了19.4 %(P=0.037)。
3 讨 论
本试验先分析了miR-222在新西兰兔各个组织中的表达,发现miR-222在肝脏中表达量最高,在腿肌中中度表达。利用生物信息学预测了miR-222的靶基因,并对靶基因进行GO分析和KEGG pathway分析来推测miR-222的生物学功能,发现靶基因主要富集在转录因子激活、激酶激活、核苷酸结合等分子功能,细胞迁移、发育和凋亡等生物学过程,癌症通路、PI3K-Akt信号通路、MAPK、Ras、cAMP等信号通路,这些通路对肌肉的发育起着重要的调控作用,例如:PI3K-Akt通路可以抑制肌肉特异性的泛素连接酶MuRF1和MAFbx的表达从而抑制肌肉萎缩[15],此外,比如胰岛素样生长因子1(insulin-like growth factor I,IGF-1)必须通过PI3K-Akt的磷酸化才能促进肌卫星细胞增殖[16];而MAPK信号通路可以通过Myf5诱导胚胎早期祖细胞的成肌分化,激活MyoD和MEF2家族中的成肌转录因子促进成肌细胞增殖和分化[17]。而且,miR-222在人类肌营养不良疾病以及MDX肌营养不良鼠模型的肌肉组织中的表达量都会升高[18-19],这些都暗示着miR-222可能对骨骼肌卫星细胞的增殖有调控作用。
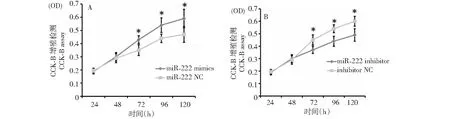
图4 CCK-8实验检测miR-222对SMSCs增殖的影响Fig.4 The effect of miR-222 on the proliferation of SMSCs cells via CCK-8 assay
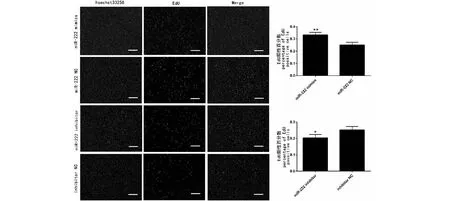
细胞核被hoechst标记成蓝色,增殖的细胞被EdU标记成红色,Merge为两种染色叠加,EdU阳性细胞百分数计算公式为:(EdU阳性细胞数/细胞核数量)×100 %,比例尺为200 μmCell nuclei (blue) and EdU positive cells(red). The ratio of EdU-positive cells was calculated with (EdU-positive cells/Hoechst stained cells)×100 %. The scale bars stand 200 μm图5 EdU试验检测miR-222对SMSCs增殖的影响Fig.5 The effect of miR-222 on the proliferation of SMSCs cells via EdU assay
使用miR-222 mimics、miR-222 inhibotor分别对SMSCs进行miR-222过表达和抑制内源性miR-222表达,CCK-8增殖检测和EdU增殖实验结果均表明,miR-222对SMSCs的增殖有促进作用。miR-222在骨骼肌中的研究较少,Cardinali等[14]研究发现,miR-222可以促进C2C12小鼠成肌细胞的增殖,与本研究结果一致。在外周动脉缺血后,miR-222能够通过超氧化物歧化酶-2(superoxide dismutase‐2,SOD-2)抑制P57的转录后表达,从而促进四肢骨骼肌的再生[20]。在心肌细胞中,miR-222也能促进心肌细胞的增殖,在小鼠心脏内对miR-222的表达进行抑制,发现增殖的标记基因(HIPK1和HMBOX1)表达量降低,心肌细胞和心脏的增殖发育受到阻碍[21]。在平滑肌中,miR-222靶向P27促进哮喘病人气管平滑肌的增殖。P27和P57是细胞周期抑制因子,通过抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDKs)的表达从而抑制G1-S、G2-M之间的转换,引起细胞增殖受到抑制[10],在骨骼肌中,P57和P27也可以同样地抑制细胞的增殖,Chakkalakal等[22]研究发现,P27抑制小鼠骨骼肌的增重,敲出P27的骨骼肌卫星细胞可以促进细胞的增殖以及细胞损伤后的自我更新。Naito等[23]研究发现用RNAi技术抑制P57的表达,导致PAX7的表达量增加,从而促进骨骼肌卫星细胞的增殖。
4 结 论
本研究结果表明,miR-222在新西兰兔各组织中差异表达,在肝脏中表达量最高,回肠中表达量最低,在肌肉中中度表达;用miR-222 mimics和inhibitor模拟miR-222在SMSCs中过表达和抑制表达,结果表明,miR-222对骨骼肌卫星细胞增殖有促进作用。

