基于线性扫频激励的磁声电导率检测系统研究*
戴明,朱慧萍,陈思平△,陈昕,陈冕,孙通
(1. 深圳大学 健康科学中心 生物医学工程学院,广东 深圳 518060;2. 南开大学深圳研究院,广东 深圳 518060)
1 引 言
据2014年世界卫生组织发布的全球癌症报告,未来20年,每年新发癌症将达2200万,同期癌症死亡数将上升到1300万[1];2017年国内347家癌症登记点每天约1万人被确诊患癌,患癌风险高达36%[2],因此,对癌症进行早期诊断具有重要意义。目前癌症诊断主要有X线、CT、超声成像、核磁共振等方法[3],由于X射线与CT为有创检测技术,使用受限;超声成像快,价格低廉,虽被广泛应用于医学成像领域,但对比度差,图像清晰度有限,且成像区域受限,同时只有当患者病灶组织发生形态病变后才能显现,因而难以进行早期诊断;MRI造价昂贵,使用和维护费用高,难以普及[3],因此,迫切需要对组织进行无创、高对比度、高分辨率、成本低、能够早期定量测量的方法和仪器。
目前研究表明,不同生理、病理状态下生物组织具有不同电特性[4],其在肿瘤生长过程中,周边血管丰富,周围电阻率也会发生变化,且生物组织功能性病变早于结构性病变,功能性恢复滞后结构性恢复[5],因此,当发生早期病变,尚未表现于形态结构时,组织内各类化学物质及其空间分布首先发生变化,其宏观上往往表现为病变组织电学特性变化[6]。因此有望通过检测组织电导率变化来检测病变情况,达到对病变组织早期诊断目的[5-7],故电导率成像研究对疾病预防和恢复具有重要意义。
目前,传统电阻抗方法不适用于组织电导率成像;感应式磁声电成像使用线圈激励,存在交变磁场对组织电流影响;电压注入磁声检测方法将电流注入成像体,其弥散性分布降低空间分辨率[6];而磁声电成像结合磁、声、电场优势,克服传统单一物理场限制,兼具超声成像高分辨率和传统电阻抗成像高对比度优点,且对磁体场强及均匀性要求低,故成本低,加之可通过电极检测,后续处理方法相对简单,因此,本研究设计一种低成本磁声电导率检测系统,其利用线性连续波作为激励源,采用激励源与电极检测信号作为输入源来进行电导率计算,其获得电导率不仅准确度较高,且计算复杂度大大降低,成像速度较快,同时提出影响系统稳定性,提高系统信噪比方法,并对均匀仿体进行实验,最后探讨探头类型及扫频时宽对分辨率影响。
2 磁声电导率成像理论推导
1997年,Wen提出霍尔效应成像[8],构建电极电压与组织电导率特性的一维模型,并推导该模型下电极检测电压与电导率关系,由于系统常数及内阻不确定,因此该方法只适用于定性描述;Xu等人提出基于互易定理MAET[9],通过检测表面电极电压求出单位电流注入成像体内电流密度分布,进而求出组织电阻率分布;为进一步提高电导率成像分辨率,刘国强等人提出洛伦兹力电阻抗成像[10],并使磁声电成像在正逆问题求解上获得进一步完善; Bradley 等人在算法重建方面提出基于傅立叶理论重建算法,通过反傅立叶变换来重构电导率[11]。
本研究采用基于线性扫频方法来进行成像,通过信号发生器产生一束扫频时宽可调Chirp信号,并通过功率分配器后,一路送给Verasonics,另一路经功率放大后送给超声探头,其中激励源可表示为:
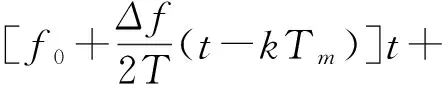
(1)
再通过Verasonics接收到的电压信号可表示为:
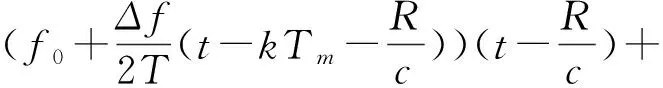
(2)
再分别将上述激励和接收信号分别进行均值处理,带通滤,混频,低通滤波后获得幅值正比于N的中频信息,即:
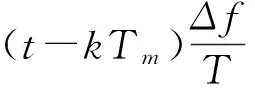
(3)
再经尺度变换获得单点激励时,电导率幅值随深度变化电导率信息。
上式A0,A1,φ0,φ1分别为发射、接收信号幅值、发射、接收初始相位,f0,Δf为起始频率和扫频宽度,T为扫频时宽,R为激励深度,c为超声传播速度,其中0≤t≤T;k=0,1,L,N-1。
3 磁声电导率系统设计
3.1 磁生电导率成像原理
通过探头发射超声来激励成像体,使成像体内局部粒子随超声波传播而振动,由于振动粒子在静磁场作用下受洛伦兹力而产生电荷分离,从而在成像体中形成局部电流源,进而产生电场,通过紧贴在成像体表面电极或非接触线圈即可获得电压信号,进而重构电导率图像[4-5],MAET成像过程见图1。

图1 MAET成像过程
本研究在现有MAET基础上采用线性扫频信号作为激励源,将线性扫频信号经功率放大后,传给超声探头,并经去离子水耦合后注入组织内,组织中局部粒子随超声纵波传播而振动,由于在超声纵波正交方向施加静磁场,导致振动的带电粒子在静磁场作用下因受洛伦兹力而产生正负电荷分离,从而形成局部电流源,进而形成局部电场,通过电极即可测得组织体表面电压,再将激励源与电极检测电压进行混频,经峰值检波等数字滤波处理后即可获得组织在XY平面上某点电导率分布曲线,再结合探头扫描位置信息,即可重建组织电导率分布图,其成像过程见图2。

图2 基于线性调频MAET成像过程
Fig2ImagingprocessofMAETusinglinearsweepmethod

图3 系统实物连图
3.2 系统平台设计
本系统由激励源,运动控制平台,Verasonics采集平台三部分组成。其中激励源包括信号发生器,功率分配器和功率放大器。运动控制平台由XYZ自由运动云平台,水浸功率探头,C形静磁体,嵌入磁体中检测水槽及镀银铜电极等组成,其中Verasonics平台被用来对电压信号及激励源分别进行14位ADC采集、前置放大、带通滤波、点乘、低通等处理及系统时序控制。其连接见图3,通过信号发生器产生带宽1 MHz,中心频率2.5 MHz线性调频激励源,经功率分配器后,一路经53dB RF Power Amplifier A150功率放大器和阻抗匹配器后送给超声探头,另一路经双层屏蔽线,阻抗匹配器后送Verasonics,同时将电极紧贴成像体两侧,并与Verasonics连接,再将成像体置于塑料水槽中固定,随后将水槽置于静磁体中,并将探头固定控制系统支架上,随后往水槽加入去离子水,待云平台校准后,经Verasonics给控制平台发送定位信号来控制探头移动,待探头运动到目标位置,Verasonics随即发出触发信号来开启信号发生器产生一束线性调频波来激励超声探头,同时Verasonics对电极电压进行检测,最后经对超声激励信号和电极检测信号进行相关成像算法处理即可获得设置定位点在超声激励路径上的电导率曲线,移动探头1 mm到下一位置进行扫描,并重复上述操作则可获得XY平面上各定位点对应电导率曲线,最终结合各定位点信息来获得仿体在整个平面区域内电导率分布图,其线性扫频激励MAET连接见图3。
本系统以MATLAB为编程语言,通过镀银铜电极来检测电压信号,并经Verasonics对激励源及电极电压分别进行阻抗匹配、ADC采集、前置放大、均值和带通滤波,随后点乘和低通滤波,再经FFT变换获得中频信号,并经尺度转换和峰值检波获得仿体在XY平面单点激励电导率曲线,再结合探头位置,激励源和电极电压,经维度变换及图像重建即可获得样本电导率分布图[7,12],其算法流程见图4。

图4 成像算法流程图
3.3 系统激励源设计
本研究采用功率探头激励仿体使离子局部振动,故需探头功率较大,考虑超声激励源及本系统特点,带宽较宽,中心频率1~3 MHz[5],扫频时宽可调超声激励源可满足实验需求,因此选择IMASONIC CDC10963作为振动激励探头,选择幅值180 mv、频率2~3 MHz、1 000 μs线性扫频连续波作为激励源。
为克服激励信号和接收信号在时延、幅值、频率、扫频时宽及起终频率不同而导致信噪比和测量精度不高,输出不同步,本研究将功率放大器输入激励及接收信号合并为同路信号;由于功率放大器需散热,其风扇转动引起振动,因此本研究将功率放大器放置于地面,并通过双层屏蔽线和屏蔽网来提高系统信噪比;由于两磁体间磁场均匀度不同,因而将成像体放在两磁体内中心区域;为不影响探头自由运动及减小空气间隙和气泡对超声激励仿体产生影响,本研究采用去离子水作为耦合剂。
3.4 仿体制作
将烧杯1中放入甲苯酸,并放入丙醇搅拌,然后放入丙三醇和水,最后放入猪皮粉,并搅拌均匀,并将烧杯2中放入丙三醇、丙醇、琼脂及水搅拌均匀。将两烧杯溶液混合,并放入NaCl搅拌均匀后倒入模具,最后冷却成形。通过上述方法制作的含0.5%NaCl均匀仿体见图5。

图5 0.5%NaCl均匀仿体实物图
4 实验结果及结论
为验证本系统成像理论正确性,通过Verasonics对激励信号及经功率分配后另一延时2 μs线性扫频信号分别进行阻抗匹配,ADC采集,均值滤波,带通滤波,混频低通滤波,FFT变换,尺度转换后所测得中频频率为If=2.035×104Hz,深度R=0.313 cm。
若取c=1540 m/s,τ=2 us,T=100 us,并进行尺度变换后可得:If=2.0×104Hz,R=0.308 cm,其理论计算值与实测If和R一致,证明线性扫频激励洛伦兹力电导率成像应用于本系统的正确性。
为测试系统准确性和稳定性,本研究制成与生物组织电导率相近含0.5% NaCl,厚度3.50 cm均匀仿体,并将其固定在探头前4.25 cm位置,且仿体底面与塑料外壳间存在0.20 cm空隙,其超声B模式扫描见图6,通过三不同时宽扫频信号对该仿体分别进行实验,所得电导率曲线见图7,从图7得出三不同时宽信号均可获得仿体上下底面与去离子水间电导率变化界面,而1 000 μs扫频信号所获得电导率幅值最大,信噪比最好,清晰获得去离子水与容器底部电导率界面,且测得界面位置跟B模式扫描图及实际仿体厚度,仿体底部到容器底部一致,且三扫频时宽均能得到相同结论,说明本成像方法可应用于均匀仿体电导率变化区域检测中,此外,从图7可看出,500 μs扫描时间还无法清晰获得去离子水与容器底部电导率差异,而1 000 μs、1 500 μs扫频激励能清晰区分,表明线性扫频时宽是影响分辨率的一个参数。

图6 均匀仿体超声B模式扫描图
为测试聚焦探头影响,本研究采用CDC10963-4对同一均匀仿体进行实验,结果表明:聚焦点深度跟仿体中心点位置有关,当聚焦点越靠近均匀仿体上表面时,越能清晰获得仿体上表面电导率异常界面,而仿体下底面界面不明显,当聚焦点靠近均匀仿体下表面时,在仿体下表面能获得清晰电导率变化界面,即探头在聚焦点所测得信号最强,偏离聚焦点所测得信号则越来越弱,所测结果与聚焦理论一致。
此外,本研究使用500 μs时宽扫频信号激励均匀仿体,并进行1 mm步长B模式扫描后获得仿体电导率分布见图8,从图8获得仿体上下电导率变化界面位置跟超声B模式界面及直尺实测值一致,证明本系统的准确性,并对0.3%,0.5%,0.7%NaCl浓度均匀仿体进行实验,均能获得相同结论。虽然上述结果表明本系统能被应用于电导率变化区域检测,但仍有诸多改进之处,如细分扫频时宽,增大磁体空间,提高磁场均匀度,完善平台结构。由于仿体中含有NaCl,因而导致仿体内与电导率有关NaCl在水中逐渐稀释,从而导致应用于实验的仿体有效时间受限。此外,本系统只对仿体进行B扫实验,而对电导率成像算法进行优化和改进将作为接下来研究重点。
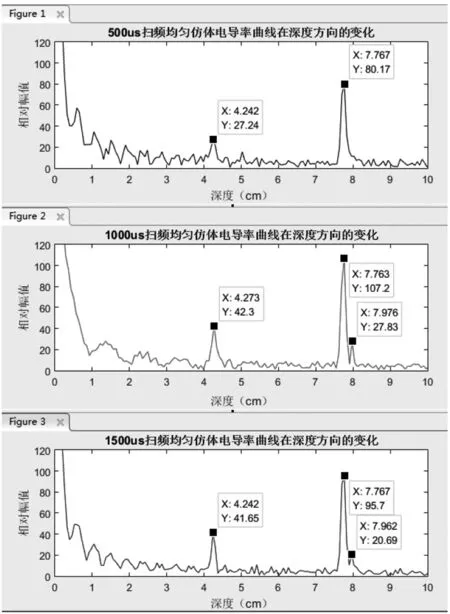
图7 不同扫频时间激励均匀仿体所得电导率曲线图
Fig7Conductivitycurvesusingthreelinearsweepsignals

图8 500 μs扫频B模式电导率图
Fig8ConductivityB-modeimagingusing500μschirpsignal
5 结束语
本研究不仅能定量对组织电导率进行检测,且克服了基于互易定理的MAET局限性,其采用线性连续波作为激励源所获得仿体电导率不仅准确度较高,且计算复杂度大大降低,同时提出影响系统稳定性,提高系统信噪比的方法,并通过本系统对仿体进行实验,获得清晰电导率曲线,并证明线性扫频时宽是影响磁声电导率成像分辨率的一个参数。由于磁声电成像还处于起步阶段[7],因此仍需进一步创新和完善,达到临床检测还需很长过程,但其在癌症早期诊断,软组织疾病检测方面具有重要意义。

