神经营养因子-3联合全反式维甲酸与β-巯基乙醇诱导大鼠骨髓间充质干细胞分化效果比较
张杰,秦华丽,蒋明
(1.温州医科大学附属第一医院 耳鼻咽喉头颈外科,浙江 温州 325015;2.长沙市妇幼保健院 耳鼻咽喉头颈外科,湖南 长沙 410007;3.中南大学湘雅三医院 耳鼻咽喉头颈外科,湖南 长沙 410013)
近年来骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)治疗神经退行性病变日益受到学者重视。BMSCs具有高度自我复制能力和多向分化潜能,且在适宜条件下能向神经元样细胞分化[1]。目前最常见的诱导剂为神经营养因子与化学制剂。本研究比较碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)预诱导后,再用神经营养因子-3(neurotrophin-3,NT-3)联合全反式维甲酸(retinoic acid,RA)与β-巯基乙醇(beta-mercaptoethanol,β-BME)进行分步诱导的方法来体外诱导BMSCs向神经元样细胞分化的效果差异。
1 材料和方法
1.1 材料 澳洲胎牛血清、0.25%胰酶-0.02%EDTA、青链霉素购自美国Gibco公司;PE anti-rat CD29、CD90、CD45、IgG1购自美国BioLegend公司;β-BME、bFGF、RA、NT-3购自美国PeProtech公司;Cy3标记山羊抗兔IgG(H+L)购自上海碧云天公司;L-DMEM培养基购自美国Hyclone公司;大鼠抗山羊神经元特异性烯醇化酶(neuron-specific endase,NSE)购自武汉博士德公司;4~6周龄,40~60 g雄性SD大鼠购自中南大学湘雅三医院动物实验中心,动物许可证号为SYXK(湘)2014-0013。
1.2 方法
1.2.1 分离培养大鼠BMSCs:用腹腔注射水合氯醛麻醉后,无菌条件下取大鼠股骨和胫骨,用2 mL注射器抽取含10%胎牛血清的DMEM培养基反复冲洗骨髓,离心去上清,以1×105个/mL的细胞密度接种于25 cm2细胞透气培养瓶内,置于饱和CO2,湿度5%,37 ℃恒温培养箱内培养。按照8 h首次换液,后3 d换液1次的方法,待细胞长满后传代。每日在倒置显微镜下观察细胞形态变化。
1.2.2 BMSCs表面标记分子的鉴定:待P3代BMSCs长满瓶底90%以上时,胰酶消化后移入15 mL离心管内,1 000 r/min,离心5 min,PBS重悬细胞,重复3次,调节细胞密度到1×106个/mL,分别加入抗体试剂PE-CD29、PE-CD90、PE-CD45各3管,及1管PEIgG1,置冰上避光孵育30 min。4 ℃,2 000 r/min,离心5 min,弃上清,PBS重悬,重复3次,洗净未结合的抗体。每管加入200 μL PBS重悬细胞,流式细胞仪检测,重复3次,CELLQUEST软件分析结果。
1.2.3 体外诱导BMSCs向神经元样细胞分化:取P3代BMSCs胰酶消化后,按8×103个/mL的密度接种于预先放有消毒盖玻片的6孔板内制备细胞爬片,加完全培养液2 mL,待细胞60%~70%融合。用预诱导液2 mL(98% L-DMEM+2% FBS+10 ng/mL bFGF[2])诱导24 h后,随机分为A组(NT-3+RA,换用98% LDMEM+2% FBS+20 ng/mL NT-3+0.5 μmol/L RA[3])和B组(β-BME,换用98% L-DMEM+2% FBS+1 mmol/L β-BME[3]),2组各用2 mL诱导剂诱导1 h、5 h、24 h、7 d、14 d、21 d后于倒置相差显微镜下观察细胞形态变化。
1.2.4 细胞免疫荧光鉴定:取细胞爬片用PBS洗3次,5 min/次,再用4%多聚甲醛固定15 min,PBS洗3次,5 min/次,再用0.5% Triton-X100浸泡打孔15 min,PBS洗2次,5 min/次,后用封闭液封闭,4 ℃冰箱过夜。加已用封闭液稀释的一抗200 μL,37 ℃避光孵育3 h。用含0.1% Triton-X100的PBS漂洗4次,5 min/次。加入已用PBS稀释的二抗200 μL,37 ℃避光孵育1 h。用含0.1% Triton-X100的PBS漂洗4次,5 min/次。用ddH2O按1∶2 000稀释的DAPI,避光染色5 min;PBS漂洗4次,5 min/次,甘油封片,在倒置荧光显微镜下观察并拍照。随机选择10个非重叠视野,分别计算诱导后1 h、5 h、24 h、7 d、14 d、21 d的NSE阳性率(NSE染色阳性率=阳性细胞数/总细胞数)。
1.3 统计学处理方法 采用SPSS13.0软件进行统计学分析。正态分布计量资料用表示,同组内不同时间点比较用单因素重复测量方差分析,相同时间点2组间比较用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs原代培养和传代培养结果 刚接种的BMSCs呈圆形,大部分悬浮在培养液中。各个时间段的BMSCs形态见图1。
2.2 BMSCs表面标志物鉴定结果 由流式细胞仪检测,CD45 PE阳性率分别为8.34%、6.95%、6.94%,平均7.41%;CD90 PE阳性率分别为99.98%、99.98%、99.98%,平均99.98%;CD29 PE阳性率分别为98.21%、98.32%、97.20%,平均97.91%;故CD29 PE、CD90 PE为阳性表达,CD45 PE为阴性表达。见图2。

图1 BMSCs原代培养和传代培养结果(×100)

图2 BMSCs表面标志物流式鉴定结果
2.3 BMSCs诱导后细胞形态学变化 A组加NT-3+RA诱导1 h,少数胞体有轴突样改变,见图3A;诱导5 h细胞漩涡样生长,部分胞体轴突明显延伸,较前增多,并出现少许多角形细胞,见图3B;诱导24 h细胞数量增多,出现少许胞体变圆的细胞,见图3C;诱导至7 d大多数细胞胞体变圆,可有双触角或多触角细胞,可呈多角形,内可见2~3个核仁。胞间漩涡状趋势逐渐消失,部分细胞间相互连接交织成桥梁状,见图3D;诱导至14 d细胞突起较前明显延长,并出现一、二级分支,形成双级或多极的突起,突起间互相连接,呈网络状,见图3E;诱导21 d,仍可见少许存活的神经元样细胞,其连接的突起变细,细胞桥梁趋向断离,其中部分细胞出现颗粒及空泡,呈死亡趋势,见图3F。B组加β-BME诱导1 h,部分胞体呈短棒形或圆形,见图4A;5 h时见胞体可呈双触角或多触角样改变,有些亦见双核仁,部分细胞胞质中出现颗粒和空泡,见图4B;24 h时见悬浮的细胞碎片增多,大部分细胞胞体破裂,趋向老化死亡,见图4C。
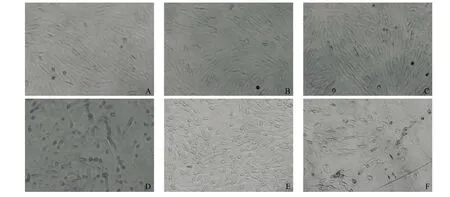
图3 BMSCs经NT-3+RA诱导后各时间点细胞形态学变化(×100)
2.4 2组BMSCs的NSE表达情况比较 免疫荧光结果示,A组诱导分化24 h和B组诱导分化5 h后NSE均阳性表达,见图5。

图4 BMSCs经β-BME诱导后细胞学形态变化(×100)

图5 2组NSE免疫荧光鉴定结果(×200)
B组在诱导24 h后大部分细胞死亡。经统计学分析,A组诱导分化7 d后达到高峰,NSE表达率为(81.92±5.02)%,与其他时间点比较差异有统计学意义(P<0.01)。B组诱导5 h后NSE表达最高,与1 h比较差异有统计学意义(P<0.01)。在1 h和5 h B组NSE表达率高于A组,差异有统计学意义(P<0.01)。见表1。
3 讨论
BMSCs起源于中胚层组织,是一种具有多分化潜能的非造血干细胞,在一定条件下可以被诱导分化为外胚层起源的神经元样细胞。已有研究发现BMSCs分化的神经元样细胞能修复受损的神经[4],并且移植后能为自身修复提供支架[5],因此BMSCs可以作为治疗神经退行性疾病的理想种子细胞。
随着研究的不断深入,研究者发现了很多种BMSCs向神经元样细胞分化的诱导剂,主要有:RA、抗氧化剂(β-BME[3]、褪黑素、丁羟茴醚、二甲亚砜等)、神经营养因子及生长因子[3](NT-3和bFGF)、中药[6]等。但其诱导机制仍然不明确。其中,RA能催化胚胎干细胞定向诱导分化为神经元,能调控细胞的生长增殖及分化,有很强的诱导剂功能[7],能和生长因子联合,增加神经细胞的合成[8]。β-BME为强抗氧化剂,可以通过提高胞内cAMP水平[9],进一步诱导BMSCs转变成神经细胞样形态。bFGF是一种具有多种功能的多肽生长因子,可以促使BMSCs向神经元样细胞分化[1],参与分化启动,细胞的生长、发育和组织损伤的修复[10],可能与wnt信号通路相关[11]。而NT-3作为神经营养素家族中的一员,在诱导BMSCs向神经元样细胞转化过程中非常重要[12]。
为了寻找BMSCs的最佳诱导方案,获得更佳的诱导结果,研究者采用了各种研究方案去提高诱导率,但是不同的诱导剂,其转化效率大为不同,如:FGF-RA方案[13]阳性分化率约为40%,而BME-RA方案[14]的分化率约为20%。而且不同研究者可能因操作手法的差别,即使采用相同的方法也可能得出不同的诱导率[15]。此外,DEZAWA等[16]的研究表明联合诱导分化高于单独诱导分化,HERMANN等[17]的研究结果则证实分步诱导优于单一步骤诱导,且能够获得较高的分化效率。
表1 BMSCs诱导分化成神经元样细胞NSE阳性表达率(,%)
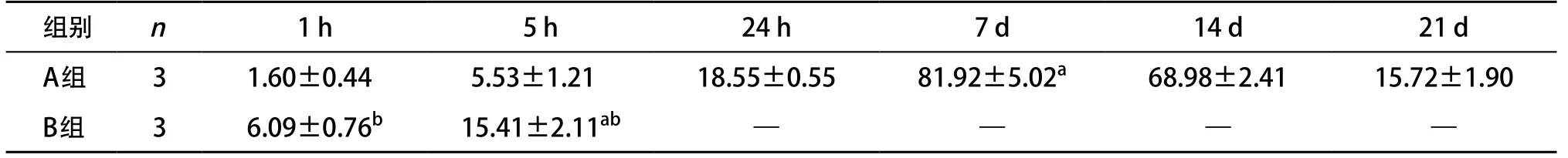
表1 BMSCs诱导分化成神经元样细胞NSE阳性表达率(,%)
与同组内其他时间点比:aP<0.01;与A组同时间点比:bP<0.01
组别 n 1 h 5 h 24 h 7 d 14 d 21 d A组 3 1.60±0.44 5.53±1.21 18.55±0.55 81.92±5.02a 68.98±2.41 15.72±1.90 B组 3 6.09±0.76b 15.41±2.11ab — — — —
刘谦虚[18]的研究认为RA诱导稳定表达脑源性神经营养因子的BMSCs表达NSE阳性率高于单独的RA诱导,且单用RA与不加诱导剂的空白对照组无明显变化,故本研究采取分步诱导+联合诱导,bFGF预诱导24 h后,再换用NT-3+RA及β-BME诱导,探索相对较好的诱导方案。结果发现2组均能诱导BMSCs向神经元样细胞分化,但是NT-3+RA组细胞存活时间较β-BME组显著延长,故后期诱导分化率较β-BME组高,但β-BME组短期诱导分化率较高。这些结果与前人研究基本一致。有学者认为[19]化学药物可导致BMSCs的肌动蛋白网络断裂,并引起细胞质回缩,可有似神经元细胞样伸出轴突的假象,这也可能是β-BME诱导后细胞生存时间短的原因。而NT-3+RA组细胞存活时间长,而且后期分化率高,可能与NT-3的神经营养作用有关。故NT-3+RA方案较β-BME方案更佳。但考虑到诱导剂还存在可能的致畸性[3],而且移植的细胞在中枢神经系统存活时间较短暂[15],故诱导的BMSCs能否通过移植来治疗神经退化性疾病仍需进一步实验来证实。

