静脉糖负荷联合胰岛素法调控血糖在猪18F-FDG PET/CT心肌显像中的应用
李 婷,李剑明,卢如明
(泰达国际心血管病医院核医学科,天津 300457)
18F-FDG PET/CT心肌代谢显像是目前公认的评价存活心肌的“金标准”[1-2],其联合灌注显像评价存活心肌对指导再血管化治疗及预后判断具有重要意义[3-6]。血糖浓度和胰岛素水平是保证18F-FDG心肌显像成功和图像质量的关键,而在动物实验18F-FDG心肌显像中调节血糖的方法尚缺乏统一、成熟的方案。本研究建立小型猪心肌梗死模型,采用静脉糖负荷联合胰岛素法,探讨实验猪18F-FDG PET/CT显像中血糖调控方法,分析血糖调整中影响图像质量的关键因素,为相关动物实验研究提供借鉴。
1 材料与方法
1.1实验动物 实验用广西巴马小型猪30头(天津市百农实验动物繁育科技有限公司提供),实验动物许可证号SCXK(津)2015-0002,均为雄性,体质量20~25 kg,平均(22.50±2.32)kg。
1.2建立急性心肌梗死模型 经实验猪耳后颈部肌肉注射陆眠宁(8 mg/kg体质量)诱导麻醉动物后,开胸暴露心脏前壁及侧壁的冠状动脉,分离左前降支(left anterior descending branch, LAD)近中段,选择第一对角支开口部位以远0.5~1.0 cm处结扎LAD。手术结束后于安静避光处等待实验动物复苏,待其生命体征平稳后送回至饲养中心。于术后2 h对实验动物行脐带间充质干细胞治疗。
1.3仪器与方法
1.3.1仪器及显像剂 心肌灌注显像采用GE Millennium VG-5 SPECT显影仪,显像剂采用99Tcm-MIBI(放化纯度>95%,由北京原子高科股份有限公司提供);心肌代谢显像采用GE NM690 PET/CT扫描仪,显像剂采用18F-FDG(放化纯度>95%,由本科室回旋加速器及Tracerlab生产);血糖测定采用罗氏自动血糖仪及配套血糖试纸。
1.3.2显像过程 为评价造模后干细胞治疗效果,于治疗后第1、4周分别行一日法SPECT心肌灌注和PET/CT心肌代谢显像。显像当日实验猪停饲、停饮,以耳后颈部肌肉注射陆眠宁行诱导麻醉,建立静脉通道,以丙泊酚(5~8 ml/h)维持麻醉。局部消毒后,以无菌注射器针头扎猪鼻取血后测定血糖浓度(基础血糖值),根据血糖浓度予不同剂量25%葡萄糖溶液静脉推注(表1)。随后经静脉推注99Tcm-MIBI 370~555 MBq,15 min后再测血糖(二次血糖值),据血糖浓度静脉推注普通胰岛素注射液(剂型10 ml,400 IU,表2),随即行SPECT显像,采集时间10 min,结束后10 min(即胰岛素注射后约20 min),第3次测量血糖(末次血糖值),直至血糖达7.9~8.8 mmol/L时,经静脉注射18F-FDG 74~92.5 MBq(3.7MBq/kg体质量),40 min后行PET/CT显像,采用门控采集方案,三维采集,每个R-R间期采集8帧图像,每个床位采集10 min,共采集1个床位。

表1 静脉注射葡萄糖方案

表2 静脉注射胰岛素方案
注:当注射胰岛素后末次血糖值下降不明显时,可追加注射0.5~1.0 IU胰岛素
1.4图像处理及质量评价 采用Xeleris 3工作站重建PET/CT图像,获得左心室短轴、垂直长轴和水平长轴断层图像。由2名具有8年经验的核医学医师对图像质量进行评估,意见不同时经协商达成一致。评分标准[7]:0分,心肌不摄取FDG;1分,心肌少量摄取FDG,不能做出或严重影响诊断;2分,心肌基本摄取FDG,基本不影响诊断;3分,心肌完全摄取FDG,图像完整清晰。将图像分为优、良、差共3组:0分和1分为图像质量差,2分为图像质量良,3分为图像质量优。
记录基础血糖值、二次血糖值及末次血糖值,计算血糖升高百分比[血糖升高百分比=(二次血糖值-基础血糖值)/基础血糖值×100%]和血糖下降百分比[血糖下降百分比=(二次血糖值-末次血糖值)/二次血糖值×100%]。采用Viability Cedars QPS软件评价心肌存活情况,采用17节段心肌分布图,获得灌注代谢匹配性减低的心肌节段数,为无存活心肌节段[8],计算存活心肌百分比[存活心肌百分比=(1-无存活心肌节段数/17)×100%]。采用Viability Cedars QGS软件计算左心室射血分数(left ventricular ejected function, LVEF)。
1.5统计学分析 采用SPSS 19.0统计分析软件。计量资料用±s表示,以单因素方差分析比较图像质量优、良、差3组间各项参数的差异,两两比较采用LSD-t检验。以图像质量好(图像质量评分为2分或3分)和图像质量差(图像质量评分为0分或1分)为因变量,以基础血糖值、血糖升高百分比、二次血糖值、血糖下降百分比、末次血糖值、存活心肌百分比、LVEF为协变量,采用多因素Logistic回归分析获得影响图像质量的因素。P<0.05为差异有统计学意义。
2 结果
30头实验猪中,2头造模后因心室颤动而死亡,2头因首次心肌灌注显像示心肌梗死面积过小而被剔除,最终26头实验猪入组,完成PET/CT显像52头次,其中图像质量优者24头次(图1),良19头次,差9头次(图2)。
图像质量优、良、差3组间基础血糖值、血糖升高百分比、二次血糖值、血糖下降百分比及末次血糖值总体差异均有统计学意义(P均<0.05),存活心肌百分比及LVEF差异均无统计学意义(P均>0.05),见表3。3组间两两比较,血糖下降百分比和末次血糖值任意2组间差异均有统计学意义(P均<0.05)。图像良组与差组、优组与差组间基础血糖值和二次血糖值差异均有统计学意义(P均<0.05),而图像优组与良组间差异无统计学意义(P均>0.05)。图像优组与差组间血糖升高百分比差异有统计学意义(P<0.05),而图像优组与良组、良组与差组间差异无统计学意义(P均>0.05)。
二元多因素Logistic同归分析结果表明,基础血糖值、血糖升高百分比、血糖下降百分比及末次血糖值是图像质量的独立影响因素(P均<0.05,表4)。
表3 图像质量优、良、差组实验猪血糖参数比较(±s)

表3 图像质量优、良、差组实验猪血糖参数比较(±s)
组别基础血糖值(mmol/L)血糖升高百分比(%)二次血糖值(mmol/L)血糖下降百分比(%)末次血糖值(mmol/L)存活心肌百分比(%)LVEF(%)优组(n=24)5.13±1.871.53±0.9911.73±1.73 0.47±0.12 6.23±1.79 89.55±2.8764.24±9.92良组(n=19)5.76±2.081.10±0.3911.78±2.360.39±0.10∗7.46±1.67∗89.00±1.6366.21±7.91差组(n=9)7.89±2.41∗#0.82±0.41∗13.69±2.67∗#0.31±0.13∗#8.96±1.45∗#90.36±1.6068.79±9.35F值8.5464.6954.3788.67812.5071.2831.048P值0.0010.0130.017<0.001<0.0010.2850.357
注:*:与优组比较,P<0.05;#:与良组比较,P<0.05
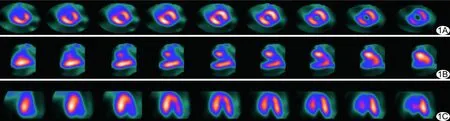
图1 实验猪PET/CT心肌代谢图,心肌完全摄取18F-FDG,心肌外放射性本底较低,心肌显影好,梗死区显示清晰,图像质量评分为3分 A.短轴位; B.垂直长轴位; C.水平长轴位

图2 实验猪PET/CT心肌代谢图,心肌不均摄取18F-FDG,心腔及周围本底影较高,图像质量评分为1分 A.短轴位; B.垂直长轴位; C.水平长轴位
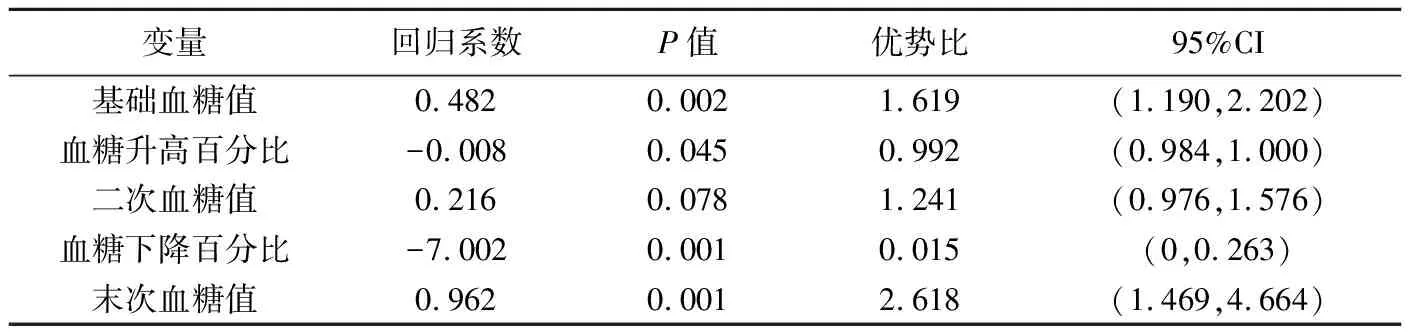
变量回归系数P值优势比95%CI基础血糖值0.4820.0021.619(1.190,2.202)血糖升高百分比-0.0080.0450.992(0.984,1.000)二次血糖值0.2160.0781.241(0.976,1.576)血糖下降百分比-7.0020.0010.015(0,0.263)末次血糖值0.9620.0012.618(1.469,4.664)
3 讨论
葡萄糖是存活心肌能量代谢的主要底物之一,18F-FDG是葡萄糖类似物。受试者空腹时,18F-FDG心肌显像图像质量差,难以诊断存活心肌[9-10]。在糖负荷下,胰岛素分泌增多,血浆脂肪酸水平下降,在胰岛素介导下心肌细胞以葡萄糖作为主要能量来源[11]。因此,18F-FDG心肌代谢显像质量依赖于糖负荷和体内胰岛素水平[12-13]。
目前临床多应用口服葡萄糖负荷联合使用胰岛素调节血糖[3,14],耗时较长,口服葡萄糖一般1 h才能达到血糖峰值,再联合心肌灌注显像时,常需2天才能完成,而在动物实验中尚无调节血糖的统一方法,一般参照人体方案。本实验研究采用静脉注射葡萄糖,达血糖高峰时间明显缩短;不同图像质量组别间基础血糖值、血糖升高百分比、二次血糖值、血糖下降百分比及末次血糖值差异均有统计学意义,而存活心肌百分比及LVEF无明显差异;进一步行Logistic多因素回归分析显示,基础血糖值、血糖升高百分比、血糖下降百分比及末次血糖值是图像质量的独立影响因素。
血糖下降百分比反映血糖下降的幅度,糖负荷联合胰岛素干预后的快速、大幅度的血糖下降阶段应是注射18F-FDG的最佳时机。静脉注射胰岛素后10~30 min作用达高峰,此时体内胰岛素作为调节激素对心肌摄取葡萄糖的促进作用最大[15],同时降血糖的作用最强,体内血糖与18F-FDG的竞争力最弱,于此时注射可提高心肌摄取18F-FDG程度,从而获得较好的图像质量,目前多认为末次血糖达7.9~8.8 mmol/L时为注射18F-FDG的最佳时机[9-10,16],而末次血糖过高必然降低心肌对18F-FDG摄取的竞争力,从而影响图像质量。本研究中图像质量优组动物末次血糖值为(6.23±1.79)mmol/L,低于上述临床推荐值,但仍获得了较佳图像质量,提示实际应用中或不能固化末次血糖值,可能是基础血糖及自身胰岛细胞功能均存在个体差异,也可能与动物血糖水平不完全等同于人体有关。
动物实验过程中,胰岛素高峰时间不易准确识别,因此应尽量增大血糖下降幅度,并在下降幅度最大时注射18F-FDG,可明显提高显像成功率。笔者体会如下:①根据血糖浓度,尽量给予充足的胰岛素剂量;②适当延后测量末次血糖时间,至少30 min;③当末次血糖值与前次血糖值相比下降不明显时,可暂缓注射18F-FDG,等待约10 min再次测量,直至血糖下降幅度明显增大时再行注射,必要时追加少量胰岛素;④推荐以血糖下降百分比(0.47±0.12)%或末次血糖值(6.23±1.79)mmol/L作为参考值,用于指导相关动物实验的注射时机。
本研究的局限性在于实验动物的基础糖代谢状况不详,仅能依据血糖值对葡萄糖及胰岛素的剂量进行调整,可能对存在糖代谢紊乱的动物效果欠佳。
综上所述,应用静脉注射葡萄糖联合胰岛素法对猪PET心肌代谢显像进行血糖调控,合理安排血糖调控与显像时间,可明显缩短18F-FDG PET/CT心肌代谢显像时间、提高效率,为相关实验提供了有效的方法学依据。

