远缘杂交甜菜M14野生基因相关性状的研究
郑佳玲,刘丽萍

摘要:通过远缘杂交的方法获得了附加1条野生白花甜菜染色体,并且能稳定高频传递的单体附加系甜菜M14(Beta vulgaris L.,VV+1C、2n=18+1),白花甜菜染色体积极参与杂种细胞的代谢活动,白花甜菜9号染色体是远缘杂交甜菜M14高频传递与繁殖的遗传物质载体,具有抗寒、抗旱、高糖、抗褐斑病及叉根性等遗传学性状。对甜菜M14小孢子发生与雌配子体发育研究发现,在雄配子体发生过程中,由单核小孢子到二细胞花粉形成期间有精核退化或消失致使花粉败育达85%以上。由于附加1条野生白花甜菜染色体严重影响甜菜M14雄配子体的分化与发育导致其结实率低下。雌配子体发育研究证明,甜菜M14属于配子体无融合生殖中的二倍孢子体(diplospory)兼性无融合生殖体,讨论了远缘杂交甜菜M14附加的白花甜菜染色体对遗传育种及野生甜菜优质基因利用的价值。
关键词:甜菜;远缘杂交;野生基因;相关性状
基金项目:功能无机材料化学教育部重点实验室项目“甜菜染色体操纵遗传学研究”(项目编号:201606);黑龙江省创新创业A类训练项目“远缘杂交甜菜野生基因相关性状的研究”项目编号:(201810212120)
中图分类号: S566 文献标识码: A DOI编号: 10.14025/j.cnki.jlny.2018.20.029
甜菜远缘杂交是将野生种有益基因转移到栽培甜菜的主要措施,也是扩大优质基因库的重要途径[1]。通过远缘杂交获得的近100%高频传递材料单体附加系甜菜M14具有非常重要的研究价值和应用潜力。
Jassem B[2].(1990)报道白花甜菜组(Corollinae Section)的各物种都存在无融合生殖能力。单体附加系甜菜M14属于配子体兼性无融合生殖材料(VV+1C,2n=2x+1=19)。从1988年开始对栽培甜菜、沿海甜菜、叶用甜菜、白花甜菜、平匐甜菜、小碗花甜菜等进行种间远缘杂交,其中主要的杂交组合是栽培甜菜(B.vulgaris)与白花甜菜(B.corolliflora Zoss)的种间杂交。黑龙江大学郭德栋教授成功地将带有无融合生殖基因的白花甜菜9号染色体转移到普通栽培甜菜上,使只进行有性生殖的栽培甜菜可高效表达无融合生殖特性[3-5],具有非常重要的应用前景。
核型分析结果表明[6-8]:单体附加系M14中甜菜各物种的染色体是稳定的,附加的1条白花甜菜染色体所携带的特异基因致使单体附加系甜菜M14的高频传递特性得以表达。郭德栋等[9-12]利用“Microdissection”技术在南开大学成功分离白花甜菜9号染色体,方晓华[7]等成功构建白花甜菜人工染色体BAC文庫并建成白花甜菜9号染色体特异性探针池,共49920个克隆,平均插入片段127kb,覆盖染色体基因组7.5倍[13-15]。利用白花甜菜特异的散在重复序列作为探针筛选附加的第9号染色体的BAC共2377个,覆盖附加的染色体3.4倍[16,18-19]。李海英等[20-23]利用无融合生殖甜菜花期mRNA对白花甜菜9号染色体的BAC芯片进行差异杂交,发现2个BAC克隆含有M14花期特异表达的基因。戈岩等[17]对单体附加系甜菜M14进行荧光原位杂交,供试探针被定位于附加的白花甜菜第9号染色体的长臂末端[27]。胚胎学研究判定单体附加系甜菜具有兼性无融合生殖特性[24-26]。目前为止,查阅国内外相关资料显示,尚没有对单体附加系甜菜M14野生基因相关性状的研究报道。本文报道弥补了远缘杂交甜菜研究的不足,为甜菜远缘杂交材料的深入研究提供了基础理论依据,拓展了甜菜野生基因优势的利用前景。
1 材料与方法
1.1 材料与试剂
远缘杂交甜菜单体附加系M14由黑龙江大学提供,黑龙江大学甜菜课题组鉴定其为兼性无融合生殖材料(VV+1C,2n=2x+1=19)。
盐酸、冰乙酸、甘油、醋酸洋红、无水乙醇、70%乙醇、8-羟基喹啉、石碳酸、甲醛、山梨醇、中性树胶、二甲苯。染色液为改良苯酚品红和醋酸洋红。
1.2 仪器与设备
OLYMPUS-BX51显微镜(日本OLYMPUS公司)、普通光学显微镜(国产)、解剖镜(国产)。
1.3 方法
1.3.1 甜菜M14细胞及遗传性状调查 (1)附加白花甜菜染色体检查:取材:早8:00取样,取样部位:甜菜心叶,用0.002M/L8-羟基喹啉预处理2h,卡诺固定液(乙醇与冰乙酸体积比为3∶1)固定4h,用等体积的盐酸和乙醇解离,水洗,改良碱性品红染色,压片,观察,拍照。(2)花粉败育检测:为进一步研究甜菜无融合生殖的机理于单体附加系M14植株田间花期取花絮固定,解剖镜分离花药,利用压片技术观察甜菜单体附加系M14品系花粉发生发育,醋酸洋红染色观察甜菜M14花粉母细胞的发育情况,OLYMPUS-BX51显微观察并拍照。
1.3.2 空中搭载实验 将附加1条野生白花甜菜染色体的单体附加系甜菜M14的种子通过中科院物理所进行空中搭载实验后返回田间进行种植,并调查其相关生物学性状。
2 结果与分析
2.1 远缘杂交获得的单体附加系甜菜M14
利用栽培甜菜(B.vulgaris L.)与白花甜菜(B.corolliflora Zoss)种间杂交及回交,获得了1个近100%稳定传递的单体附加系甜菜M14植株。栽培甜菜和白花甜菜的种间杂交,通过自然重组,成功将1条白花甜菜染色体导入普通栽培甜菜获得单体附加系甜菜M14(2n=18+1),有丝分裂中期染色体形态如图1所示。
2.2 空中搭载实验含糖量检测
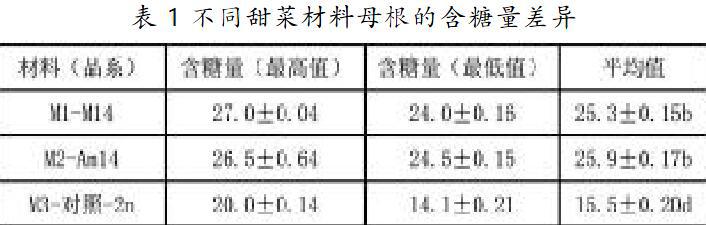
经过连续4年的含糖量检测,对单体附加系甜菜M14和空中搭载实验Am14材料随机抽检50株母根,M3为对照组普通栽培甜菜。检测结果:对照组M3普通栽培甜菜含糖量的最高值、最低值和平均值均低于M1和M2。空中搭载的甜菜M2和未进行空中搭载的M1差异不显著。结果如表1所示。
2.3 野生基因相关性状调查
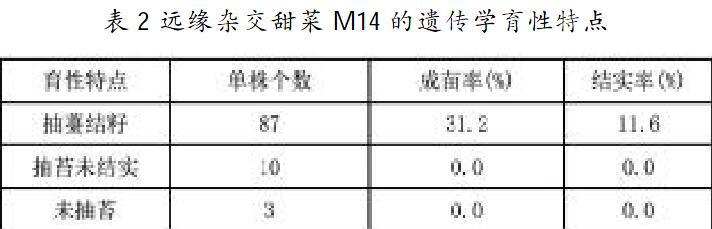
遗传学性状是区分甜菜远缘杂交后代的重要标志。对远缘杂交甜菜野生基因相关性状研究每年都要进行,包括:根、茎、叶;花、果实、种子;结实率、发芽率、出苗率、植株繁茂程度、植株高矮、抽薹类型、花期早晚、花药败育情况调查;根型、大小、叉根性等。本文对100株远缘杂交甜菜的野生基因性状和育性特征进行了调查,抽薹在6~7月份;花期6~8月份;结实在9~10月份;结实率调查在10~11月份;根形特征调查和含糖量检测在冬季。甜菜M14育性特征检测结果如表2所示。
2.4 甜菜单体附加系M14花粉育性检测结果
单体附加系甜菜M14花粉败育现象比较突出,成熟花药为棕褐色,利用解剖镜分离初期幼小花药,通过压片法对甜菜M14的花药及花粉育性进行检测分析,结果发现,普通栽培甜菜小孢子母细胞减数分裂步骤一致,但是,单体附加系甜菜M14的同一花药小孢子母细胞减数分裂行为频率不同。处于正常减数分裂状态的只有3.5%左右。而85%以上的花粉败育是绒毡层细胞过早解体,如图所示,花粉育性检测结果验证了单体附加系甜菜M14为兼性无融合生殖材料的理论基础。花粉败育绒毡层解体特征如图2所示。
3讨论
3.1远缘杂交甜菜M14附加的白花甜菜染色体对遗传育种的影响
野生白花甜菜染色体携带的基因能够稳定高频传递后代。甜菜远缘杂交可深入研究种间亲缘关系的远近。胚胎学鉴定为单体附加系甜菜M14为兼性无融合生殖体。细胞学研究发现,有性生殖比率占3.5%,无融合生殖比率占96.5%。虽然有性生殖比率低,但是其繁殖能力超强,无融合生殖甜菜由于雄配子体发生过程中出现异常,绒毡层过早解体导致营养供应受到阻滞,以至于花粉败育率高、繁殖能力低下、结实率偏低的结果。推断有性生殖体存在致死基因的可能性。无融合生殖体二倍体孢子生殖的一些报道说明少数种的卵细胞自发形成胚,同时它们的花粉发育也是败育的。
3.2 野生白花甜菜优质基因的利用价值
含糖量检测实验对远缘杂交甜菜的应用性研究具有重要的参考价值,远缘杂交甜菜M14含糖量显著高于普通栽培甜菜10%左右。所以说远缘杂交是利用和开发有益基因的重要途径。在黑龙江这样寒冷的低温带种植远缘杂交甜菜M14,形态长势良好,具有抗寒、抗旱的特性。野生白花甜菜来自英国皇家植物园,它的根形酷似人参状,因此,杂交后的甜菜M14具有叉根的特性,同时具有高糖、抗褐斑病的优良性状,该甜菜具有潜在的应用价值。
3.3 无融合生殖的标志性特征
远缘杂交甜菜M14 为高频传递的二倍体孢子无融合生殖的人工合成物种,传递率在96.5%。其花粉发生败育比率较高的主要原因是由于附加了1条野生种白花甜菜染色体所導致,从而影响植株的正常结实与繁殖发育,其花药呈褐色,外形干瘪,育性检测结果验证了远缘杂交甜菜M14的结实率低下的原因。单体附加系甜菜M14只有11.6%的结实率,单体附加系甜菜M14花粉败育现象被认定为是无融合生殖的重要标志[28]。对野生白花甜菜染色体及其携带的基因进行相关研究仍然是今后较长时间内研究的方向和重点。
4 结论
对远缘杂交甜菜M14野生基因相关性状进行研究,报告了单体附加系甜菜M14的遗传学性状,就花粉败育进行了调查和统计分析,附加的白花甜菜染色体导致绒毡层过早解体,花粉败育也是无融合生殖的重要标志,野生基因的相关性状分析,单体附加系甜菜M14 的高糖和叉根性状显著遗传了野生白花甜菜的特性,研究结果,为远缘杂交甜菜的应用性研究提供了基础理论依据。
参考文献
[1]Li Z Z. Translated from contribution of cell genetics to plant breeding [J]. The fifteenth international genetics conference abstracts, 1983, 118-119.
[2]Jassem B. Apomixis in the Genus Beta [J]. Apomixis Newsletter, 1990 (02):7-23.
[3]Nogler G A. Genetics of apospory in apomictic.Ranunculus auricomus. V. Conclusio ns [J]. Bot Helv, 1984 (94):411-422.
[4] Adachi S M. Karyotype analysis in the Beta species[J].Bul.of Fac.Agr.Mie Univ.Tniv.Tsu.Japan,1962 (25):25-32.
[5] Bosemark N O, Bormotov V E. Chromosome morphology in a homozygous line of sugar beet [J]. Hereditas, 1971 (69):205-212.
[6]郭德栋,王桂芝,王继志,等.栽培甜菜和白花甜菜种间杂交的研究(Ⅰ)种间杂种后代形态学变异[J].黑龙江大学自然科学学报,1991,18(03):9-16.
[7]王桂芝,郭德栋,贾树彪,等.栽培甜菜(Beta vulgaris L.)和白花甜菜(Beta corolliflora Zoss.)种间杂交及细胞遗传学研究[J]. 中国甜菜糖业,1994:(03):7-15.
[8]康传红,王桂芝,贾树彪,等.栽培甜菜和白花甜菜种间杂交后代无融合生殖的观察[J].中国甜菜,1995(01):3-8.
[9] Peel M D,Carman J G,Liu Z W,Wang R C.Meiotic anomalites in hybrids beteen wheat and apomictic Elymus rectisetus(Nees in lehm.)A.Love Connor.Crop Sci,1997,37(03):717723.
[10]Koltunov A M. Apomixis: Moleculer strategies for the generation of genetically identical seeds without fertilization. Plant Physiology.1995.180:1345-1352.
[11] Khush G S, et al. Aopmixis for Rice Improvement.InG S,Khush,ed,Apomixis:Exploiting hybrid vigor in rice,International Rice Research Institute, Manila,Thephilipines.
[12]J P Vielle Calzada. Apomixis:The asexual revolution.Science,1996,274:1322-1323.
[13]贾宁,唐研耀,曾燕如,等. 植物无融合生殖研究进展[J].生物学通报,2015,31(12):15-24.
[14]Nogler G A. Genetics of apospory in apomictic ranunculus auricomus. V. Conclusio ns[J]. Bot Helv, 1984 (94):411-422.
[15]申業,申家恒,郭德栋,等.甜菜单体附加系M14无融合生殖的细胞胚胎学研究[J].西北植物学报,2006,26(5):975-963.
[16]刘丽萍,王艳,杨峰山,等.单体附加系甜菜M14与异缘三倍体甜菜(VVC)核型比较分析[J].中国农学通报,2014,30(09):155-159.
[17]戈岩,何光存,王志伟,等.无融合生殖甜菜M14的GISH和BAC-Fish研究[J].中国科学,C辑:生命科学,2007,37(02):209-216.
[18]郭德栋,康传红,刘丽萍,等.异缘三倍体甜菜(VVC)无融合生殖的研究[J].中国农业科学,1999(04):113-114.
[19]Fang X H, Gu S H, Xu Z Y. Construction of a binary BAC library for an apomictic monosomic addition line of Beta corolliflora in sugar beet and identification of the clones derived from the alien chromosome [J]. Theor.Appl.Gent, 2004 (108):1420-1425.
[20]李海英,马春泉,于冰,等.利用mRNA差异显示技术分离甜菜M_(14)品系特异表达基因的cDNA片段[J].植物研究,2007,27(04):465-468.
[21]蒋德生,李海英,于冰,等.甜菜M14品系BvM14-APX、BvM14-DHAR3、BvM14-MDAR基因相应NaCl胁迫的表达分析[J].云南大学学报,1999,21(08):180-181.
[22]申业,申家恒,郭德栋,等.甜菜无融合生殖单体附加系M14大孢子发生期间细胞壁胼胝质的变化[J].作物学报,2006,32(06):894-898.
[23]Savidan Y J, Carman G, Dresselhaus T. The flowering of apomisis: From Mechanisms to Genetic Engineering Mexico,DF:CIMMYT.IRD[A]. European Commission DGVI(FAIR),2001:44-63.
[24]申业,申家恒,郭德栋,等.甜菜无融合生殖单体附加系M14雌配子体的发生与发育[J].武汉植物学究,2006,24(02):106-112.
[25]刘丽萍,方晓华,康传红,等.无融合生殖甜菜单体附加系的获得和鉴定[J].哈尔滨医科大学学报,2000,34(05):1-3.
[26]康传红,刘丽萍, 李勇,等.通过单体附加系传递率分析进行甜菜无融合生殖基因定位[J].哈尔滨医科大学学报,2000,34(05):4-6.
[27]刘丽萍,刘巧红,唐艳,等.甜菜染色体操纵材料遗传学特性及经济性状的研究[J].黑龙江大学自然科学学报,2017,34(06):708-713.
[28]申业,申家恒,郭德栋,等.甜菜无融合生殖单体附加系M14小孢子发生与雄配子体发育的观察[J]. 哈尔滨师范大学自然科学学报,2003,19(06)70-74.
作者简介:郑佳玲,在读本科生,研究方向:生物技术。
通讯作者;刘丽萍,硕士,实验师,研究方向:植物生物学。

