飞蝗双链RNA降解酶的抗体制备及组织定位
宋慧芳,张建琴,范云鹤,李涛,马恩波,张建珍
飞蝗双链RNA降解酶的抗体制备及组织定位
宋慧芳1,2,3,张建琴1,4,范云鹤1,2,3,李涛1,3,马恩波1,3,张建珍1,3
(1山西大学应用生物学研究所,太原 030006;2山西大学生命科学学院,太原 030006;3农业有害生物综合治理山西省重点实验室,太原 030006;4山西大学中医药现代研究中心,太原 030006)
【目的】双链RNA降解酶(dsRNA degrading enzyme, dsRNase)是制约RNA干扰(RNAi)技术在害虫防治中应用的关键因素之一。本研究旨在利用原核表达系统获得飞蝗LmdsRNase2和LmdsRNase3的特异抗原,进而制备抗体,对其进行组织定位和蛋白表达量检测,为进一步解析飞蝗中肠dsRNA降解酶基因的功能分化提供蛋白水平的证据。【方法】通过对LmdsRNase2和LmdsRNase3的氨基酸序列(GenBank: ARW74135.1和ARW74134.1)进行比对,分别选取特异的LmdsRNase2和LmdsRNase3抗原序列(R2’、R3’)进行后续的研究。根据和的cDNA全长序列,设计包含酶切位点HI、dIII的引物,采用PCR技术扩增目标片段,双酶切后连接至pET-32a载体。将重组质粒转化至大肠杆菌BL21(DE3)感受态细胞中,加入IPTG至终浓度为0.5 mmol·L-1,37℃下诱导4 h后提取蛋白,采用SDS-PAGE电泳方法检测蛋白表达。大量培养带重组质粒的大肠杆菌,诱导目的蛋白大量表达,用镍柱亲和层析法分离R2’和R3’蛋白,Bradford法检测蛋白浓度。经两次免疫新西兰大白兔后,最终获得LmdsRNase2和LmdsRNase3的多克隆抗体。利用ELISA法测定多克隆抗体的效价,通过western blot检测抗体的特异性。提取飞蝗5龄第3天的中肠组织蛋白和中肠液,分别用LmdsRNase2和LmdsRNase3的抗体检测其表达量。最后制备飞蝗5龄第3天的中肠石蜡切片,通过免疫组化对LmdsRNase2和LmdsRNase3蛋白进行亚细胞定位。【结果】通过氨基酸序列比对发现,LmdsRNase2和LmdsRNase3具有37%的序列一致度,选取特异的序列R2’和R3’设计引物,分别包含157和153个氨基酸残基,理论分子量分别为17.0和16.8 kD。在IPTG浓度为0.5 mmol·L-1条件下,37℃诱导4 h后,目的蛋白在包涵体中大量表达。扩大培养重组菌株后提取蛋白,用镍亲和层析柱分离得到纯度为85%的R2’蛋白,可直接用于免疫;而R3’蛋白的纯度低于85%,利用电泳切胶纯化后免疫新西兰大白兔,36 d后取抗血清进行检测,效价均达到1﹕102 400,表明抗体效果良好。用多克隆抗体杂交实验室保存的His-LmdsRNase2和His-LmdsRNase3融合蛋白,对抗体进行特异性检测,结果表明R2和R3的抗体分别特异性识别LmdsRNase2和LmdsRNase3,无交叉杂交现象,且条带与His抗体杂交到的条带大小一致。采用western blot方法检测,发现LmdsRNase2蛋白在中肠组织中高表达,但在中肠液中未检测到可见表达,LmdsRNase3蛋白在中肠组织和中肠液中均未检测到表达。进一步采用免疫组化方法对两个蛋白进行组织定位,发现LmdsRNase2和LmdsRNase3均在中肠细胞质中表达,但LmdsRNae3的表达量较低。【结论】成功制备了特异性良好的飞蝗LmdsRNase2和LmdsRNase3抗体,western blot和免疫组化分析表明LmdsRNase2在中肠细胞质中高表达,而LmdsRNase3的表达量很低。研究结果为飞蝗中肠两个dsRNA降解酶LmdsRNase2和LmdsRNase3的功能分化提供了蛋白水平的证据。
飞蝗;dsRNA降解酶;多克隆抗体;组织定位
0 引言
【研究意义】RNA干扰(RNAi)技术作为高效的反向遗传手段被广泛应用于昆虫学领域[1-3],近年来,随着研究工作的不断深入,利用RNAi技术进行害虫防治已成为植保领域的新型策略[4-5]。但在通过饲喂双链RNA(dsRNA)防治农业害虫飞蝗()的过程中,发现虫体中肠内的双链RNA降解酶(dsRNA degrading enzyme,dsRNase)可快速降解dsRNA,导致RNAi效率极低[6]。因此,制备飞蝗dsRNase抗体,并对其进行组织定位,进而从蛋白水平阐释飞蝗dsRNA降解酶的生物学功能及分化机制,对RNAi技术在害虫防治中的应用具有重要的理论与实践意义。【前人研究进展】目前,已有很多证据表明dsRNA在进入细胞前保持完整性是保证RNAi效率的关键因素之一[7-9]。Arimatsu等[10]在鳞翅目昆虫家蚕()肠液中纯化得到BmdsRNase蛋白,发现其具有降解dsRNA的活性;Garbutt等[11]研究发现,烟草天蛾()RNAi效率低下的主要原因是虫体血淋巴可以快速降解dsRNA,进一步研究发现其中一个dsRNase在血淋巴和中肠中均表达,另外一个dsRNase只在中肠组织高表达;Wynant等[12]在沙漠蝗()中鉴定出4个肠道高表达的核酸酶基因,经RNAi初步研究表明,只有dsRNase 2具有降解dsRNA的活性;随后,Spit等[13]在马铃薯甲虫()中也鉴定获得两个肠道高表达的dsRNase,同时沉默这两个dsRNase后,提高了饲喂dsRNA介导的RNAi效率;Luo等[14]在烟粉虱()中也发现存在两个dsRNase基因,一个在中肠高表达,另一个在全身均有表达,同时沉默这两个基因之后可提高烟粉虱的RNAi效率。由此可见,众多学者把提高RNAi效率的研究重点聚焦在昆虫dsRNase的分子功能方面。【本研究切入点】虽然越来越多的昆虫双链RNA降解酶被报道,但大多集中于cDNA序列获取、mRNA水平的表达特性以及沉默该基因后对RNAi效率的影响,对其蛋白表达特性以及组织定位仅在家蚕中有报道[7,15]。笔者课题组针对飞蝗饲喂dsRNA干扰无效的分子机制开展了深入研究,发现飞蝗具有4个dsRNase基因,经qPCR检测发现,和在中肠组织高表达,进一步采用RNAi技术分析发现,LmdsRNase2可导致dsRNA在中肠快速降解,构成飞蝗饲喂dsRNA干扰无效的主要影响因素[6]。然而,LmdsRNase2和LmdsRNase3蛋白在昆虫中肠组织的定位以及表达还未见系统研究。【拟解决的关键问题】分别选取LmdsRNase2和LmdsRNase3特异的抗原序列区进行原核表达并制备多克隆抗体,随后对LmdsRNase2和LmdsRNase3进行组织定位与分析,为进一步阐明飞蝗dsRNA降解酶的功能分化提供蛋白水平的证据,促进RNAi技术在害虫防治中的应用。
1 材料与方法
试验于2016—2017年在山西大学应用生物学研究所完成。
1.1 材料和试剂
材料:供试飞蝗饲养于山西大学应用生物学研究所养虫室。温度28—30℃,光周期14 L﹕10 D,相对湿度15%—25%。取飞蝗5龄第3天中肠进行分析。
试剂:pET-32a原核表达载体由实验室保存。限制性内切酶HI和dIII购于美国New England Biolabs公司;Taq酶、T4连接酶、DNA Marker均购于TaKaRa公司;胶回收试剂盒、质粒提取试剂盒购于美国OMEGA公司;引物合成和测序由生工生物工程(上海)有限公司完成;IPTG购于索莱宝公司;His单克隆抗体购于美国Santa Cruz公司;羊抗鼠免疫球蛋白G和羊抗兔免疫球蛋白G购于北京中杉金桥公司;标准蛋白Marker和BCIP/NBT-AP显色试剂盒购于碧云天生物公司;SYTOX®Green nucleic acid stain荧光染料购于美国Thermo Fisher公司,驴抗兔Cy3荧光二抗购于美国Jackson ImmunoResearch公司。
1.2 抗原序列的选取以及原核表达载体的构建
用MEGA 5软件对LmdsRNase2和LmdsRNase3的氨基酸序列进行比对,找出差异序列并运用在线软件(http://web.expasy.org/compute_pi/)预测其分子量大小以及等电点等,进而选取特异的抗原序列(R2’和R3’)。
和的编码区已在飞蝗中成功扩增并保存为Blunt-菌株,提取质粒作为模板。分别设计并合成R2’的正向引物CGCGACGGGCAGTCG-TACGAC和R2’的反向引物CCCGCTACGGCGCAGCGTTCA CGTAC;R3’的正向引物CGCCGCAAGAGC CTCCGCCGC和R3’的反向引物CCCGCTA GGCTC- CCGTGAGAGCTAC,其中酶切位点HI和dIII用下划线表示,引入终止密码子用粗体标出。PCR扩增得到R2’和R3’抗原序列,用HI和dIII双酶切后连接至pET-32a载体上,送至生工生物工程(上海)有限公司测序。
1.3 R2’/R3’的诱导表达及纯化
将测序正确的重组质粒pET-32a-以及空载体pET-32a转化至BL21(DE3)感受态中,挑取单克隆,接种到3 mL带氨苄青霉素(50 µg·mL-1)的LB培养基中,37℃下200 r/min振荡培养至OD600为0.6—1,加入IPTG至终浓度为0.5 mmol·L-1,37℃下诱导4 h。12 000×离心5 min收集菌体,用PBS缓冲液重悬菌体并加入蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)进行超声破碎,裂解产物在4℃条件下12 000×离心10 min,分离上清和沉淀。经12%的SDS-PAGE凝胶电泳后,用考马斯亮蓝染色检测。
将检测可表达重组蛋白的菌株接种至1 L LB培养基中,采用优化条件进行诱导,8 000×离心20 min收集菌体,加入Buffer I(20 mmol·L-1pH 7.4的Tris-HCl缓冲液,10 mmol·L-1咪唑,0.5 mol·L-1NaCl)进行吹悬,加入PMSF后超声破碎30 min。12 000×离心30 min后留取沉淀,加入Buffer II(20 mmol·L-1pH 7.4的Tris-HCl缓冲液,10 mmol·L-1咪唑,0.5 mol·L-1NaCl,0.5% Triton-100,0.2 mmol·L-1EDTA)清洗3次,加入Buffer III(8 mol·L-1尿素,20 mmol·L-1pH 8.0的Tris-HCl缓冲液,100 mmol·L-1NaCl,5%甘油)吹悬沉淀后4℃振荡过夜。16 000×离心30 min后收集上清并用0.45 μm的滤膜过滤。用GE公司的AKTA pure系统以及配套的HisPrep FF 16/20预装柱进行纯化。用Buffer III对柱子进行平衡,用Buffer III-10 mmol·L-1咪唑(Buffer III,10 mmol·L-1咪唑)以及Buffer III-500 mmol·L-1咪唑(Buffer III,500 mmol·L-1咪唑)进行连续梯度洗脱,收集洗脱液共10管(E1—E10),每管5 mL。洗脱组分通过SDS-PAGE检测。
1.4 抗体制备以及效价检测
多克隆抗体的制备以及效价检测委托北京华大蛋白质研发中心完成。取纯化后的目的蛋白400 μg,用生理盐水稀释至200—500 μL,与等体积的弗氏佐剂混合,充分混匀,形成油包水。选取2.0 kg左右的新西兰大白兔进行免疫,将混匀的油包水免疫原对其背部进行皮下注射,完成初次免疫。14 d及26 d后再分别进行一次加强免疫,免疫量为200 μg。36 d时,耳静脉取血检测效价,之后颈动脉取血,5 000×离心10 min后,收取血清作为多克隆抗体。
采用ELISA方法测定制备抗体的效价。包被液(Na2CO3-NaHCO3缓冲液,pH 9.6)稀释重组蛋白抗原至终浓度为2 μg·mL-1,从200倍开始用PBS缓冲液梯度稀释,设置PBS为空白对照,200倍PBS稀释的阴性血清为阴性对照,二抗为稀释20 000倍的山羊抗兔IgG/HRG,显色5 min后加50 μL终止液(2 mol·L-1H2SO4)终止反应;双波长(450/630 nm)测吸光值。免疫前的血清为对照,其OD值为N;免疫后的血清OD值为P,当P/N≥2.1即认为是阳性[16-17]。
1.5 western blot检测抗体的特异性
取飞蝗5龄第3天的虫体进行解剖,小心将中肠外面的液体用纸巾吸干,再将中肠内容物以及消化液移入离心管中,加入100 μL PBS缓冲液,16 000×离心10 min后取上清即为中肠液,将中肠组织放入离心管中,加入PBS提取中肠蛋白。取Sf9细胞-杆状病毒系统表达的His-LmdsRNase2和3全长蛋白[6]作为阳性对照,使用Bradford法[18]测定蛋白浓度。制备12%的SDS-PAGE凝胶进行电泳,上样量为100 μg蛋白。采用湿转法[19]将蛋白转印至硝酸纤维素膜上(100 V,100 min)。用含5% w/v牛血清白蛋白(BSA)的TBST缓冲液(20 mmol·L-1pH 7.4的Tris-HCl,150 mmol·L-1NaCl,0.05% Tween-20)在室温下封闭2 h,然后与制备的R2和R3多克隆抗体以及His单克隆抗体4℃孵化过夜。TBST洗膜3次,每次10 min,将膜与碱性磷酸酶共价结合的羊抗兔或羊抗鼠免疫球蛋白G孵育1 h,TBST洗膜3次,每次10 min。使用BCIP/NBT-AP显色试剂盒进行显色。
1.6 免疫组化进行组织定位分析
取飞蝗5龄第3天的虫体进行解剖,中肠组织用4%的多聚甲醛固定2 d后,制备石蜡切片,厚度为5 μm,方法参见Liu等[20]对中肠石蜡切片步骤的描述。切片经梯度酒精脱蜡后,用3%双氧水37℃处理10 min,0.01%柠檬酸缓冲液(pH 6.0)煮沸15 min后冷却。用10%羊血清37℃封闭30 min,分别滴加1﹕500和1﹕200稀释的R2和R3抗体,37℃孵育2 h。洗涤后滴加驴抗兔Cy3荧光二抗,避光37℃孵育1 h。PBS冲洗3次,每次5 min。滴加SYTOX®Green nucleic acid stain荧光染料(1﹕1 000稀释),37℃孵育10 min,冲洗,干燥,中性树胶封固后,采用LSM 880(Zeiss,Germany)激光共聚焦显微镜进行观察拍照,Cy3和SYTOX®Green荧光的激发波长分别为561和504 nm。
2 结果
2.1 飞蝗LmdsRNase2和LmdsRNase3抗原序列的选取
运用MEGA 5软件对LmdsRNase2和LmdsRNase3(GenBank:ARW74135.1和ARW74134.1)进行比对后,采用GeneDoc软件作图,结果如图1所示。飞蝗LmdsRNase2和LmdsRNase3分别编码405和390个氨基酸,具有37%的序列一致性,仅在序列两端差异明显。图中黑色实线框为选取的LmdsRNase2抗原序列区R2’,以DGQS开始,NAAP结尾,共157个氨基酸残基;黑色虚线框为选取的LmdsRNase3抗原序列区R3’,以RKSL开始,LTGA结尾,共153个氨基酸残基。运用pI/Mw在线软件分析R2’和R3’的理论分子量,分别为17.0和16.8 kD,理论等电点为4.8和8.3。
2.2 pET-32a-R2’/R3’的构建及蛋白诱导表达
以实验室保存的Blunt-LmdsRNase2和LmdsRNase3菌株为模板,设计引物,PCR扩增得到的目的条带约为470 bp,将目的片段双酶切连接至线性化的pET-32a载体上,得到重组质粒pET-32a-/。重组质粒经HI和dIII双酶切鉴定。结果如图2-A所示,pET-32a质粒全长为5 900 bp,以及条带也与图中相应条带位置一致(白色箭头所示),测序结果显示重组质粒构建成功。
将重组质粒转化至菌株BL21(DE3)中,用0.5 mmol·L-1的IPTG 37℃诱导4 h后提取蛋白,分离上清和沉淀,经SDS-PAE凝胶电泳检测,结果如图2-B所示。R2’和R3’片段均在包涵体中大量表达(黑色箭头所示)。R2’和R3’融合蛋白的理论分子量约为33 kD,图中箭头所示分子量大小符合预期。

黑色实线框Black solid box:LmdsRNase2抗原序列the sequences of R2’;黑色虚线框Black dotted box:LmdsRNase3抗原序列the sequences of R3’

A:重组质粒的双酶切鉴定Recombinant plasmids digested with BamH I and Hind III;Marker:DNA分子量标准物 DNA standard size markers。B:目的蛋白诱导表达后SDS-PAGE电泳检测SDS-PAGE analysis of R2’/R3’ proteins induced with IPTG;Marker:标准蛋白Marker Protein standard size markers;32a/-R2’/-R3’-S:上清 Supernatant;32a/-R2’/-R3’-P:沉淀 Precipitate
2.3 目的蛋白的纯化
目的蛋白R2’以及R3’经扩大培养并诱导表达后,经亲和层析柱纯化后的组分通过12% SDS- PAGE凝胶电泳进行条带分析(图3-A),结果显示,R2’在E2组分中纯度最高,而R3’在E6组分中所获得的量虽较少,但纯度较高。为进一步制备抗原,将样品透析除盐后,检测R2’-E2和R3’-E6的蛋白浓度约为3和1 mg·mL-1,发现只有R2’的纯度达到85%以上(图3-B),故R3’样品进行胶纯化后再开展后续的免疫程序。
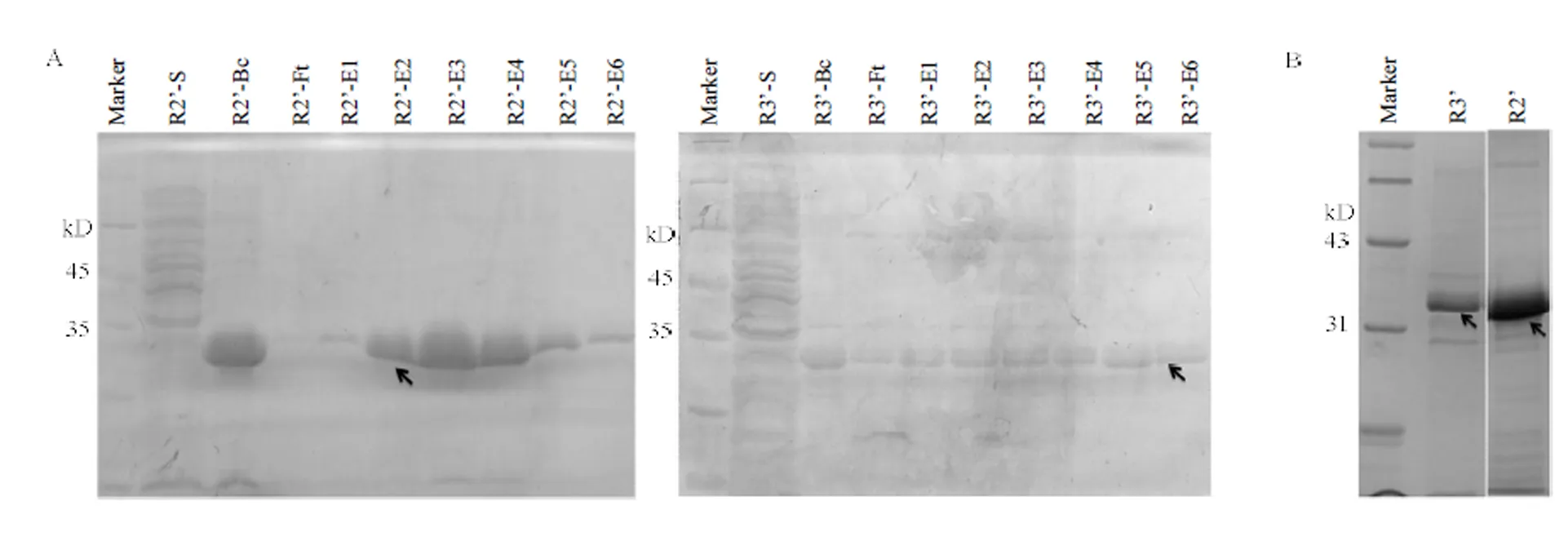
A:纯化后的R2’/R3’蛋白SDS-PAGE电泳检测SDS-PAGE analysis of purified protein R2’ and R3’;Marker:标准蛋白Marker Protein standard size markers;R2’/R3’-Bc:柱纯化前的粗蛋白组分 Before column fraction;R2’/R3’-Ft:未与柱结合的组分 Flow through column fraction;R2’/R3’-E1、E2……E6:含不同浓度咪唑的洗脱液对结合有目的蛋白进行洗脱的组分 Eluted fractions washed by different concentrations of imidazole;箭头指示为目的蛋白 The arrow points to the target protein。B:目的蛋白免疫兔子前SDS-PAGE电泳检测SDS-PAGE analysis of R2’/R3’ proteins which were used for injection
2.4 抗体效价以及特异性检测
纯化后的R2’和R3’蛋白经两次免疫兔子之后获得多抗血清,用ELISA法对抗体效价进行检测,结果如表1所示,效价达到了1﹕102 400,显示抗体效果良好。为进一步检测抗体的特异性,取实验室保存的用杆状病毒-昆虫细胞表达系统异源表达的His-LmdsRNase2(R2)和His-LmdsRNase3(R3)全长蛋白作为对照。Western blot检测结果如图4-A所示,R2的抗体只能识别His-LmdsRNase2,大小与图4-B中His抗体检测到的His-LmdsRNase2大小一致,同样R3的抗体只能识别His-LmdsRNase3,抗体特异性良好。此外,提取飞蝗中肠组织蛋白和中肠液后,用R2的抗体检测,可见中肠中LmdsRNase2的表达,但有3条条带,而在中肠液中未检测到蛋白表达。用R3的抗体未检测到中肠和中肠液中LmdsRNase3的表达。
2.5 飞蝗LmdsRNase2和LmdsRNase3的组织定位
为进一步了解LmdsRNase2和LmdsRNase3在飞蝗中肠组织中的表达情况,利用免疫组化方法分析了其在中肠组织中的定位,结果如图5所示。二者均在中肠细胞质中表达,但LmdsRNase3的表达量明显低于LmdsRNase2。

表1 抗体效价检测

A:Western blot检测 LmdsRNase2/3 在飞蝗中肠中的表达 Western blot analysis of LmdsRNase2/3 expression level in L. migratoria midgut;Marker:标准蛋白Marker Protein standard size markers;Control:Sf9细胞裂解上清 Sf9 cells lysate;R2/R3:Sf9细胞中过表达的His-LmdsRNase2/3全长蛋白 Expressed His-LmdsRNase2/3 proteins by Sf9 cell;MG1/2:中肠组织蛋白 Total protein of L. migratoria midgut;MG-F1/2:中肠液 Midgut fluid。 B:His抗体检测Sf9 细胞中过表达的His-LmdsRNase2/3 The detection of His-LmdsRNase2/3 by His-tag antibody

绿光指示的为细胞核 Green color indicates the cell nucleus:红光指示的为LmdsRNase2/3 Red color indicates LmdsRNase2/3;阴性血清作为对照negative serum as the control
3 讨论
RNAi技术自1998年首次在秀丽线虫()中报道[21],目前已广泛应用于多种生物的功能基因研究[22-23]。2007年,Baum等将该技术应用于转基因玉米中,结果表明经过转基因表达ds的玉米植株可以显著抵抗玉米根叶甲()对根部的侵害[24]。随后,由农作物介导表达dsRNA进行害虫防治的方法陆续在水稻()[25]、棉花()[26]、马铃薯()[27]等作物中得以研究报道。近年来,RNAi技术已被公认为是第4代杀虫剂的核心技术,基于RNAi的害虫防治已逐渐成为一种新型的害虫绿色防控策略[4-5]。但是,目前制约RNAi技术的主要因素是不同昆虫间RNAi效率差异明显,甚至同一种昆虫dsRNA导入方式不同也可导致RNAi效率不同,如飞蝗注射dsRNA后可以出现目的基因的显著沉默[28],但饲喂dsRNA却未出现基因沉默现象[29]。进一步研究发现,飞蝗有4个dsRNase基因,在mRNA水平上LmdsRNase2和LmdsRNase3均在中肠组织高表达[6]。
本研究成功获得LmdsRNase2和LmdsRNase3的抗体,特异性良好(图4)。提取中肠组织蛋白和中肠液之后,用R2和R3的抗体分别检测LmdsRNase2和LmdsRNase3的蛋白表达水平,发现R2抗体在中肠组织中可以杂交到3条条带。Arimatsu等[30]研究发现,在家蚕中肠组织中经分子筛分离得到3条条带,一条是45 kD的BmdsRNase前体,一条是43 kD的切除了信号肽的中间体,还有一条是41 kD的BmdsRNase成熟体。因此,笔者推测本文检测到的3条条带可能是飞蝗dsRNase2的不同剪切体。在中肠组织中并未检测到LmdsRNase3的表达,表明LmdsRNase3的表达量很低,这与笔者课题组前期的转录本检测结果一致,中肠组织中的表达丰度是的28倍[6]。同时,采用RNAi技术沉默后,中肠液不再降解dsRNA,而沉默后,中肠液依然可降解dsRNA;用杆状病毒-昆虫细胞表达系统异源表达的LmdsRNas2融合蛋白在体外可以快速降解dsRNA,而LmdsRNase3融合蛋白则不能降解dsRNA。这些结果均表明,在中肠液中发挥降解dsRNA功能并最终导致饲喂飞蝗dsRNA干扰无效的主要因子是LmdsRNase2[6]。本文的结果从蛋白层面为上述结果提供了有力的佐证。
此外,在飞蝗中肠液中未能检测到LmdsRNase2和LmdsRNase3蛋白,分析其原因,可能是分泌至中肠液中的LmdsRNase2蛋白占总蛋白量的比例低,而LmdsRNase3由于缺信号肽,推测可能未分泌到中肠液中。Arimatsu等[10]从家蚕中肠液中分离提纯得到家蚕dsRNase并对其蛋白降解特性进行了研究,该实验提取了25 mL家蚕中肠液(总蛋白量93.5 mg)经多步纯化后得到了11 μg的dsRNase蛋白。而本研究中每个样品只提取了5头飞蝗的中肠液,总蛋白量只有约400 μg,按照家蚕中肠液中dsRNase的比例计算,用于检测的飞蝗中肠dsRNase仅0.05 μg,这可能是中肠液中抗体未检测到dsRNase的主要原因。目前国际上对昆虫dsRNase蛋白表达特性以及组织定位仅在家蚕中有报道,Arimatsu等[15]用免疫组化的方法发现家蚕dsRNase定位于家蚕中肠细胞中。本研究中免疫组化分析结果可见,LmdsRNase2在中肠细胞中均有大量表达,而LmdsRNase3的表达量较低,这与家蚕中的报道一致。本研究制备得到的LmdsRNase2和LmdsRNase3的抗体可用于LmdsRNase2蛋白抑制剂的筛选或飞蝗两个中肠特异的核酸酶LmdsRNase2和LmdsRNase3的功能分化等研究,有助于对飞蝗饲喂dsRNA无效的分子机制进行深入解析,促进RNAi技术在飞蝗及其他害虫防治中的应用。
4 结论
成功获得飞蝗LmdsRNase2和LmdsRNase3的特异性抗体,进一步采用western blot技术进行检测和免疫荧光分析。结果显示,LmdsRase2和LmdsRNase3均在飞蝗中肠细胞中表达,但LmdsRNase3表达量较低。据此分析,在飞蝗中肠中,LmdsRNase3蛋白表达丰度低是该酶不发挥降解dsRNA的另一主要原因。研究结果为解析飞蝗中肠LmdsRNase2和LmdsRNase3两个酶的功能分化提供了蛋白水平的证据。
[1] BETTENCORT R, TERENIUS O, FAYE I.gene silencing by ds-RNA injected into Cecropia pupae is lethal to next generation embryos., 2002, 11(3): 267-271.
[2] TIAN H G, PENG H, YAO Q, CHEN H X, XIE Q, TANG B, ZHANG W Q. Developmental control of a Lepidopteran pest,, by ingestion of bacteria expressing dsRNA of a non-midgut gene., 2009, 4(7): e6225.
[3] YU R R, LIU W M, LI D Q, ZHAO X M, DING G W, ZHANG M, MA E B, ZHU K Y, LI S, MOUSSIAN B, ZHANG J Z. Helicoidal organization of chitin in the cuticle of the migratory locust requires the function of the chitin deacetylase2 enzyme (LmCDA2)., 2016, 291(47): 24352-24363.
[4] ZHANG J, KHAN S A, HECKEL D G, BOCK R. Next-generation insect-resistant plants: RNAi-mediated crop protection., 2017, 35(9): 871-882.
[5] ZHU K Y, MERZENDORFER H, ZHANG W Q, ZHANG J Z, Muthukrishnan S. Biosynthesis, turnover, and functions of chitin in insects., 2016, 61(1): 177-196.
[6] SONG H F, ZHANG J Q, LI D Q, COOPER A M W, SILVER K, LI T, LIU X J, MA E B, ZHU K Y, ZHANG J Z. A double-stranded RNA degrading enzyme reduces the efficiency of oral RNA interference in migratory locust., 2017, 86: 68-80.
[7] LIU J S, SWEVERS L, IATROU K, HUVENNE H, SMAGGHE G.DNA/RNA non-specific nuclease: expression of isoforms in insect culture cells, subcellular localization and functional assays., 2012, 58(8): 1166-1176.
[8] WANG K X, PENG Y C, PU J, FU W X, WANG J L, HAN Z J. Variation in RNAi efficacy among insect species is attributable to dsRNA degradation., 2016, 77: 1-9.
[9] CAO M, GATEHOUSE J A, FICHES E C. A systematic study of RNAi effects and dsRNA stability inand, following injection and ingestion of analogous dsRNAs., 2018, 19(4): 1079.
[10] ARIMATSU Y, FURUNO T, SUGIMURA Y, TOGOH M, ISHIHARA R, TOKIZANE M, KOTANI E, HAYASHI Y, FURUSAWA T. Purification and properties of double-stranded RNA-degrading nuclease, dsRNase, from the digestive juice of the silkworm,., 2007, 76(1): 57-62.
[11] GARBUTT J S, BELLES X, RICHARDS E H, REYNOLDS S E. Persistence of double-stranded RNA in insect hemolymph as a potential determiner of RNA interference success: evidence fromand., 2013, 59(2): 171-178.
[12] WYNANT N, SANTOS D, VERDONCK R, SPIT J, WIELENDAELE P V, BROECK J V. Identification, functional characterization and phylogenetic analysis of double stranded RNA degrading enzymes present in the gut of the desert locust,., 2014, 46: 1-8.
[13] SPIT J, PHILIPS A, WYNANT N, SANTOS D, PLAETINCK G, VANDEN BROECK J. Knockdown of nuclease activity in the gut enhances RNAi efficiency in the Colorado potato beetle,, but not in the desert locust,., 2017, 81: 103-116.
[14] LUO Y, CHEN Q G, LUAN J B, CHUNG S H, VAN ECK J, TURGEON R, DOUGLAS A E. Towards an understanding of the molecular basis of effective RNAi against a global insect pest, the whitefly., 2017, 88: 21-29.
[15] ARIMATSU Y, KOTANI E, SUGMURA Y, FURUSAWA T. Molecular characterization of a cDNA encoding extracellular dsRNase and its expression in the silkworm,., 2007, 37: 176-183.
[16] 赵静, 孙洋, 谭永安, 肖留斌, 姜义平, 柏立新. 甜菜夜蛾卵黄原蛋白多克隆抗体制备及其在不同发育时期蛋白表达. 中国农业科学, 2017, 50(22): 4316-4324.
ZHAO J, SUN Y, TAN Y A, XIAO L B, JIANG Y P, BAI L X. Polyclonal antibody preparation ofvitellogenin and its protein expression at different developmental stages., 2017, 50(22): 4316-4324. (in Chinese)
[17] 魏原杰, 王亚美, 黄丽娜, 刘宁, 赵洁, 艾新宇, 刘小宁. 棉蚜P450的克隆、原核表达及多克隆抗体的制备. 中国农业科学, 2017, 50(7): 1351-1360.
WEI Y J, WANG Y M, HUANG L N, LIU N, ZHAO J, AI X Y, LIU X N. Cloning, prokaryotic expression and preparation of the polyclonal antibody againstfrom., 2017, 50(7): 1351-1360. (in Chinese)
[18] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding., 1976, 72: 248-254.
[19] 宋慧芳, 李应龙, 马恩波, 张建珍. 飞蝗--乙酰氨基葡萄糖苷酶基因的表达及酶学特性分析. 中国农业科学, 2016, 49(21): 4140-4148.
SONG H F, LI Y L, MA E B, ZHANG J Z. The heterogenous expression and enzymatic characteristics of--acetylglucosaminidase from., 2016, 49(21): 4140-4148. (in Chinese)
[20] LIU X, ZHANG H, LI S, ZHU K Y, MA E, ZHANG J. Characterization of a midgut-specific chitin synthase gene () responsible for biosynthesis of chitin of peritrophic matrix in., 2012, 42(12): 902-910.
[21] FIRE A, XU S Q, MONTGOMERY M K, KOSTAS S A, DRIVER S E, MELLO C C. Potent and specific genetic interference by double-stranded RNA in., 1998, 391(6669): 806-811.
[22] WANG Y B, ZHANG H, LI H C, MIAO X X. Second-generation sequencing supply an effective way to screen RNAi targets in large scale for potential application in pest insect control., 2011, 6(4): e18644.
[23] ZHOU X G, WHEELER M M, OI F M, SCHARF M E. RNA interference in the termitethrough ingestion of double-stranded RNA., 2008, 38: 805-815.
[24] BAUM J A, BOGAERT T, CLINTON W, HECK G R, FELDMANN P, ILAGAN O, JOHNSON S, PLAETINCK G, MUNYIKWA T, PLFEAU M, VAUGHN T, ROBERTS J. Control of coleopteran insect pests through RNA interference., 2007, 25(11): 1322-1326.
[25] ZHA W J, PENG X X, CHEN R Z, DU B, ZHU L L, HE G C. Knockdown of midgut genes by dsRNA-transgenic plant-mediated RNA interference in the hemipteran insect., 2011, 6(5): e20504.
[26] MAO Y B, TAO X Y, XUE X Y, WANG L J, CHEN X Y. Cotton plants expressingdouble-stranded RNA show enhanced resistance to bollworms., 2011, 20(3): 665-673.
[27] ZHANG J, KHAN S A, HASSE C, RUF S, HECKEL D G, BOCK R. Full crop protection from an insect pest by expression of long double-stranded RNAs in plastids., 2015, 347(6225): 991-994.
[28] LI D Q, ZHANG J Q, WANG Y, LIU X J, MA E B, SUN Y, LI S, ZHU K Y, ZHANG J Z. Two chitinase 5 genes from: Molecular characteristics and functional differentiation., 2015, 58: 46-54.
[29] LUO Y, WANG X, WANG X, YU D, CHEN B, KANG L. Differential responses of migratory locusts to systemic RNA interference via double-stranded RNA injection and feeding., 2013, 22(5): 574-583.
[30] ARIMATSU Y, SUGIMURA Y, FURUSAWA T.processing of the dsRNase precursor isolated from silkworm midgut tissue,., 2011, 79(3): 125-127.
(责任编辑 岳梅)
Antibody Preparation and Subcelluar Localization of dsRNA Degrading Enzyme in
SONG HuiFang1,2,3, ZHANG JianQin1,4, FAN YunHe1,2,3, LI Tao1,3, MA EnBo1,3, ZHANG JianZhen1,3
(1Institute of Applied Biology, Shanxi University, Taiyuan 030006;2College of Life Science, Shanxi University, Taiyuan 030006;3Shanxi Key Laboratory of Integrated Pest Management in Agriculture, Taiyuan 030006;4Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan 030006)
【Objective】The dsRNA degrading enzyme (dsRNase) is an important obstacle of using RNAi technology for pest control. The objective of this study is to obtain specific antigens of LmdsRNase2 and LmdsRNase3 by using prokaryotic expression system, and then to prepare antibodies, and to detect the protein expression level of midgut and subcelluar localization. The results will provide strong evidence from protein level to further analysis of functional differentiation of LmdsRNase2 and LmdsRNase3 in the midgut of.【Method】The specific antigen sequences (R2’ and R3’) of LmdsRNase2 and LmdsRNase3 (GenBank: ARW74135.1, ARW74134.1) were chosen by alignment analysis. The primers withHI,dIII restriction sites were designed according to the complete cDNA sequences. The target sequences were amplified by PCR and ligated to pET-32a vector through double enzyme digestion. The recombinant plasmids were transformed intoBL21 (DE3) competent cells, and then the cells were induced with 0.5 mmol·L-1IPTG for 4 hours at 37℃. SDS-PAGE electrophoresis was performed to examine the target proteins. After that, large amounts ofcells were cultured for protein extraction. The target proteins R2’ and R3’ were purified through Ni-NTA agarose chromatography, and the protein concentration was determined according to the method of Bradford.The anti-LmdsRNase2 and 3 polyclonal antibodies were obtained after immunizing New Zealand white rabbit. The specificity of antibody was detected by western blot analysis, the recombinant LmdsRNase2 and LmdsRNase3 proteins were used as antigens. The titers of two antibodies were determined by ELISA. Furthermore, the total proteins were extracted frommidgut and midgut fluid on day 3 of 5th instar nymph, and western blot was used to test the expression level of LmdsRNase2 and LmdsRNase3. Finally, the paraffin sections of the midgut on day 3 of 5th instar nymph were prepared, the subcellular localization of LmdsRNase2 and LmdsRNase3 proteins in the midgut ofwas conducted by immunofluorescence.【Result】LmdsRNase2 and LmdsRNase3 showed 37% sequence identity by full-length amino acid sequence alignment, and the variant sequence regions (named as R2’ and R3’ for LmdsRNase2 and LmdsRNase3, respectively) were selected for PCR primer design. The length of R2’ and R3’ is 157 and 153 a.a., respectively, and the calculated molecular mass of them is 17.0 and 16.8 kD, respectively. The protein expression was induced with 0.5 mmol·L-1IPTG for 4 hours at 37℃, finally the expressed proteins were only detected in inclusion bodies. The recombinant proteins R2’ and R3’ were purified using Ni-NTA agarose chromatography, and the purity of R2’ is 85%, it is suitable to directly immune New Zealand white rabbit. But the purity of R3’ is under 85%. To further obtain highly purified R3’, R3’was loaded on a gel and the expected band was cut for protein extraction and following immunization. After 36 days, ELISA results indicated that the titer of LmdsRNase2 and LmdsRNase3 antibodies was 1﹕102 400. Western blot demonstrated that anti-LmsRNase2 and 3 polyclonal antibodies could specifically detect LmdsRNase2 or LmdsRNase3 proteins, respectively, no cross hybridization was observed. The molecular weight was consistent with the predicted size. LmdsRNase2 protein was highly expressed inmidgut by western blot, nevertheless, there was no detectable signal in midgut fluid. However, LmdsRNase3 could not be detected in both midgut and midgut fluid. Immunofluorescence results showed that both LmdsRNase2 and LmdsRNase3 were expressed in cytoplasm ofmidgut cells, but the expression level of LmdsRNase3 protein was much lower than that of LmdsRNase2.【Conclusion】Anti-LmdsRNase2 and 3 specific polyclonal antibodies were successfully prepared, western blot and immunofluorescence showed that LmdsRNase2 protein was highly expressed in midgut, whereas the expression of LmdsRNase3 was very low. These results provide evidence of protein level for the functional differentiation of LmdsRNases in the midgut of.
; dsRNA degrading enzyme (dsRNase); polyclonal antibody; subcelluar localization
2018-04-21;
2018-06-26
国家自然科学基金(31601697,31730074)
宋慧芳,E-mail:songhuifang88@126.com。 通信作者张建珍,E-mail:zjz@sxu.edu.cn
10.3864/j.issn.0578-1752.2018.19.008
