诃子、矮紫堇、甘青乌头提取物对牛病毒性腹泻病毒的体外抑制作用
王丹阳,张 康,王旭荣,王海瑞,王 磊,张 凯,张景艳,李建喜,王学智
(中国农业科学院兰州畜牧与兽药研究所,甘肃省新兽药工程重点实验室,兰州 730050)
牛病毒性腹泻病(BVD)又称牛病毒性腹泻-黏膜病,是牛病毒性腹泻病毒(BVDV)引起的急性、接触性传染病[1]。临床上主要表现为发热、腹泻、免疫抑制、白细胞减少、出血及致死性黏膜病,妊娠母畜流产、产畸形胎或持续性感染牛(PI牛)[2]。该病毒属于黄病毒科瘟病毒属[3],单股正链RNA分子,基因序列及抗原性和猪瘟病毒、羊边界病毒有很高的同源性[4]。近年来随着对BVDV分子特征的深入研究,囊膜蛋白E2(gP53)含有多种抗原结构域,有利于介导免疫中和反应及病毒感染的初始阶段[5-7],有些抗原决定区有较高的变异率[8-9],使得BVDV具有高度的变异性,导致疫苗保护失效和持续性感染。目前,疫苗接种仍是防控该病的主要方法,但因弱毒疫苗可诱发免疫抑制和黏膜病[10],而灭活疫苗免疫期较短,成本较高等诸多原因使得至今还没有保护效果非常好的疫苗能有效地防控该病。为此,研究高效敏感抗BVDV的药物对牛病毒性腹泻病的治疗及防控具有重要意义。随着中草药抗病毒药物的研发近几年早已成为国内外的研究热点[11],有关针对于BVDV抗病毒药物的研究也日益增多。经研究表明,人参皂苷和鹿角盘多糖具有显著的抗BVDV的作用[12-13];金丝桃素可溶性粉对BVDV也具有抑制作用,且直接杀灭作用显著[14];苦马豆素(SW)对BVDV有较好的复制抑制作用和综合作用,也有一定的直接杀伤作用[15];沙冬青种子总生物碱对BVDV有较强的直接杀伤和复制抑制作用,而无明显的吸附阻断作用[16];另外,莪术油、鱼腥草、黄茂、双黄连和五味子乙素对鹿源BVDV均具有显著的抑制作用[17-18];此外,诃子提取物及鞣质类成分、甘青乌头和矮紫堇提取物及多种生物碱成分,均具有一定的抗菌、抗病毒、抗炎等功效[19-21]。本研究主要采用了利巴韦林做阳性对照药物,通过三种不同的作用方式探究3种藏药的体外抗BVDV效果,这在之前相关的研究中均未见报道,为抗BVDV药物的研发及生产应用提供理论依据。
1 材料与方法
1.1 药物
藏药诃子、矮紫堇、甘青乌头由中国农业科学院兰州畜牧与兽药研究所购自藏区,水提法提取,冻干成粉后密封,4 ℃避光保存备用;阳性药物(利巴韦林)购自索莱宝生物有限公司。
1.2 病毒与细胞
美国标准毒株BVDV(NADL),购自中国兽医药品监察所。MDBK细胞株购自上海和园生物技术股份有限公司。
1.3 试剂与仪器
RPMI-1640培养基(GIBCO公司);胎牛血清(FBS)(GIBCO公司);胰酶(GIBCO公司);磷酸盐缓冲液(PBS)(索莱宝生物科技有限公司);Cell Counting Kit-8(碧云天生物技术有限公司);DMSO(索莱宝生物科技有限公司);SpectraMax M2e酶标仪,购自美国Molecular Devices公司;生物显微镜(22EB,德国DIALUX);原位冷冻干燥机(LGJ-10F北京松原华星科技有限公司)等。
1.4 试验方法
1.4.1 不同浓度药物稀释液的配制 采用二倍稀释法用3%细胞维持液对3种藏药冻干粉分别配制以下10个浓度:256、128、64、32、16、8、4、2、1、0.5 mg·mL-1,利巴韦林干粉稀释256、128、64、32、16、8、4、2、1、0.5 μg·mL-1,0.22 μm微滤膜过滤除菌,4 ℃避光保存备用。
1.4.2 病毒TCID50的测定 参照郝宝成等[9]的病毒毒力测定方法对BVDV的TCID50进行测定。按Reed-Muench氏法计算BVDV的TCID50为10-4.67·0.1 mL-1。
1.4.3 药物对MDBK细胞最大安全浓度的测定 消化MDBK,加入细胞生长液,按每孔1×105·mL-1的密度接种于96孔板,培养成单层细胞后,弃生长液,加梯度稀释的药液,100 μL·孔-1,每个浓度设8个重复,置培养箱中继续培养72 h,逐日观察细胞病变程度和病变孔数。同时设置正常细胞对照组和空白对照组。待CPE不再继续时,PBS洗涤细胞板3次,每孔加入10 μL的CCK8试剂,置培养箱中培养4 h,450 nm处用酶标仪测定各组细胞的吸光度(OD值)。按照下面的公式计算细胞病变率,并利用GraphPad PrismTM软件计算药物半数中毒浓度(CC50)。CC50是能够使50%的细胞发生病变时的药物浓度;最大安全浓度(MNTC)是能够使90%以上的细胞存活的药物浓度。
细胞病变率(%)=[(细胞对照组平均OD值-试验加药组平均OD值)/细胞对照组平均OD值]×100%。
1.4.4 药物体外抗BVDV作用
1.4.4.1 不同浓度药物稀释液的配制:采用二倍倍比稀释法以最大药物安全浓度为基准(诃子1 mg·mL-1;矮紫堇1 mg·mL-1;甘青乌头8 mg·mL-1;利巴韦林 2 μg·mL-1)配制以下5个稀释浓度。
1.4.4.2 药物对BVDV的直接杀伤作用:将等量的100·TCID50BVDV病毒液与药物稀释液混合均匀置于培养箱中预先作用4 h,加入96孔板,100 μL·孔-1,培养箱中作用2 h,弃上清液,加100 μL细胞维持液继续培养72 h,逐日观察、详细记录每孔的CPE。同时设置正常细胞对照组、病毒对照组和空白对照组,每个浓度设8个重复,待病毒对照组CPE不再继续时,按“1.4.3”操作进行CCK8细胞活力检测,并计算该作用方式下的抗BVDV有效率和药物半数有效浓度(EC50)。
药物的抗病毒有效率(%)=[(试验加药组平均OD值-病毒对照组平均OD值)/(细胞对照组平均OD值-病毒对照组平均OD值)]×100%。
1.4.4.3 药物对BVDV的吸附阻断作用:细胞接种96孔板,待长成单层细胞后加药物稀释液,37 ℃培养4 h后,弃液,加入100·TCID50病毒液,100 μL·孔-1,吸附2 h弃去病毒液,加入细胞维持液继续培养,逐日观察CPE并记录病变孔数。待病毒对照组不再出现CPE时,进行细胞活力检测,计算该作用方式下的抗病毒有效率。
1.4.4.4 药物对BVDV复制阻断作用:细胞接种96孔板,待长成单层细胞后加入100·TCID50病毒液,每孔100 μL,吸附2 h后弃液,每孔加入100 μL药物稀释液,逐日观察并记录CPE,并测定有效抑制率。
1.4.5 试验数据处理 利用SPSS 22.0 软件对有效抑制率进行相关性分析,对抑制率高达50%的供试药物,利用GraphPad PrismTM软件分别计算药物半数中毒浓度(CC50)及药物半数有效浓度(EC50),按公式TI=CC50/EC50,计算相应的治疗指数(TI)。
2 结 果
2.1 药物对MDBK细胞最大安全浓度测定
试验加药组的细胞毒性表现为细胞的杀伤作用,且呈现剂量依赖关系;利巴韦林组则表现一定的抑制细胞增长效应。经测定诃子、矮紫堇、甘青乌头和利巴韦林的最大安全浓度分别为1 mg·mL-1、1 mg·mL-1、8 mg·mL-1和2 μg·mL-1;经软件分析后,药物半数中毒浓度分别为6.383 mg·mL-1、7.116 mg·mL-1、42.40 mg·mL-1和20 μg·mL-1,表明4种药物对MDBK细胞的毒性从大到小依次为利巴韦林、诃子、矮紫堇和甘青乌头。
2.2 药物对BVDV的直接杀伤作用
在药物和BVDV预先作用的给药方式下,各加药组的细胞病变程度较病毒对照组有所减轻。由表1可看出,4种药物对BVDV均表现出有一定的抑制作用,在安全浓度范围内,有效抑制率呈一定的量效关系。相比同种药物的其他浓度组,诃子、矮紫堇、甘青乌头和利巴韦林均在最大药物安全浓度时有较高的有效抑制率,分别是52.43%、72.86%、56.87%和51.06%;经软件分析,EC50分别为0.613 mg·mL-1、0.367 mg·mL-1、3.059 mg·mL-1和2 μg·mL-1,TI分别为10.41、19.39、13.86和10.00(表2),表明4种药物对BVDV均具有一定的直接灭活作用,其抑制作用效果较好的是矮紫堇,其次是甘青乌头、诃子和利巴韦林。
表1药物对BVDV直接杀伤作用的CPE及CCK8检测结果
Table1TheresultsofdirectlykillingeffectofdrugsonBVDVbyCPEandCCK8
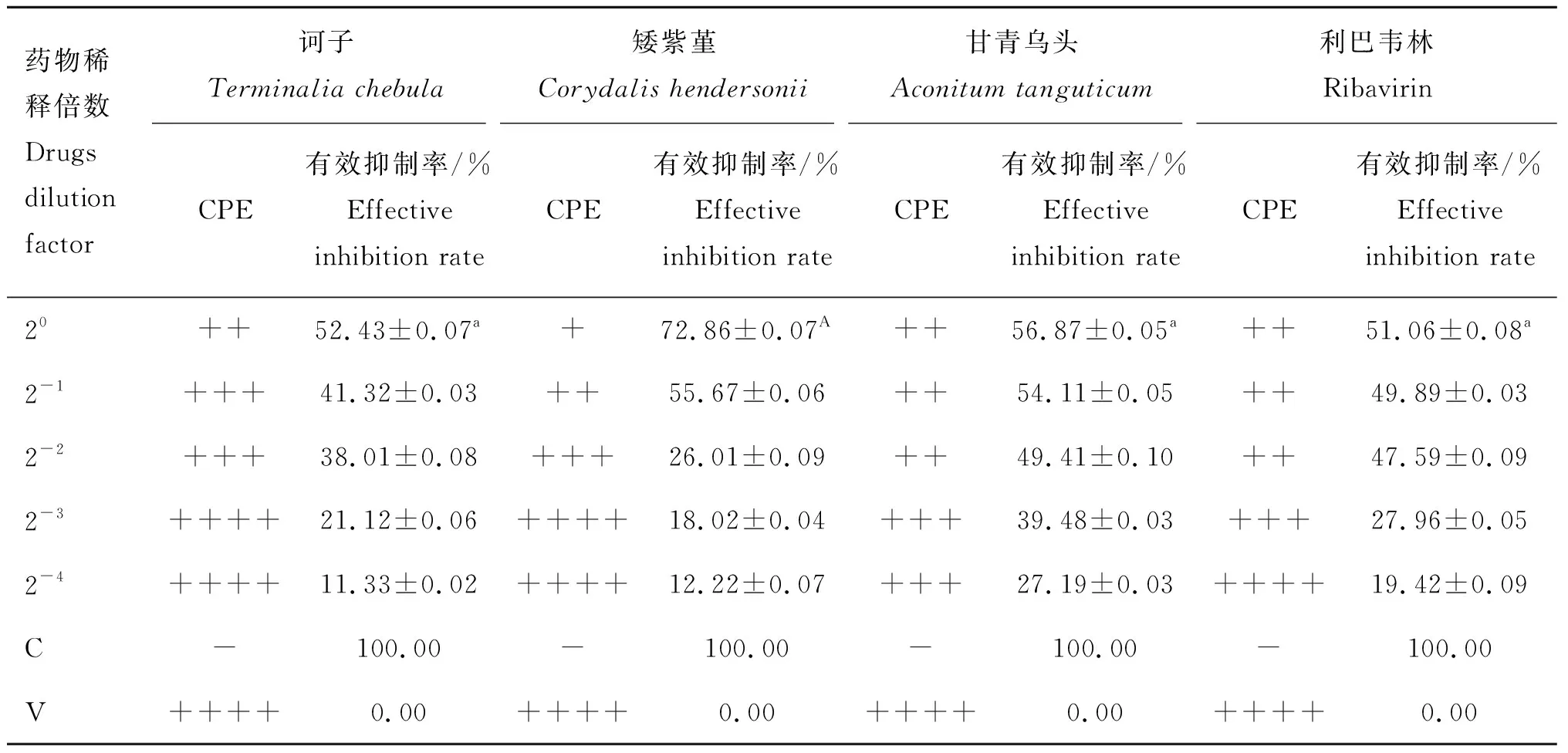
药物稀释倍数Drugs dilution factor诃子Terminalia chebula矮紫堇Corydalis hendersonii甘青乌头Aconitum tanguticum利巴韦林RibavirinCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rate20++52.43±0.07a+72.86±0.07A++56.87±0.05a++51.06±0.08a2-1+++41.32±0.03++55.67±0.06++54.11±0.05++49.89±0.032-2+++38.01±0.08+++26.01±0.09++49.41±0.10++47.59±0.092-3++++21.12±0.06++++18.02±0.04+++39.48±0.03+++27.96±0.052-4++++11.33±0.02++++12.22±0.07+++27.19±0.03++++19.42±0.09C-100.00-100.00-100.00-100.00V++++0.00++++0.00++++0.00++++0.00
表2药物对BVDV治疗指数的测定结果
Table2Theresultsoftreatmentindexofdrugs
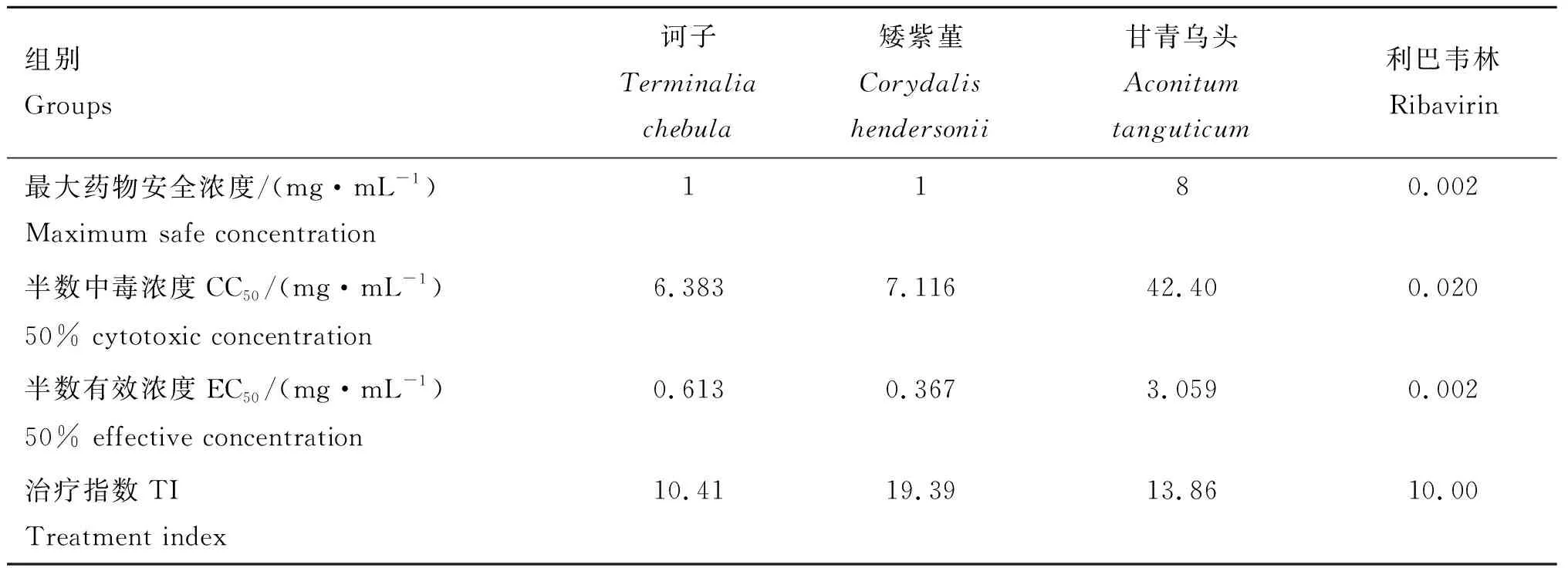
组别Groups诃子Terminalia chebula矮紫堇Corydalis hendersonii甘青乌头Aconitum tanguticum利巴韦林Ribavirin最大药物安全浓度/(mg·mL-1)Maximum safe concentration1180.002半数中毒浓度CC50/(mg·mL-1)50% cytotoxic concentration6.3837.11642.400.020半数有效浓度EC50/(mg·mL-1)50% effective concentration0.6130.3673.0590.002治疗指数TITreatment index10.4119.3913.8610.00
2.3 药物对BVDV的吸附阻断作用
药物对BVDV吸附阻断作用的CPE观察和细胞活性检测结果见表3。CPE观察结果显示:药物预先处理组与病毒对照组相比,细胞病变的程度均没有明显变化。细胞活性检测结果显示,4种药物对BVDV的有效抑制率均在20%以下,表明诃子、矮紫堇、甘青乌头和利巴韦林均不能阻止BVDV对MDBK细胞的吸附作用。
表3药物对BVDV吸附阻断作用的CPE及CCK8检测结果
Table3TheresultsofadsorptionblockingeffectofdrugsonBVDVbyCPEandCCK8
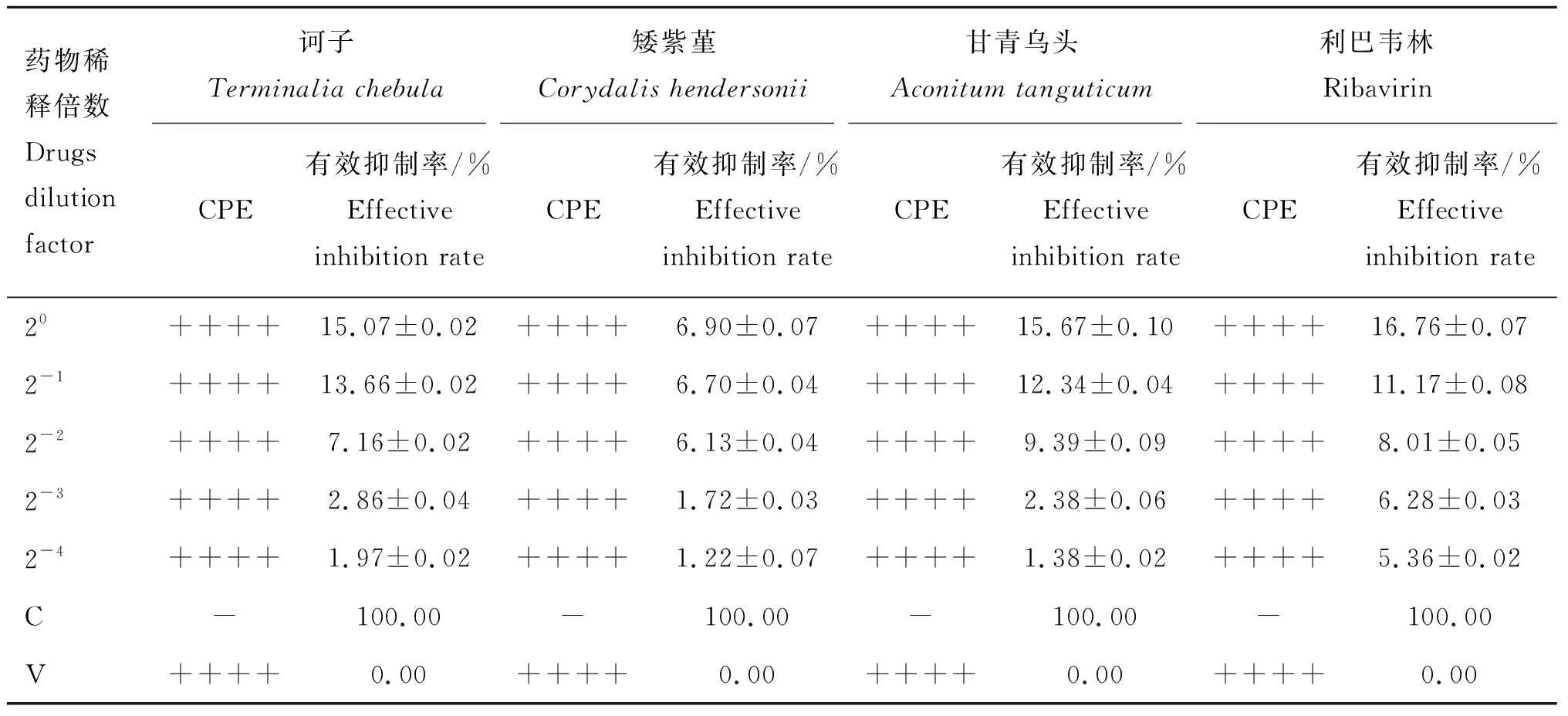
药物稀释倍数Drugs dilution factor诃子Terminalia chebula矮紫堇Corydalis hendersonii甘青乌头Aconitum tanguticum利巴韦林RibavirinCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rate20++++15.07±0.02++++6.90±0.07++++15.67±0.10++++16.76±0.072-1++++13.66±0.02++++6.70±0.04++++12.34±0.04++++11.17±0.082-2++++7.16±0.02++++6.13±0.04++++9.39±0.09++++8.01±0.052-3++++2.86±0.04++++1.72±0.03++++2.38±0.06++++6.28±0.032-4++++1.97±0.02++++1.22±0.07++++1.38±0.02++++5.36±0.02C-100.00-100.00-100.00-100.00V++++0.00++++0.00++++0.00++++0.00
2.4 药物对BVDV复制阻断作用
药物对BVDV复制阻断作用的CPE观察和细胞活性检测结果见表4。CPE观察结果显示:病毒预先处理组与病毒对照组相比,细胞病变的程度均没有明显变化。细胞活性检测结果显示,3种藏药对BVDV的有效抑制率均在15%以下,表明诃子、矮紫堇和甘青乌头均不能阻断BVDV在MDBK细胞中的复制过程。而利巴韦林在2 μg·mL-1浓度时与病毒对照组相比,细胞病变程度有所降低,但有效抑制率均小于30%,表明该作用方式下的利巴韦林对BVDV则有微弱的复制阻断作用。
表4药物对BVDV复制阻断作用的CPE及CCK8检测结果
Table4TheresultsofreplicationblockingeffectofdrugsonBVDVbyCPEandCCK8
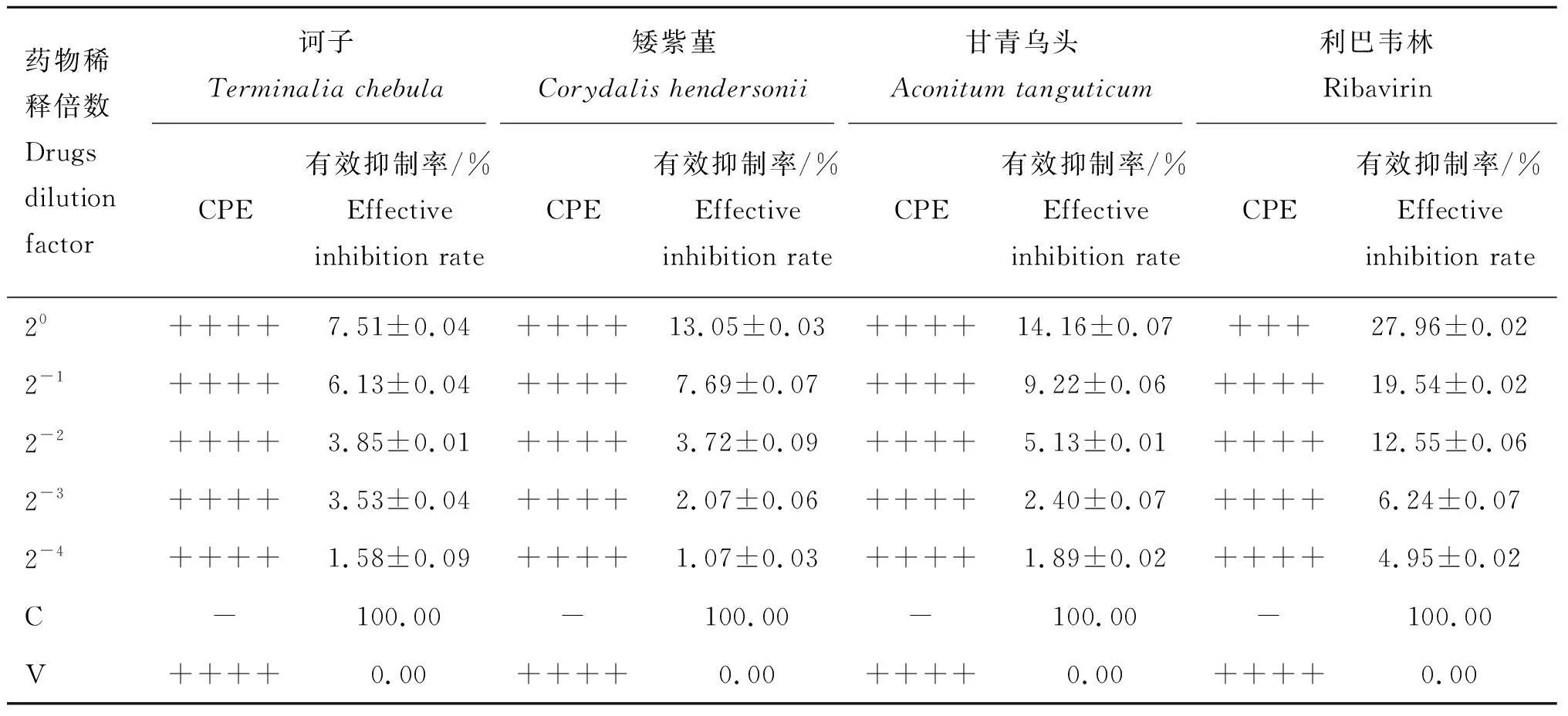
药物稀释倍数Drugs dilution factor诃子Terminalia chebula矮紫堇Corydalis hendersonii甘青乌头Aconitum tanguticum利巴韦林RibavirinCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rateCPE有效抑制率/%Effective inhibition rate20++++7.51±0.04++++13.05±0.03++++14.16±0.07+++27.96±0.022-1++++6.13±0.04++++7.69±0.07++++9.22±0.06++++19.54±0.022-2++++3.85±0.01++++3.72±0.09++++5.13±0.01++++12.55±0.062-3++++3.53±0.04++++2.07±0.06++++2.40±0.07++++6.24±0.072-4++++1.58±0.09++++1.07±0.03++++1.89±0.02++++4.95±0.02C-100.00-100.00-100.00-100.00V++++0.00++++0.00++++0.00++++0.00
3 讨 论
3.1目前,国内外研究抗病毒药物的治疗效果通常采用CPE、病毒蚀斑技术和MTT比色分析等方法[22-24]。CPE观察法比较直观,但存在一定的主观性、灵敏度低,无法进行统计学分析;MTT比色分析法采用染色法检测吸光度值的变化来判断细胞活性,可快速、灵敏地对药效进行定量分析[25]。而CCK-8试剂盒是一种MTT的升级替代品,比MTT更加稳定且对细胞无明显的毒性,等比线性范围更宽,试验结果更加稳定、灵敏[26]。故本研究采用CPE观察法和CCK8检测相结合的方法来进行细胞毒性试验和抗病毒药效学试验,更加客观地评价药物的抗病毒作用效果。
3.2我国的传统中医药有着很长的发展历史,在抗病毒研究领域中已取得很大进展。经研究发现,诃子的种子提取物对HIV-1、单纯疱疹病毒(HSV-1)、流感病毒、柯萨奇病毒B3、B5(CVB3、CVB5)等均具有一定抑制作用[19,27];甘青乌头的提取物可抑制HSV-2病毒复制周期的各个环节[28],其二萜生物碱在体外对H1N1有明显的抑制作用[29];紫堇属植物中分离得到生物碱成分也具有一定的抗病毒作用[30]。为深入探讨3种藏药的抗BVDV作用,本研究采用3种不同作用方式进行体外抗病毒药效学试验。结果表明,藏药诃子、矮紫堇、甘青乌头及利巴韦林在药物与病毒直接灭活作用的方式下均有较高的抑制率,分别为52.43%、72.86%、56.87%和51.06%,治疗指数TI分别为10.41、19.39、13.86和10.00,表明4种药物对BVDV均具有一定的直接杀伤作用,这与邱翔宇等[16]和郭志廷等[14]的研究报道基本相符;而在先加药后加病毒、先加病毒后加药两种作用方式下的有效抑制率均小于30%,表明4种药物对病毒的复制阻断作用和吸附阻断作用并不明显,这与郭志廷等[14]报道的结果大致相符,而与郝宝成等[15]和邱翔宇等[16]的研究结果存在一定差异,推测可能与药物的种类、试验的条件、病毒的宿主来源有关。
3.3利巴韦林又名病毒唑,为广谱抗病毒药。该药对许多DNA和RNA病毒有抑制作用,如流感病毒、呼吸道合胞病毒(RSV)、甲型肝炎病毒、疱疹病毒、乙型肝炎病毒等[31-32]。临床上通常用于治疗流行性腮腺炎、流感病毒引起的呼吸道感染以及联合聚乙二醇干扰素治疗丙型肝炎等[33]。本研究选择利巴韦林作为阳性对照药物,来进一步评价供试药物的抗病毒抑制效果。通过比较药物抗病毒有效抑制率和治疗指数,3种藏药中矮紫堇的抗病毒有效率要显著高于利巴韦林,而诃子和甘青乌头则与利巴韦林相接近,表明藏药矮紫堇的直接杀灭病毒作用要好于诃子、甘青乌头和利巴韦林。
4 结 论
利用细胞培养技术、利巴韦林做阳性对照药物首次探讨了3种藏药的体外抗BVDV作用。结果表明,3种藏药对BVDV均有一定的抑制作用,且对病毒的直接杀灭作用均好于吸附阻断作用和复制阻断作用。其中,矮紫堇抑制效果最佳,优于诃子、甘青乌头及利巴韦林,未来将对其抗病毒作用机制做进一步研究。

