幽门螺杆菌诱导胃癌细胞上皮-间充质转化的研究*
周法庭,朱红玲,朱 华,王 毅,许 俊,杨振华△
(1.三峡大学第一临床医学院,湖北宜昌 443003;2.宜昌市中心人民医院急诊科,湖北宜昌 443003;3.三峡大学消化疾病研究所,湖北宜昌 443003)
胃癌是临床最常见的恶性肿瘤之一,在全球恶性肿瘤排行中胃癌的发病率位居第5位,病死率位居第3[1]。近年来由于腌制食品摄入减少和胃镜在临床广泛应用,胃癌的病死率有所下降,但是我国仍然是胃癌高发国家[2]。2012年我国胃癌死亡总人数达29.8万例,男性病死率仅次于肺癌和肝癌,女性病死率仅次于肺癌[3-4]。胃癌细胞早期发生转移和浸润是导致胃癌患者死亡和治疗失败的根本原因,大量研究证实上皮-间充质转化(epithelial-mesenchy transition,EMT)是调控恶性肿瘤细胞发生转移的主要机制[5]。
EMT是机体常见的生物学变化,它参与了组织器官分化、伤口愈合、器官纤维化和肿瘤细胞转移等多种病理生理学过程[6]。肿瘤细胞发生EMT是指上皮来源的肿瘤细胞受多种因素刺激后,丧失上皮特征,获得间充质表型的过程。在这一过程中,肿瘤细胞的许多生物学特征发生改变,包括细胞形态转变成间充质状,骨架发生重塑、细胞连接破坏、极性消失、迁移和侵袭能力显著增强[7]。在上述变化中,E-钙黏蛋白(E-cadherin)表达的降低被视为肿瘤细胞发生EMT的标志性改变。目前,研究发现趋化因子、细胞外基质、转录因子和小分子RNA等均可调控肿瘤细胞发生EMT,如转化生长因子-β(TGF-β)、基质金属蛋白酶-9(MMP-9)、Snail和miR-203等[8]。而在上述化学因子中,有关TGF-β的研究最为透彻,常被作为阳性对照。当TGF-β和细胞表面的受体结合,形成TβRⅡ-TGFβ-TβRI复合物,可激活Smad 2/3-Smad4、Ras-MEK-ERK和TRAF-TAK1-JNK等多条信号轴来调控肿瘤细胞的EMT过程。
在体内,胃癌细胞的转移除了受上述化学因子调控外,幽门螺杆菌(Helicobacter pylori,Hp)也是胃癌细胞最主要的生物刺激。Hp可生成尿素酶、空泡毒素、细胞毒素相关蛋白和黏附素等多种致病因子,持续刺激胃黏膜上皮细胞,引起胃炎、胃溃疡、胃癌和胃黏膜相关淋巴瘤[9]。对于Hp诱发胃癌已成为毋庸置疑的事实,但是能否促使胃癌细胞发生EMT却鲜有报道[10]。本研究拟分析Hp刺激后胃癌细胞发生EMT的情况,为胃癌转移的治疗提供新方向。
1 材料与方法
1.1材料 人胃黏膜上皮细胞株GES-1和人胃癌细胞株SGC-7901均购自中国科学院生物化学与细胞生物学研究所,两种细胞株的鉴定和培养在本研究前期工作时顺利完成。幽门螺杆菌 SS1(Sydney Strain 1,SS1)菌株购自Novagen公司。胰蛋白酶、RIMP 1640培养基和DAPI核酸性染料均购自Invitrogen公司;胎牛血清购自复蒙公司;蛋白提取试剂盒及ECL 发光试剂盒购自江苏凯吉生物公司;BCA 试剂盒购自碧云天公司。E-cadherin (H-108) 、Snail 1(H-130)、MMP-9(6-6B)兔多克隆抗体和N-cadherin(H-4)、Vimentin (V-9)鼠单克隆抗体购自Santa Cruz公司,β-actin鼠单克隆抗体和HRP标记的二抗购自北京中杉金桥。
1.2实验方法
1.2.1细胞培养 将GES-1和SGC-7901细胞分别接种在RIMP 1640完全培养基(10%胎牛血清,100 mg/mL的链霉素、1×104U/L青霉素)常规培养(37 ℃、5% CO2),待细胞融合度90%左右,用2.5%的胰蛋白酶处理至细胞形态变圆后终止消化,传代培养,取对数生长期细胞进行实验研究。
1.2.2幽门螺杆菌培养 将幽门螺杆菌SS1菌株按1.0%的体积比接种至布氏肉汤液体培养基(含5%的胎牛血清)中,置于微需氧(37 ℃、5% CO2和85% N2)环境中培养,根据Hp菌落数量,绘制生长曲线。参考HAN等[11]的实验方法,取对数期的SS1菌株进行实验,离心收集并重悬后,分别加入GES-1细胞或SGC-7901细胞培养基中。
1.2.3Transwell小室检测胃癌细胞纵向迁移 待SGC-7901细胞或GES-1细胞融合度达到90%时,以胰酶消化后,进行计数和稀释,将悬液中细胞数目调整为2×105个/mL。分别取200 μL的SGC-7901细胞或GES-1细胞悬液接种于Transwell 上室,设置空白对照组、阳性对照组(TGF-β)和实验组(幽门螺杆菌SS1菌株),Transwell小室放置于24 孔板的小孔中。然后取600 μL 不含血清的RIMP 1640 培养基加入Transwell下室,阳性对照组和实验组分别加入TGF-β(终浓度5 ng/mL)和幽门螺杆菌SS1菌株(最终MOI为500),空白对照组加入等体积的不含血清的RIMP 1640培养基,放回CO2孵箱中,培养2 h[12]。取出并弃去原有培养基,分别经PBS 洗涤、多聚甲醛固定后,用0.1% 结晶紫染色20 min后。倒置显微镜下观察细胞迁移情况,随机选取5条直径,沿每条直径随机取5 个视野拍照,统计穿过Transwell小室的细胞数。
1.2.4Western blot检测EMT相关蛋白的表达 按照1.2.1传代和培养SGC-7901细胞或GES-1细胞,两种细胞均设置空白对照组、阳性对照组和实验组,阳性对照组和实验组分别加入TGF-β和幽门螺杆菌SS1菌株,终浓度分别为5 ng/mL和500 MOI。放入CO2孵箱中培养,2 h后以RIPA裂解液收集总蛋白,经BCA法定量、变性、SDS-聚丙烯酰胺凝胶电泳、转膜和封闭后,4 ℃过夜孵育相应一抗(1∶200)。再经TBST洗涤、孵育二抗(1∶5 000)、洗涤后,采用增强化学发光法( enhanced chemiluminescence,ECL) 在凝胶成像仪( ChemiDocTMXRS & Image LabTM,美国Bio-Rad 公司) 中检测蛋白的表达变化。
1.2.5免疫荧光法检测β-catenin的分布 按照1.2.3处理SGC-7901细胞或GES-1细胞,培养2 h后,经PBS液洗涤、4%多聚甲醛固定和1%BSA封闭后,加入β-catenin一抗(1∶200)过夜孵育。次日PBS洗涤后,37 ℃避光孵育荧光二抗(1∶100),1 h后加入DAPI(1∶400),37 ℃避光孵育15 min。PBS洗涤后甘油封片,立即在激光共聚焦荧光显微镜(Leica TCS SP5,Germany)下观察β-catenin的分布。

2 结 果
2.1幽门螺杆菌对胃癌细胞迁移的影响 在空白对照组中,穿过Transwell小室的GES-1细胞为(116.4±23.5)个。而实验组穿过Transwell小室的GES-1细胞数目增至(170.2±36.7)个,二者比较,差异具有统计学意义(P<0.05),见图1A。阳性对照组穿过Transwell小室的GES-1细胞为(241.5±47.3)个,明显多于实验组。对于胃癌细胞SGC-7901出现类似的变化趋势,TGF-β刺激后SGC-7901细胞迁移数目增加到(384.6±85.2)个。而幽门螺杆菌刺激SGC-7901细胞后,迁移数目由(231.9±51.0)个上升到(318.5±68.1)个,两组比较,差异具有统计学意义(P<0.05),见图1B、C。
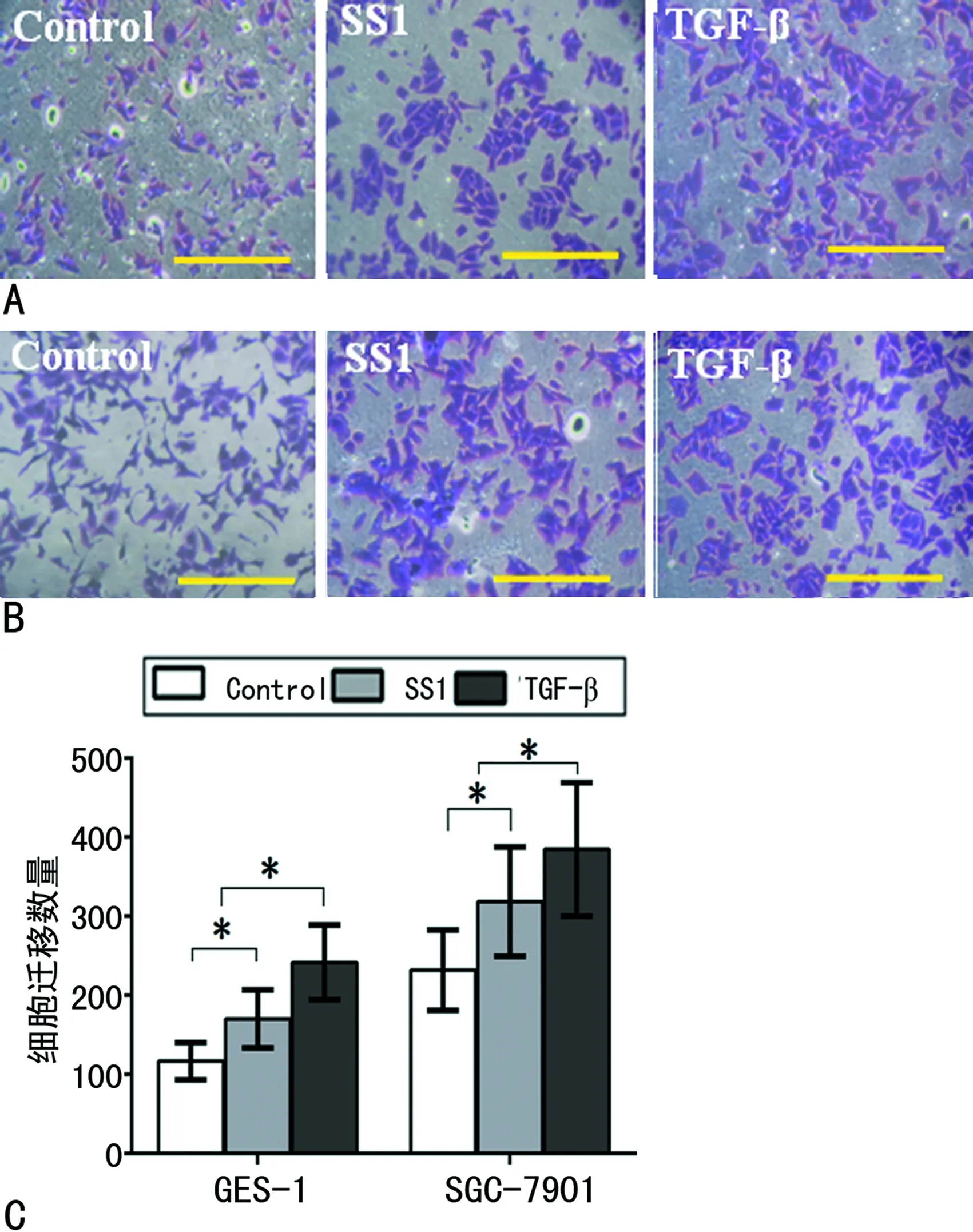
A:GES-1细胞;B:SGC-7901细胞(标尺50 μm);C:细胞平均迁移数量
图1幽门螺杆菌对细胞迁移的影响
2.2幽门螺杆菌对胃癌细胞E-cadherin和N-cadherin表达的影响 由图2可知,幽门螺杆菌SS1菌株刺激GES-1细胞和SGC-7901细胞后,E-cadherin表达量均明显降低。在GES-1细胞中,实验组(SS1)E-cadherin的相对表达量是空白对照组的(0.732±0.063)倍,二者比较,差异具有统计学意义(P<0.05),见图2B;而与阳性对照组比较,差异无统计学意义(P>0.05)。SGC-7901细胞E-cadherin变化趋势与GES-1细胞相似,幽门螺杆菌SS1菌株作用后,E-cadherin的相对表达量下降至0.741±0.135,而阳性对照组的E-cadherin相对表达量为0.622±0.091,两组比较,差异具有统计学意义(P<0.05)。与E-cadherin变化趋势不同,幽门螺杆菌SS1菌株刺激GES-1细胞后N-cadherin的表达量无明显变化(P>0.05),而刺激SGC-7901细胞后,N-cadherin相对表达量上升至1.32±0.165,高于空白对照组。而阳性对照组为1.28±0.057,与实验组比较,差异无统计学意义(P>0.05)。

A:Western blot检测E-cadherin和N-cadherin的表达水平;B:E-cadherin的相对表达量;C:N-cadherin的相对表达量
图2幽门螺杆菌对E-cadherin和N-cadherin表达影响
2.3幽门螺杆菌对胃癌细胞间充质蛋白表达的影响 以幽门螺杆菌作用于GES-1细胞后,Twist的相对表达量显著增加,是空白对照组的(1.94±0.091)倍,二者比较,差异具有统计学意义(P<0.05),而阳性对照组相对表达量为2.15±0.15,与实验组比较,差异无统计学意义(P>0.05)。在SGC-7901细胞的Twist的变化和GES-1细胞相似,幽门螺杆菌作用SGC-7901细胞后,Twist的表达水平显著增加,但与实验组比较,差异无统计学意义(P>0.05)。与Twist变化趋势不同,幽门螺杆菌和TGF-β作用于两种细胞后,GES-1细胞Vimentin相对表达量无明显变化,而SGC-7901细胞中实验组和阳性对照组显著增加,分别为空白对照组的(1.48±0.86)倍和(1.42±0.91)倍,两组比较,差异无统计学意义(P>0.05)。GES-1细胞接受幽门螺杆菌刺激后,MMP-9的表达量均高于空白对照组和阳性对照组。而SGC-7901细胞中实验组和阳性对照组MMP-9的表达水平均出现明显上升,且二者比较,差异无统计学院意义(P>0.05),见图3。
2.4幽门螺杆菌对胃癌细胞β-catenin分布的影响 经幽门螺杆菌SS1菌株刺激后,GES-1细胞和SGC-7901细胞膜上的β-catenin显著减少(黄色箭头),而细胞核中的β-catenin明显增加(红色箭头),且分布变化趋势与对应的阳性对照组相似,见图4。
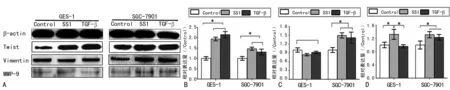
A:Western blot检测间充质蛋白的表达水平;B:Twist相对表达量;C:Vimentin的相对表达量;D:MMP-9的相对表达量
图3幽门螺杆菌对间充质蛋白的表达影响

A:GES-1细胞;B:SGC-7901细胞(标尺5 μm)
图4幽门螺杆菌对胃癌细胞β-catenin分布的影响
3 讨 论
幽门螺杆菌是一类黏附于胃幽门的微需氧型革兰阴性菌,与胃癌和胃黏膜相关淋巴瘤的发生发展密切相关,已被WHO视为第一类生物致癌因子[13]。国内外关于于幽门螺杆菌的研究主要集中于胃炎和胃癌的致病机制,而忽视了它对胃癌细胞细胞生物学行为的作用。幽门螺杆菌的致病因子有尿素酶、空泡毒素、细胞毒素相关蛋白和黏附素,此外它还可刺激机体释放环氧化酶(COX)、白细胞介素-1(IL-1)和肿瘤坏死因子-α(TNF-α)等炎症因子。其中,细胞毒素相关蛋白Cag是幽门螺杆菌最重要致病因子。据CagA可将幽门螺杆菌分为CagA+和CagA-两大类,阳性菌株的毒力远超过阴性菌株。Cag和上述致病因子不仅能诱导胃黏膜细胞发生癌变,而且能调控胃上皮细胞的增殖和凋亡[14]。幽门螺杆菌能刺激G细胞分泌胃泌素,并且与其受体CCK-β 结合,促进上皮细胞增殖。研究发现幽门螺杆菌可通过双重方式调控上皮细胞凋亡。一方面,幽门螺杆菌与宿主上皮细胞结合后,释放前列腺素,激活PPARγ,抑制细胞凋亡[15]。而另一方面,幽门螺杆菌还会分泌尿素酶和空泡毒素,活化Caspase-3或FAS,促进凋亡[16]。
近年来不少学者证实幽门螺杆菌可影响胃癌细胞的转移,诱导胃癌细胞发生上皮-间充质转化。 CagA能诱导胃上皮细胞酪氨酸磷酸化和骨架重排,诱导机体释放炎症因子,进而促进细胞迁移。O′CONNOR等[17]发现幽门螺杆菌感染的患者血清可溶性E-cadherin的水平明显低于健康人群,而感染CagA+菌株的患者可溶性E-cadherin明显低于CagA-菌株患者。与O′CONNOR的研究相似,YIN等[18]分别以Hp.60190(CagA+)和Hp.Tx30a(CagA-)菌株刺激AGS细胞,发现前者刺激后AGS细胞的Snail 1、Slug和Vimentin的RNA水平明显高于后者。幽门螺杆菌还可分泌TNF-α调节蛋白(TNF-α induced proteins,TIPα),活化MEK/ERK信号途径,抑制MKN-1细胞Vimentin的表达,促进细胞形态发生改变和丝状伪足的形成,诱导胃癌细胞发生EMT[19]。关于幽门螺杆菌诱导胃癌细胞发生EMT机制仍不清楚,最近有研究发现CagA的羧基末端能与SHP2 和 PAR1/MARK2结合,使谷氨酸-脯氨酸-异亮氨酸-酪氨酸-丙氨酸(EPIYA)模体磷酸化,导致细胞表型转换。但LEE等[20]发现幽门螺杆菌可抑制GSK-3表达,进而上调Snail和Snail和β-catenin表达,诱导胃癌细胞发生EMT。Hp.SS1菌株是由澳大利亚LEE团队驯化而来,是CagA+和VacA+菌株,具有很强的黏附能力[21]。 本研究以Hp.SS1菌株分别刺激胃癌和胃上皮细胞,分析胃癌细胞迁移能力及EMT相关标志物的变化。结果发现Hp.SS1菌株使胃癌细胞的β-catenin向核内易位,抑制E-cadherin的表达,促进N-cadherin、Twist和MMP-9的表达,促进胃癌细胞的迁移。本研究在YIN等[18]研究基础上,通过体外模拟幽门螺杆菌与胃癌细胞的相互作用,并与趋化因子TGF-β相比较,证实了幽门螺杆菌可诱导胃癌细胞发生EMT。最近CHOI等[22]发现早期为患者行幽门螺杆菌根除治疗,患者的Twist、Snail、Slug 和 Vimentin的mRNA水平下降,而E-cadherin的mRNA水平上升。由此可知,对于合并幽门螺杆菌感染的胃癌患者行幽门螺杆菌根除治疗不仅能改善患者症状,还可能会抑制胃癌细胞转移。

