血清铁蛋白与2型糖尿病周围神经病变的相关性分析
喻昆林,范佳双,刘书言
(昆明医科大学第二附属医院 内分泌科,云南 昆明 650101)
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)是糖尿病常见的慢性并发症之一,严重影响患者的生活质量。铁是人体必需的微量元素之一,血清铁蛋白(serum ferritin, SF)是其主要的储存形式,其对体内铁的转运、储存及铁代谢调节起着重要的作用。研究显示,铁代谢异常与糖尿病密切相关,铁超负荷使胰岛细胞分泌功能受损和葡萄糖耐量异常、导致血糖升高[1]。血清SF是诊断缺铁性贫血、机体铁储备及铁负荷过多的有效指标。研究证实,糖尿病的发生随血清SF水平的升高而增加,说明铁负荷过多是2型糖尿病(type 2 diabetes mellitus, T2DM)的危险因素[2]。血清SF与糖尿病慢性并发症的关系越来越受到重视,本研究旨在探讨血清SF水平对DPN患者发病的影响,为临床研究提供参考依据。
1 资料与方法
1.1 一般资料
选取2016年1月-2016年12月该院T2DM患者150例,将其分为糖尿病无周围神经病变组(T2DM组)66例、糖尿病周围神经病变组(DPN组)84例。T2DM组:男性36例,女性30例;平均年龄(60.48±12.29)岁。DPN组:男性46例,女性38例,平均年龄(58.85±11.24)岁。选取该院门诊健康体检者30例作为对照组(NC组):男性14例,女性16例;平均(60.63±8.31)岁。糖尿病符合世界卫生组织(world health organization, WHO)1999年诊断标准。DPN符合T2DM WHO DPN的诊断标准:有麻木、蚁行感、针刺感及烧灼感或伴有“手套、袜套样”的四肢肢端感觉障碍;肌电图检查有运动和感觉神经传导障碍,运动神经传导速度<45 m/s或感觉神经传导<40 m/s。所有受试者排除外各种急慢性感染、恶性肿瘤、心肝肾功能不全、贫血、铁剂治疗及引起周围神经病变的其他原因(如药物中毒、化学物质损害及营养障碍等)。
1.2 方法
所有受试者过夜禁食8 h抽取肘正中静脉血5 ml,静置1 h离心后取血清,采用美国贝克曼-库尔特公司AU5800全自动生化分析仪测定空腹血糖(fasting blood sugar, FPG)、餐后2 h血糖(2 hours blood sugar, 2 hPG)、 糖 化 血 红 蛋 白(hemoglobin A1c,HbA1c)、总胆固醇(total cholesterol, TC)、三酰甘油(triglyceride, TG)、 高 密 度 脂 蛋 白(high density lipoprotein cholesterol, HDL)、低高密度脂蛋白(low density lipoprotein cholesterol, LDL)及同型半胱胺酸(homocysteine, Hcy)。采用郑州安图生物工程股份有限公司AutoLumo A2000化学发光检测仪测定血清SF、空腹胰岛素(fasting insulin, Fins)。稳态模型评价胰岛素抵抗指数(HOMA-IR)、胰岛β细胞分泌指数(HOMA-IS)。HOMA-IR=FPG×Fins/22.5,HOMAIS=20×Fins/(FPG-3.5)。记录所有受试者的临床体征[包括年龄、病程、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure, DBP)]。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,方差齐性检验后,两两比较用LSD-t检验;相关分析采用Spearman法,影响因素的分析采用多因素Logistic回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 3组一般临床资料及血清SF比较
3组性别、年龄比较,差异无统计学意义(P>0.05)。3组 SBP比较,差异无统计学意义(P>0.05);3组DBP比较,差异有统计学意义(P<0.05)。3组 FPG、2 hPG、HbA1c、TC、TG、LDL、Fins及Hcy比较,差异有统计学意义(P<0.05);随着DPN发生,DPN组与T2DM组FPG、2h PG、HbA1c、TG、FINS及Hcy比较,差异有统计学意义(P<0.05)。3组HOMA-IR、HOMA-IS比较,差异有统计学意义(P<0.05);T2DM组与 DPN组HOMA-IR、HOMA-IS比较,差异有统计学意义(P<0.05);HOMA-IR逐渐增高,HOMA-IS逐渐降低。3组血清SF水平比较,差异有统计学意义(P<0.05);DPN组血清SF水平>T2DM组>NC组。3组HDL比较,差异无统计学意义(P>0.05)。T2DM组与DPN组病程、DBP、TC及LDL比较,差异无统计学意义(P>0.05)。见表1。
2.2 血清SF与其他因素的相关性分析
血清SF与HbA1c、HOMA-IR及Hcy呈正相关(rs=26.600、14.055和 9.513,P=0.000、0.000和 0.043);与HOMA-IS呈负相关(rs=-0.895,P=0.004);与年龄、病程、SBP、DBP、TC、TG、HDL、LDL、FPG、2 hPG及Fins无关。
2.3 DPN相关因素的Logistic回归分析
以是否合并周围神经病变为因变量,以SF、Hcy、SBP、DBP、FPG、2 hPG、HbA1c、TC、TG、HDL、LDL、Fins、HOMA-IR、HOMA-IS、 年 龄 及病程为自变量进行多因素Logistic回归分析;以0.05为引入水准,0.10为剔除水准,结果显示SF、Hcy、2 hPG、TG、Fins、HOMA-IR及 HOMA-IS是 影 响DPN的危险因素。见表2。
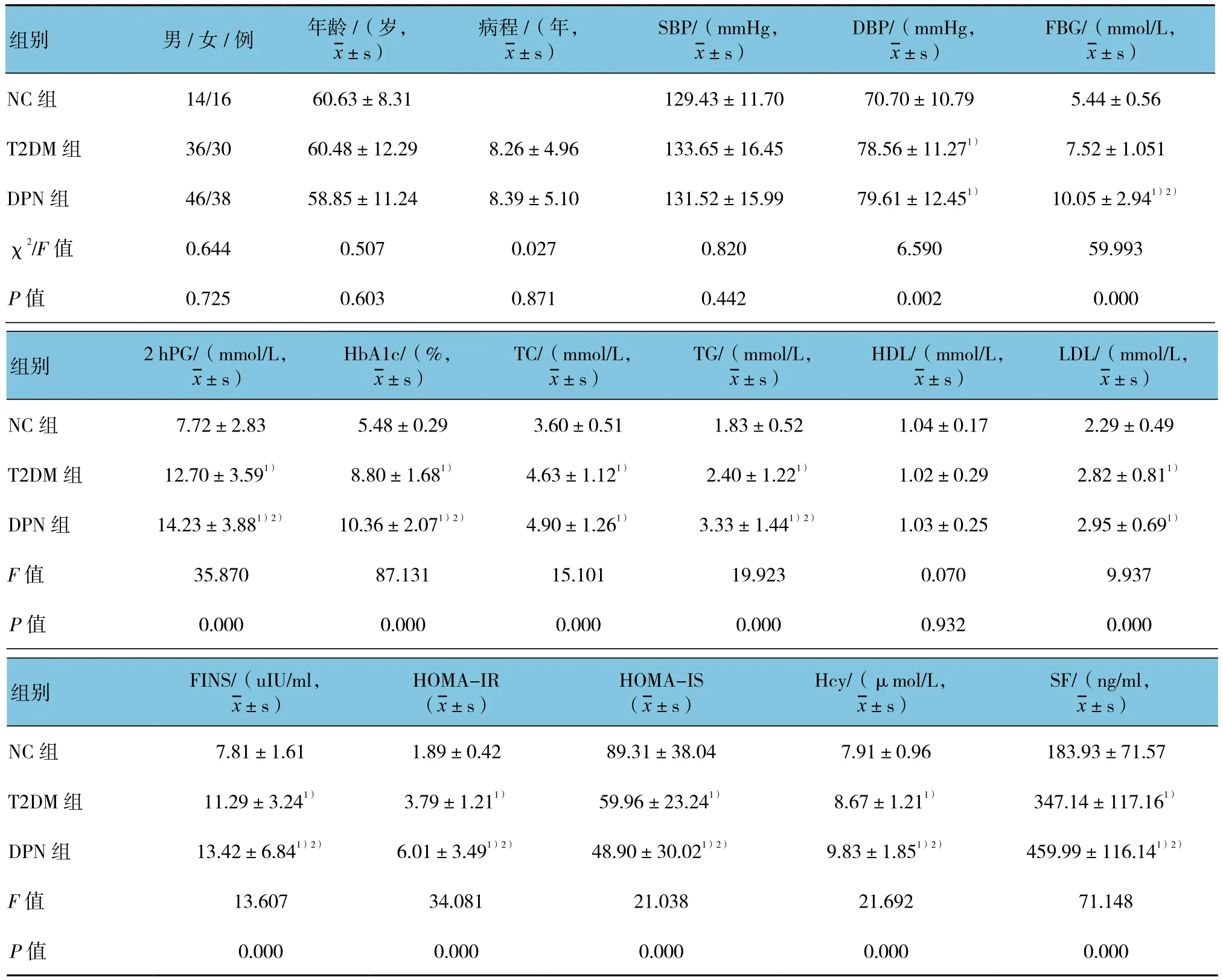
表1 3组一般临床资料及血清SF比较
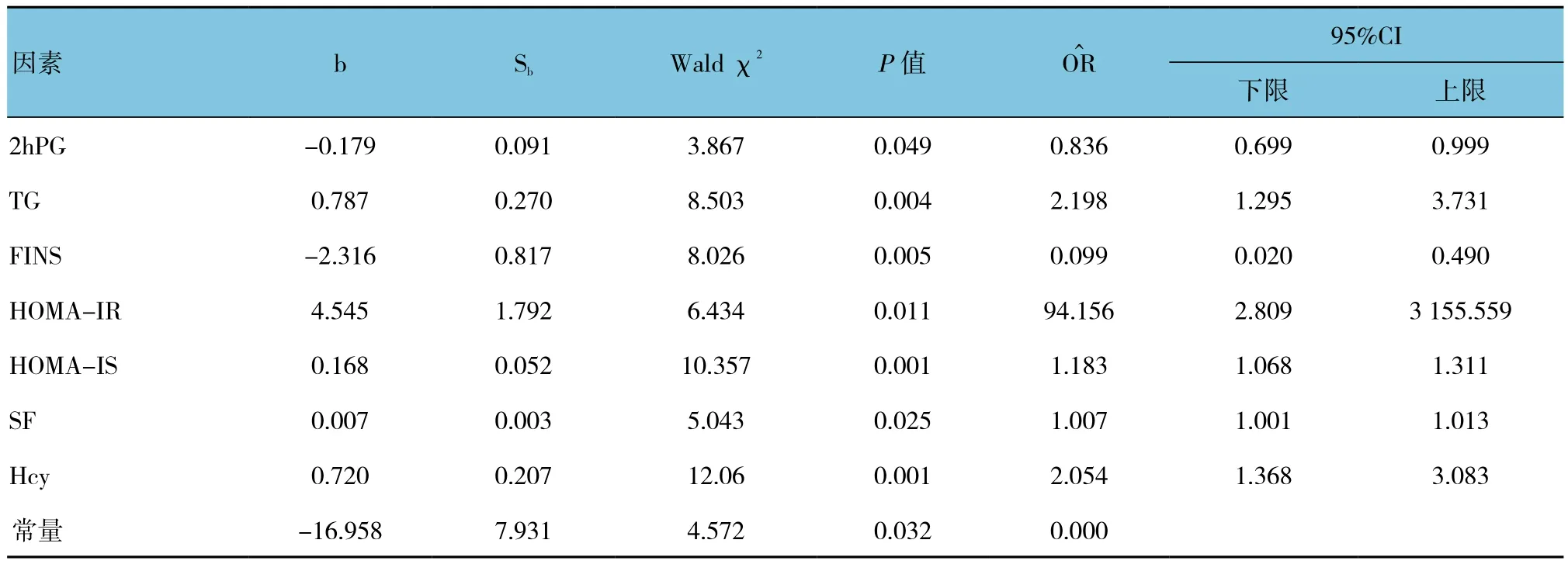
表2 DPN相关因素的Logistic回归分析
3 讨论
T2DM是以胰岛B细胞功能缺陷合并胰岛素抵抗的一类代谢性疾病,长期的高糖毒性导致各种慢性并发症。DPN是糖尿病常见的慢性并发症之一,严重影响患者的生活质量。铁是体内含量最为丰富的微量元素,铁蛋白是一种由肝脏合成的糖蛋白,是铁储存的主要形式。当体内铁含量增加时,血清SF可将铁摄取并储存,避免细胞内高浓度游离铁对细胞的毒性作用。多项研究证实,糖尿病患者存在血清铁超负荷,导致血清铁蛋白增高[3-4]。铁超负荷所致的遗传性铁色素沉着大鼠动物模型显示胰岛B细胞的凋亡可引起胰岛素分泌功能降低、糖耐量异常和糖尿病[5]。铁超负荷使得过多的铁沉积于肝脏及胰腺,与胰岛素抵抗、血糖、血脂代谢紊乱、炎症反应、氧化应激及动脉粥样硬化密切相关[6]。国内学者研究发现,T2DM患者血清SF高于正常人[7-8],血清SF水平升高可影响胰岛素的合成和分泌,减弱胰岛素对肝葡萄糖的抑制作用及周围组织对游离脂肪酸的代谢,加重血糖、血脂代谢紊乱,由此说明血清SF水平的升高也是T2DM的危险因素,T2DM及慢性并发症的发生与铁超负荷有关。
目前,铁超负荷与胰岛素抵抗作用的确切机制尚不清楚,流行病学研究显示,血清SF升高与肝脏炎症程度和肝功能异常有关[9]。血清SF水平升高导致的胰岛素抵抗主要由肝脏介导;其次是引起胰岛B细胞功能的衰竭[10],其可能的机制为肝脏铁沉积过多、肝脏功能受损,对胰岛素的灭活及清除作用减弱、导致高胰岛素血症。铁超负荷可干扰胰岛素对肝脏糖异生的抑制作用,加重肝脏的胰岛素抵抗。胰岛素水平异常可促进肝脏中过量铁离子的积累,导致血清铁蛋白合成增加。研究发现,HOMA-IR与正中神经、尺神经的运动传导速度呈负相关[11]。DPN越重,胰岛素抵抗越明显、胰岛细胞功能越差。DPN与胰岛素抵抗关系密切,因此血清SF升高所致的胰岛素抵抗在糖尿病及其并发症的发生中起着关键性作用。
DPN的发病机制尚未完全清楚,与长期高糖毒性及微循环障碍、代谢异常、神经营养因子缺乏、过量氧化自由基产生及自身免疫紊乱等因素有关。DPN表现为神经轴索病变及脱髓鞘,随病程发展导致临床神经损伤的典型症状,表现为四肢肢端感觉的异常及神经传导速度的减弱。血清SF升高与糖尿病发病呈正相关[12]。糖代谢紊乱致神经细胞内葡萄糖、山梨醇糖及果糖浓度升高,引起神经细胞内渗透压升高、细胞肿胀变性,导致神经脱髓鞘、影响神经传导速度[13]。铁是生物体内重要的脂质过氧化物反应促进剂,可启动和催化Haber-Weiss反应,产生自由基导致机体组织细胞损伤[14]。铁促进氧化应激是神经细胞损伤的重要病理机制[15],铁也能促进脂质氧化与动脉粥样硬化。脂质氧化与动脉粥样硬化加剧糖尿病周围神经兹氧血管基底膜增厚、管腔狭窄及血管阻力增加,造成神经低灌注及神经内膜缺血缺氧、导致神经变性坏死[16]。去铁胺治疗可恢复糖尿病大鼠运动和感觉神经传导速度。Hcy是一种反应性微血管损伤性氨基酸,可通过氧化应激反应、一氧化氮途径及动脉粥样硬化对微血管的内皮细胞造成损伤,加重神经病变。陈德鹏研究显示,Hcy与胰岛素水平负相关,与神经传导异常相关[17]。当胰岛素减弱或缺乏时,Hcy前体物质蛋氨酸和半胱氨酸的生成和结合减少,导致血浆Hcy清除率降低、血浆Hcy水平升高。血清SF及Hcy与氧化应激密切相关,高血糖、高血清SF诱导下的氧化应激形成大量的脂质过氧化物,对神经细胞产生毒性、加剧神经组织炎症反应,使神经组织结构和功能破坏、再生修复障碍,导致DPN发生、发展[18]。本研究局限在于此为回顾性横断面研究,样本量相对有限、观察指标及结果可能受到混杂因素影响。但通过此前期研究,为以后大样本前瞻性研究提供有效的参考依据。
综上所述,糖尿病患者存在血清铁超负荷,铁超负荷所致的血清铁蛋白升高与糖尿病的血糖、血脂代谢紊乱、胰岛素抵抗、动脉硬化及神经病变的发生、发展有一定的相关性,但其作用的确切机制还有待于进一步的研究。

