门诊儿科常用药品说明书调查与分析Δ
史香芬,刘学辉,胡幼红,丁 娟,孙志勇
(郑州大学第一附属医院药学部,河南 郑州 450052)
随着我国医疗卫生事业的不断发展,儿童健康和用药水平逐步提高,儿童用药安全问题越来越受到关注。儿童处于生长发育期,与成人相比,其疾病种类、用药特点等均存在诸多不同之处,客观上决定了儿童用药有着不同于成人的特殊要求[1]。郑州大学第一附属医院(以下简称“我院”)为三级甲等综合性医院,儿科门诊患者多、病情复杂,如何保证儿童安全、有效地使用药物是首要问题。药品说明书是医师、药师和患者用药时的指南,也是有关部门鉴定医疗责任的法律依据[2-4]。现对我院儿科门诊处方涉及的药品说明书内容进行整理分析,为儿童用药提供安全保障。
1 资料与方法
随机抽取2017年10月我院儿科门诊处方1 000张,对处方中涉及药品的药品说明书“适应症”“用法用量”“儿童用药”“不良反应”“禁忌”和“注意事项”等信息进行统计分析。
2 结果
1 000张门诊儿科处方共涉及148个药品品规,其作用类别分布见表1。经统计,148个药品中,儿童专用药品[5]有32个(占21.6%),其作用类别分布见表2。32个儿童专用药品中,口服剂型25个(占78.1%),以咀嚼片、颗粒剂、干混悬剂、溶液剂和滴剂为主;注射剂4个(占12.5%),为生长激素和凝血因子类药物;外用剂型3个(占9.4%),为吸入剂、气雾剂等。药品说明书各项下儿童用药信息标注情况见表3。129个药品的说明书标准了“儿童用药”项,其内容表述明确的有31个药品(占24.0%),尚不明确的有49个药品(占38.0%),表述模糊的有35个药品(占27.1%),不推荐儿童使用的有14个药品(占10.9%)。80个药品的说明书标注了儿童“用法用量”项,其中,按照年龄计算的有24个(占30.0%),多为国产口服剂型;按体质量计算的有26个(占32.5%),注射剂中抗菌药物居多,口服剂型多为进口药品;同时按年龄和体质量计算的有6个(占7.5%),均为进口的口服剂型;按体表面积计算的有2个(占2.5%);未标注年龄和计算方法的有22个(占27.5%),仅标注“儿童”“小儿”等。
表1148个药品的作用类别分布
Tab1Distributionofpharmacologicalactiontypesin148drugs
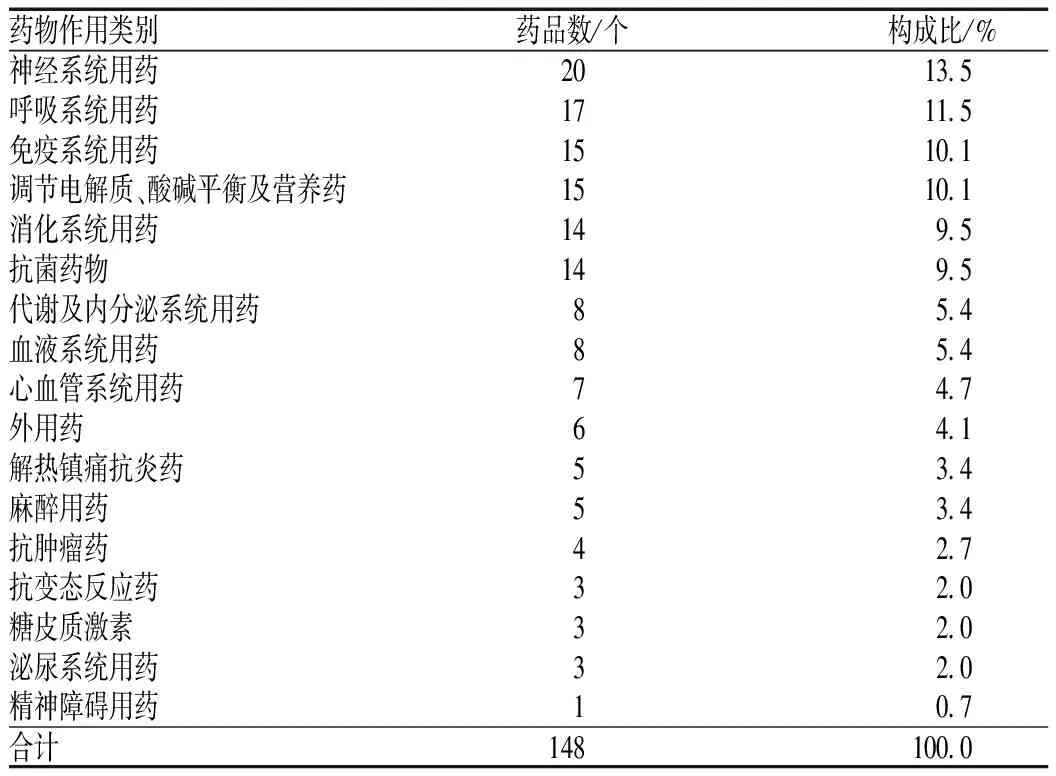
药物作用类别药品数/个构成比/%神经系统用药2013.5呼吸系统用药1711.5免疫系统用药1510.1调节电解质、酸碱平衡及营养药1510.1消化系统用药149.5抗菌药物149.5代谢及内分泌系统用药85.4血液系统用药85.4心血管系统用药74.7外用药64.1解热镇痛抗炎药53.4麻醉用药53.4抗肿瘤药42.7抗变态反应药32.0糖皮质激素32.0泌尿系统用药32.0精神障碍用药10.7合计148100.0
表2儿童专用药品的作用类别分布
Tab2Distributionofpharmacologicalactiontypes
inspecificdrugsinchildren

药物作用类别药品数/个构成比/%呼吸系统用药515.6代谢及内分泌系统用药412.5调节电解质、酸碱平衡及营养药412.5抗菌药物412.5神经系统用药39.4消化系统用药39.4解热镇痛抗炎药39.4抗变态反应药26.2免疫系统用药26.2血液系统用药26.2合计32100.0
表3药品说明书各项下儿童用药信息标注情况
Tab3Statisticsonchildren’smedicationinformation
undertheinstructions

药品说明书项目标注儿童用药信息的药品/个占全部药品的比例/%“适应症”3322.3“用法用量”8054.1“儿童用药”12987.2“不良反应”2214.9“禁忌”149.5“注意事项”1610.8
3 讨论
通过分析我院门诊儿科用药情况,结合相关文献[6-8],可见儿童用药存在药品选择难、“用法用量”项标注不规范、“儿童用药”项信息模糊或缺失、儿童药品不良反应数据缺失及超说明书用药普遍等现象。
3.1 儿童药品选择难
与成人相比,儿童的生理特征、疾病种类、用药剂量、药品口感和剂型要求特殊,这给临床治疗选择药品增加了难度。我国药品注册申请信息中明确标注为儿科专用药物的仅占2.27%,新药批准信息中明确标注为儿科专用药物的占批准品种的6%,在市场流通的药物制剂品种中儿科专用药物剂型所占比例<2%[1]。我院门诊1 000余种药品中,儿童专用药品所占比例不足5%。文献报道,我国医院儿童专用药品所占比例普遍偏低[5],很多情况下需要使用成人的剂型和规格,为达到安全剂量,家长只能靠掰开、磨粉及溶解后分刻度等方法,在分剂量的过程中不但会破坏一些特殊剂型如肠溶片、缓释片和胶囊等的特点,还会造成药品污染或剂量不准确,影响疗效或发生不良反应。
3.2 儿童“用法用量”项标注不规范
“用法用量”项是药品说明书的核心部分,直接关系到临床用药的安全与疗效,儿童用药剂量一般按照体质量、年龄和体表面积等计算。本调查统计的148个药品中,仅80个药品(占54.1%)的说明书标注了儿童“用法用量”项,其中,按照年龄计算的有24个,按体重计算的有26个,同时按年龄和体重计算的有6个,按体表面积计算的有2个,未标注年龄和计算方法的有22个。《儿科学》(8版)中对儿童年龄的划分有详细的描述,即分为新生儿期(0~28 d)、婴儿期(28 d至1周岁)、幼儿期(1~3周岁)、学龄前期(3~6周岁)、学龄期(6~10周岁)和青春期(10~18周岁)等6个年龄段。按年龄标注“用法用量”项的药品说明书中关于年龄和年龄段的描述不一,如“新生儿”“婴儿”“幼儿”“3个月以下”及“2岁至12岁”等,有待统一标准。
3.3 “儿童用药”项信息模糊或缺失
“儿童用药”项下内容是临床治疗方案参考的重要依据,关系到用药安全与临床疗效。根据《化学药品和治疗用生物制品说明书规范细则》要求,“儿童用药”主要包括儿童由于生长发育的关系而对于该药品在药理、毒理或药动学方面与成人的差异,并写明可否应用本品及用药注意事项,未进行该项试验且无可参考文献的,应当在该项下予以说明。本调查中,129个药品的说明书标注了“儿童用药”项,其中,仅24.0%的药品说明书内容表述明确,对临床有指导意义;38.0%的药品说明书内容表述为“尚不明确”“安全性和疗效尚未确定”及“未进行该项实验且无可靠参考文献”等,这种流于形式的描述对临床治疗无指导意义;27.1%的药品说明书内容表述模糊,如“遵医嘱”“用量酌减”及“在医师或药师指导下使用”;10.9%的药品因缺乏临床数据、安全性和有效性未被证实、剂量过大等原因不推荐儿童使用或禁用。儿科药品研发成本高、市场容量相对有限、临床试验受试者招募难、临床试验机构数量相对较少、政府关于儿科药品研发的激励政策尚未真正发挥作用及企业对儿童用药研究与评价重视不够等,都是造成“儿童用药”项信息标注不足的原因[9]。
3.4 儿童药品不良反应数据缺失
根据原国家食品药品监督管理总局发布的《国家药品不良反应监测年度报告(2016年)》,儿童用药安全性成为关注点,报告指出,2016年国家药品不良反应监测网络收到的来自医疗机构的120万份药品不良反应/事件病例报告中,14岁(含)以下儿童患者的报告12.8万份(占10.6%),其中严重的报告6 986份(占儿童报告总量的5.5%)。本调查统计的148个药品中,仅22个药品的说明书中描述了儿童不良反应,以抗菌药物和注射剂为主。儿童药品不良反应数据的缺失使医师在儿童的药物治疗过程中对不良反应的发生没有可预见性,且发生不良反应后不能尽快确定发生源,为临床用药带来了安全隐患。
3.5 超说明书用药现象普遍
超说明书用药是指药物的应用超出了国家药物监管部门认可的生产厂家提供的药品说明书界定范围,包括超出了适用年龄、剂量、剂型、给药途径或适应证等。超说明书用药通常是经过多年或多例临床观察,且有文献和循证医学证据
支持,但由于缺乏法律支持,使医师存在执业风险、医疗机构存在法律风险,可能增加患儿用药不良事件的发生风险[10]。在儿童疾病治疗过程中,由于儿童专用药品的缺乏和一些不规范的临床应用,使得超说明书用药现象更为普遍,主要表现为超适应证、超给药剂量、超给药频次、超给药时间、超给药途径和超适用人群等,带来很大的儿童用药安全隐患[11-12]。
综上所述,儿科患者使用成人药品的现象较普遍,常规使用的药品说明书中标示的儿童用药信息不够完整,给儿童疾病的临床治疗带来困扰,且存在用药风险。多年来,政府相关部门不断出台相关政策鼓励和支持儿童用药的研发和生产[1];也有研究通过对国内多家医院儿科用药数据进行分析,尝试建立药品说明书儿童用药信息撰写模板,指导企业修订药品说明书[9];儿童用药安全也引起了医疗机构的足够重视[13]。激励与强制措施并行是促进儿童用药发展的有效途径,建议国家采取修改《处方管理办法》中关于“一品双规”的条款、在保证药品安全性前提下加速相关儿童用药的审批、对相关儿童药品生产企业实行税收优惠政策、推进儿童用药纳入医保报销目录、赋予国家药品监管部门强制药品生产企业开展儿科研究的权力等措施,保障我国儿童用药的可及性和安全性[14-15]。相信通过多方合作努力,儿童用药安全会得到合理改善和有效保障。

