不同运动方式诱导肥胖大鼠肝脏脂联素信号通路调控脂代谢的研究
李 良,王晓静,房华玉,孔喜良,徐建方,路瑛丽,冯连世
不同运动方式诱导肥胖大鼠肝脏脂联素信号通路调控脂代谢的研究
李 良1,王晓静2,房华玉2,孔喜良2,徐建方1,路瑛丽1,冯连世1
1. 国家体育总局体育科学研究所, 北京 100061; 2. 曲阜师范大学, 山东 曲阜 273165

有氧运动;抗阻运动;脂联素;脂代谢
随着社会发展和人民生活水平的提高,肥胖问题已成为全球关注的热点问题之一。通过对全球195个国家的肥胖和超重数据进行分析后发现,2015年全球有1.07亿肥胖儿童及6.03亿肥胖成人。自1980年以来,全球大多数国家的肥胖检出率不断增加,有超过70个国家的肥胖检出率增加了一倍[12]。肥胖的大规模流行除了增加政府和社会的负担外,还会严重影响人体自身的健康。其中,向心性肥胖会导致过多的脂肪在内脏中积累,对诸多器官、系统的正常功能造成明显影响。肝脏不仅是合成脂肪和脂肪酸的重要器官,也是脂肪酸β氧化和生成酮体的主要场所,机体超过80%的胆固醇都是在肝脏形成的,血液中的脂蛋白几乎全部来自于肝脏。肝脏对脂类消化、吸收、合成、分解与运输的功能决定了肝脏对于机体脂代谢的调控有重要作用,占据了机体脂代谢调控的中心地位。在肝脏中,过多的脂肪堆积会超出肝细胞对脂肪酸的转运和氧化能力,导致脂肪在肝细胞中大量积存,形成脂肪肝[14]。有研究证实,肥胖导致的非酒精性脂肪肝在我国的发生率达到了15%,远高于酗酒导致的脂肪肝发生率[21]。在欧美国家,非酒精性脂肪肝的发生率甚至可达到20%~30%[13]。肝脏正常功能的维持需要脂肪酸来提供能量,但过多的脂肪堆积也会影响其正常功能,甚至导致疾病。因此,提升肝脏的脂代谢水平,改善脂代谢效率,对于维持肝脏和机体的正常脂代谢功能有重要意义。
脂联素(Adiponectin,APN)是一种由成熟脂肪细胞分泌的特异性蛋白,是目前发现的唯一一个与肥胖呈负相关的细胞因子[25]。APN可通过与受体结合,减少游离脂肪酸进入肝脏,血清中APN含量降低是代谢综合征的危险因素[27]之一。Fruebis等[23]通过给高脂饲料喂养的肥胖小鼠补充APN后发现,小鼠体重出现降低,血浆中游离脂肪酸和甘油三脂含量也出现了下降。APN的受体包括APN受体1和2(AdipoR1、AdipoR2),肝脏中的APN可以跟AdipoR2结合从而激活过氧化物酶体增殖物激活受体α(PPARα),活化的PPARα可进一步激活脂肪酸氧化酶基因的转录,促进脂肪酸被转运进线粒体并氧化供能。有研究证实,PPARα在脂类物质,尤其是脂肪酸的转运、氧化供能过程中有重要的调节作用。敲除小鼠的PPARα基因后,其脂肪酸转运和氧化过程严重受损,并且在肝脏中表现出明显的脂质堆积现象[26]。PPARα可以诱导肝脏细胞内肉毒碱棕榈酰基转移酶1(CPT1)的表达,CPT1是存在于线粒体内膜的酰基转移酶,在转运脂肪酸通过线粒体内膜的过程中起着至关重要的作用,是脂肪酸β氧化过程中的重要限速酶。CPT1的高表达可调节脂肪酸向线粒体转运,促进脂肪酸β-氧化,达到调节脂代谢的目的[20]。因此,“APN-PPARα-CPT1”是APN在肝脏中促进脂肪酸氧化、调节脂代谢的重要通路,起到减少脂质合成、保护肝脏产生脂肪性病变的重要作用。
有研究证据表明,合理的运动可减少脂质堆积、减轻肥胖者的体重并改善机体的脂代谢状况。有研究通过对超重和肥胖大学生进行为期8周的运动干预后发现,受试者血浆APN水平有了明显上升[1]。高品操等[3]对高脂饲料饲养的大鼠进行了11周的无负重游泳运动干预,发现有氧运动干预显著提高了肝脏中APN和PPARα的表达量。在Cho等[18]的研究中发现,高脂饮食喂养的小鼠在进行8周、每周5天、每天55 min的有氧运动干预后,其肝脏PPARα水平显著高于没有进行运动干预的小鼠。以上研究结果说明,有氧运动可在一定程度上通过APN信号通路调节机体的脂代谢水平,但目前有关抗阻运动对APN信号通路及肝脏脂代谢的研究较少。在Domingos等[19]的研究中发现,大鼠经过10周的抗阻训练后,其肝脏中PPARα mRNA表达水平显著高于安静对照大鼠。另有研究证实,抗阻运动也可减少机体脂肪堆积,改善机体血脂水平[2,15]。但是,抗阻运动是否通过调控“APN-PPARα-CPT1”信号通路达到促进脂代谢的作用还鲜有报道。综上所述,本研究旨在观察和研究有氧运动及抗阻运动对肝脏“APN-PPARα-CPT1”信号通路的影响,并探讨两种运动方式通过APN信号通路对机体脂代谢的调控作用。
1 实验材料与方法
1.1 实验对象和分组
本研究选用3周龄雄性SD大鼠为研究对象,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0011。100只大鼠在SPF级动物房中进行1周的适应性饲养后,随机分为肥胖建模组80只、正常大鼠组20只继续饲养。其中,肥胖建模组利用高脂饲料(D12451,Research Diets,New Jersey, USA)进行饲养,正常大鼠组利用符合国家标准的啮齿类动物普通饲料进行饲养。动物房温度控制在22℃±2℃,相对湿度50%±5%,大鼠自由进食和饮水。
饲养10周后,称量大鼠体重并筛选出肥胖大鼠,筛选标准为:高脂饲料饲养的大鼠体重高于普通饲料饲养大鼠平均体重的20%即为单纯性肥胖大鼠[17]。从建模成功的肥胖大鼠中取30只随机分为3组:安静对照组(CON组)、有氧运动组(AE组)和抗阻运动组(RE组),每组10只。
1.2 运动干预方案
按照分组情况对大鼠进行8周的运动干预。AE组利用跑台运动进行有氧运动干预,RE组利用负重爬梯运动进行抗阻运动干预,CON组不进行运动干预。在运动干预期间,大鼠维持高脂饲料饲养,自由进食和饮水。
1.2.1 有氧运动干预方案

1.2.2 抗阻运动干预方案
利用负重爬梯法进行抗阻运动训练[24]。爬梯长110 cm,宽18 cm,相临台阶间隔2 cm,爬梯以80°倾斜放置在地面上,其顶部有一20 cm×20 cm×20 cm的小笼子可供大鼠休息。大鼠首先进行1周的爬梯适应性训练,训练过程中不负重,由爬梯底部爬到顶部为1次完整爬梯训练,必要时在尾部给予刺激,每只大鼠每天完成8次适应性爬梯训练。完成适应性训练后开始正式训练,每2天训练一轮,每轮训练中需完成8次爬梯,次间休息2 min,负重装置(砝码)固定于大鼠尾部,负荷逐次递增,具体训练方案如下。
第1轮正式训练时,初始负荷(第1次爬梯)为大鼠体重的50%,完成第1次爬梯后,在后续每次爬梯时递增负荷30 g,直到大鼠完成8次爬梯。若中途出现大鼠无法爬到顶部的情况,将前一次爬梯的负荷定为该轮训练最大负荷,并以此负荷完成该轮剩余训练。第2轮训练中,前4次爬梯的负荷分别为第1轮训练最大负荷的50%、75%、90%和100%。如果大鼠能够完成这4次训练,随后的每次训练递增负荷30 g,直到大鼠完成8次爬梯训练并确定新的最大负荷。若出现大鼠无法爬到顶部的情况,仍以前一次爬梯的负荷定为该轮训练最大负荷,并以此负荷完成该轮剩余的训练。每轮训练确定的最大负荷供下轮训练计算新的负荷,以此类推,直到完成8周的抗阻运动训练。
1.3 实验取材
完成最后一次训练24 h后,大鼠禁食过夜,用10%水合氯醛溶液将大鼠麻醉处死并进行取材。首先于腹主动脉取血5 ml并置于血清管中,离心后取血清进行血脂及APN水平检测。取出大鼠肝脏右叶,迅速置于冰上剥离外周脂肪后剪碎,用锡铂纸包装后置于液氮中冷冻,然后转移至 -80℃冰箱中保存,用于测试肝脏中APN、PPARα、CPT1的基因及蛋白表达。剥离肾周脂肪和附睾脂肪,用吸水纸吸干表面水分后称重。
1.4 RT-PCR法检测肝脏APN、PPARα、CPT1的mRNA表达
取肝脏组织样本在预冷的研钵中研磨后,采用Trizol总RNA提取试剂盒进行样本RNA提取,操作步骤严格按产品说明书进行。以提取出的RNA为模板,按要求配置20 μl反应体系,在逆转录酶作用下合成cDNA。然后,再以合成的cDNA为模板,β-actin为内参,按要求配置20 μl反应体系进行基因扩增,每个样本有3个复孔,并利用实时荧光定量PCR系统(ABI 7500,Applied Biosystems,USA)进行荧光定量。基因扩增的反应条件为:94℃ 4 min,94℃ 20 s,60℃ 25 s,共35个循环。根据荧光定量的结果,利用2-△△ct法对样本中的mRNA进行相对定量。实验所需的引物由北京Invitrogen公司合成,各目的基因的引物序列如表1所示。

表1 目的基因的引物序列
1.5 Western Blotting法检测肝脏APN、PPARα、CPT1的蛋白表达
首先提取样本中的总蛋白,利用BCA法检测蛋白浓度,并用裂解液调节各样本的蛋白浓度一致。然后加入相应量的5×蛋白上样缓冲液,在100℃水浴锅中进行5 min的蛋白变性。利用10%的SDS-PAGE凝胶电泳分离蛋白, 200 mA恒流转膜,转膜时间约60 min。取出膜在TBST中清洗1 min,然后用封闭液封闭。将膜与稀释好的一抗(APN 1∶1 000,PPARα 1∶1 000,CPT1 1∶1 000,均购自美国Abcam公司)室温孵育10 min,放4℃过夜。次日拿出膜后用TBST洗膜3次,每次5 min,洗去残留一抗。加入HRP标记的山羊抗兔二抗,室温摇床孵育40 min,然后用TBST洗膜4次,每次5 min。最后加入ECL化学发光试剂(Millipore,USA)反应3~5 min,曝光10 s~5 min(曝光时间随不同光强度而调整),显影2 min后定影。将每个条带与相应样品的内参GAPDH条带光密度值进行比较,计算出目的条带的相对蛋白表达量。
1.6 数据处理
所有数据利用SPSS 20.0软件进行统计和分析,不同组别的数据利用One-Way ANOVA进行统计分析,各组数据利用Bonferroni test进行校准后再进行组间差异比较。统计结果以平均值±标准差(±)表示,以<0.05为具有显著的统计学差异。
2 研究结果
2.1 肥胖大鼠的建模
在饲养过程中,利用高脂饲料饲养的肥胖建模组大鼠体重增长速度高于普通饲料饲养的大鼠。饲养10周后,筛选出的肥胖大鼠体重显著高于正常饲料饲养的大鼠,并且肥胖大鼠的体重均在正常大鼠平均体重的1.2倍及以上。筛选出的肥胖大鼠平均体重为584±28 g,普通饲料饲养的大鼠平均体重为460±32 g。建模期间大鼠体重变化见图1。
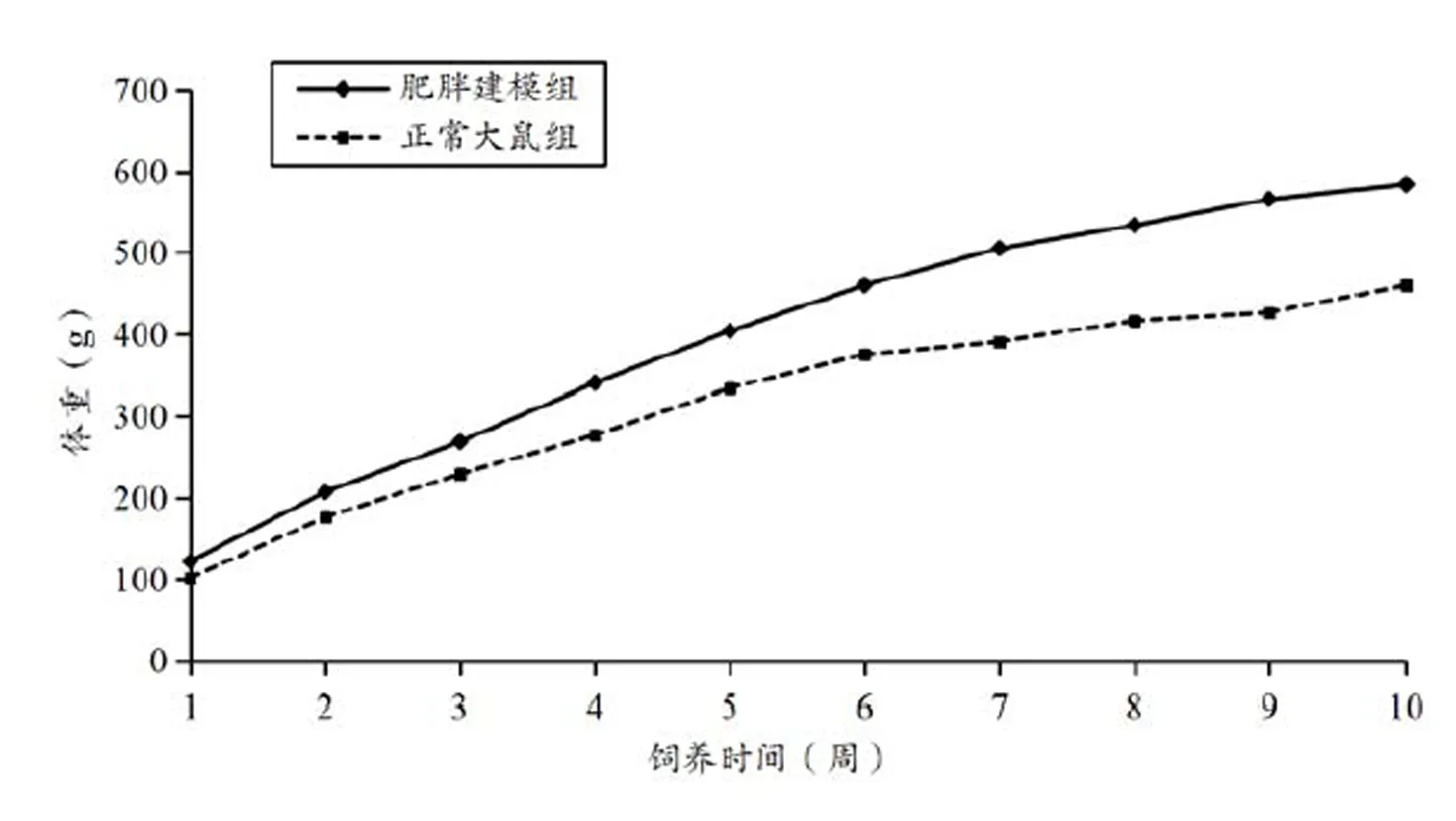
图1 10周建模期间大鼠的体重变化
Figure 1. Changes of Body Weight during 10 Weeks Modeling
2.2 运动干预后大鼠体重、脂肪重量及脂体比的比较
运动干预前,CON组、AE组、RE组大鼠的体重没有显著性差异(598.4±26.2 g567.4±44.8 g600.7±32.3 g,>0.05);而在完成8周的运动干预后,AE组和RE组大鼠的体重显著低于CON组,且AE组大鼠的体重显著低于RE组(表2)。AE组和RE组大鼠的肾周及附睾脂肪重量都显著低于CON组,AE组大鼠的脂体比也显著低于CON组。
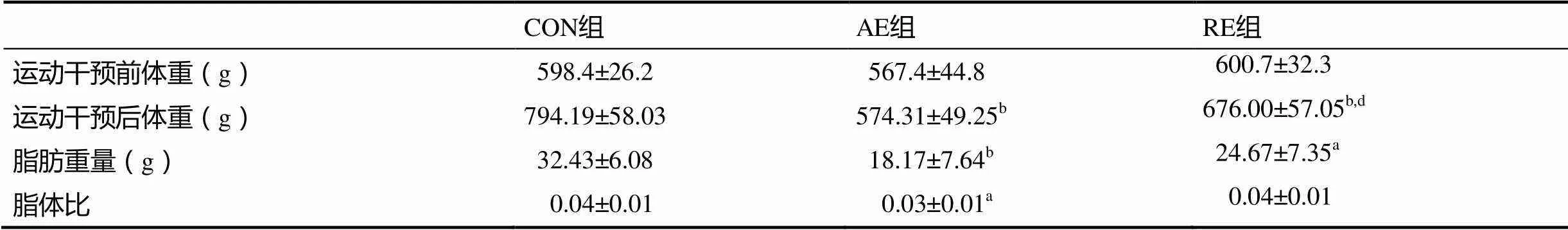
表2 运动干预后大鼠的体重、脂肪重量及脂体比变化
注:a表示与CON组比较,<0.05;b表示与CON组比较,<0.01;d表示与AE组比较,<0.01,下同。
2.3 运动干预后大鼠血清APN及血脂水平比较
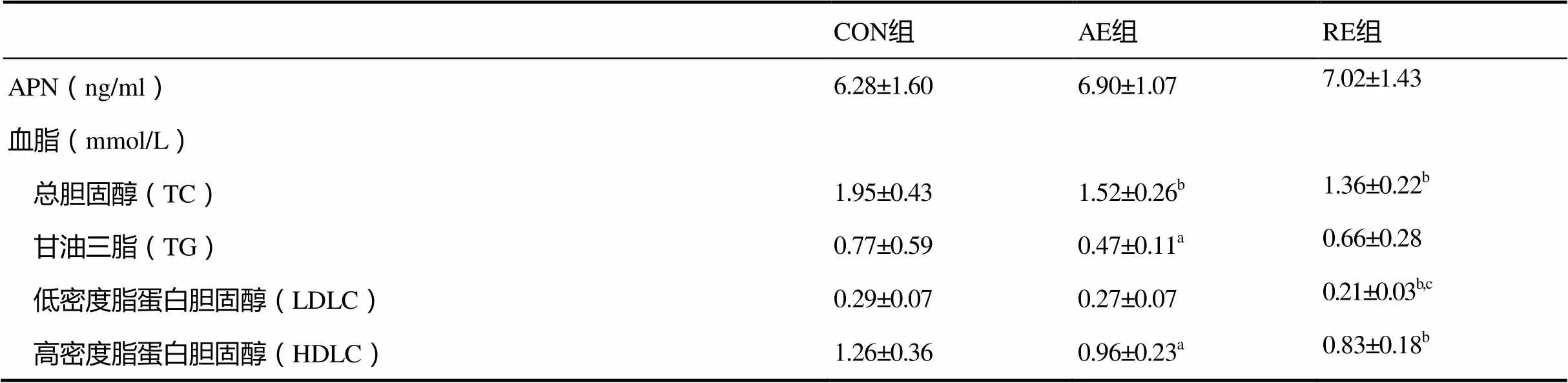
表3 运动干预后大鼠血清APN及血脂水平变化
注:C表示与AE组比较,<0.01,下同。
如表3所示,8周的运动干预后,AE组和RE组大鼠血清APN水平均高于CON组,但没有显著性差异(>0.05)。CON组大鼠的TC、HDLC水平都显著高于AE组和RE组;CON组大鼠的TG水平显著高于AE组,但与RE组没有显著性差异;RE组大鼠的LDLC水平显著低于CON组及AE组。
2.4 运动干预后肝脏APN、PPARα、CPT1的mRNA表达变化
RT-PCR的检测结果如图2所示,经过8周的运动干预后,AE组和RE组APN mRNA相对表达量均显著高于CON组(CONAE and RE: 1.00±0.053.77±0.92 and 1.62±0.30,<0.01),且AE组显著高于RE组(<0.01)。PPARα的mRNA相对表达量在CON组中为1.01±0.06,显著低于AE组的5.76±0.77(<0.01)及RE组的2.83±0.53(<0.01),且AE组显著高于RE组(<0.01)。CPT1的mRNA相对表达量在AE组中最高,显著高于CON组和RE组(AECON and RE: 5.01±0.921.01±0.11 and 2.62±0.39,<0.01),且AE组显著高于RE组(<0.01)。
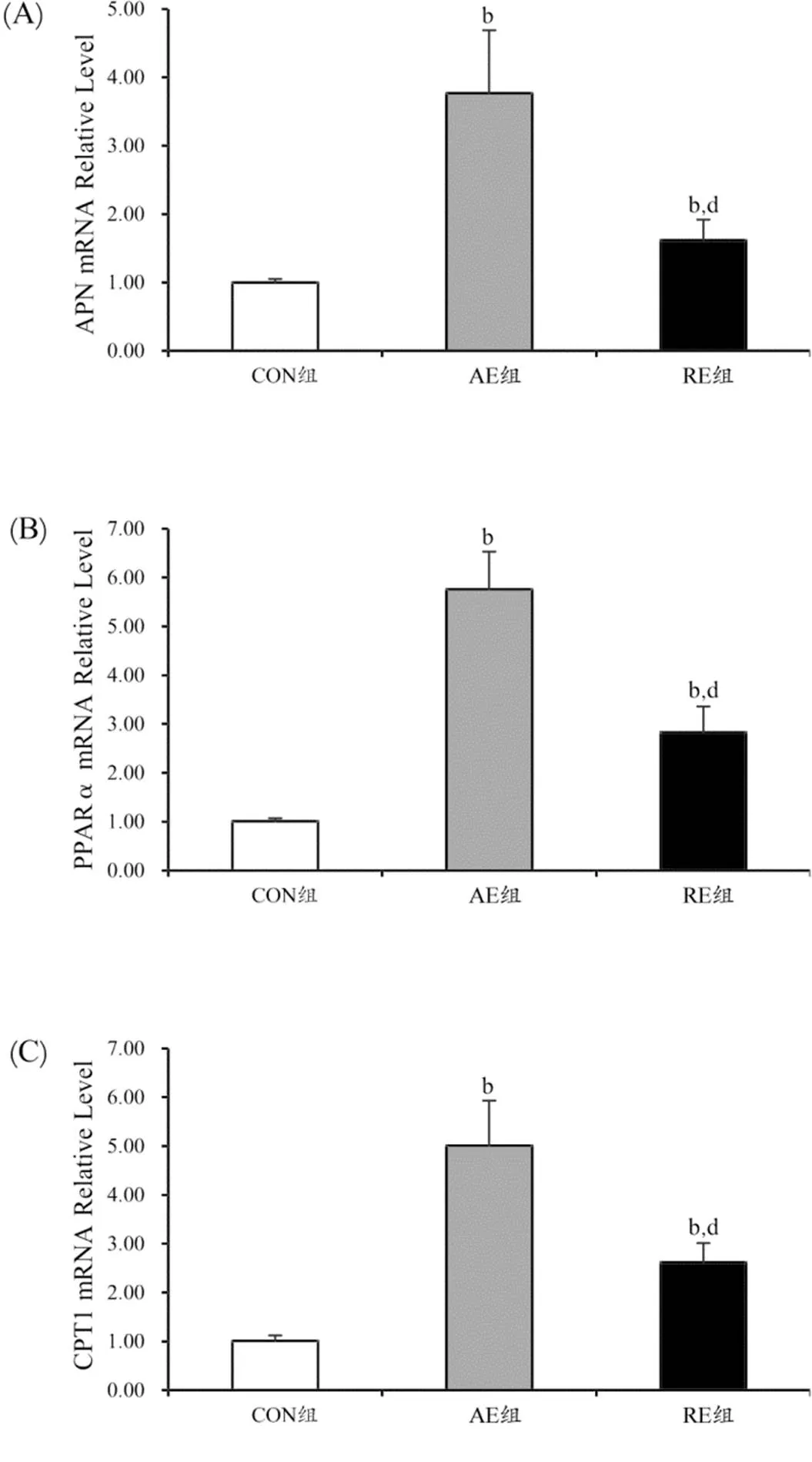
图2 运动干预后大鼠肝脏APN(A)、PPARα(B)、CPT1(C)的mRNA表达变化柱状图
Figure 2. Gene Expression of APN(A)、PPARα(B) and CPT1(C) in Liverafter Exercise Training
2.5 运动干预后肝脏APN、PPARα、CPT1的蛋白表达变化
Western Blotting的检测结果如图3所示,RE组APN蛋白的相对表达量为1.08±0.11,显著高于AE组的0.85±0.23(<0.05),但与CON组比较没有显著性差异。PPARα的蛋白表达量在RE组中同样高于AE组(AERE: 0.75±0.361.09±0.19,<0.05),但与CON组比较没有显著性差异。CPT1的蛋白表达量在CON组中显著高于AE组(CONAE: 1.000.76±0.15,0.05),但与RE组(0.88±0.04)比较没有显著性差异。
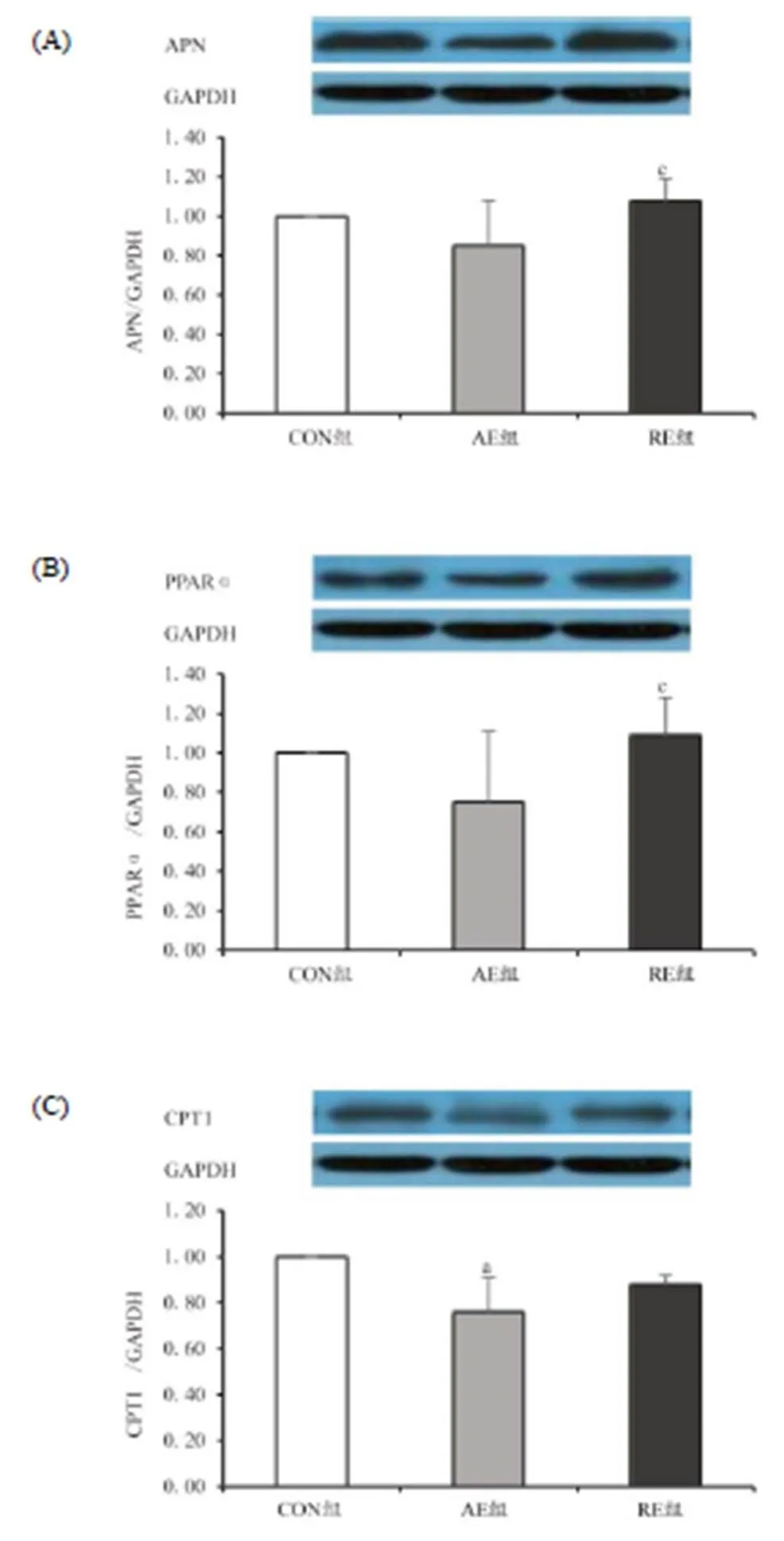
图3 运动干预后大鼠肝脏APN(A)、PPARα(B)、CPT1(C)的蛋白表达变化示意图
Figure 3. Protein Expression of APN(A)、PPARα(B) and CPT1(C) in Liverafter Exercise Training
3 分析与讨论
很多研究表明,合理的运动能够减少脂肪堆积、降低脂体比,达到降低体重的效果。本研究中,肥胖大鼠进行8周的有氧运动或抗阻运动干预后,其体重均低于未进行运动干预的肥胖大鼠。徐建方等[10]对39名肥胖受试者分别进行了4周的有氧运动或抗阻运动干预,这两组受试者的体重都有明显降低,与本研究结果相一致,说明,有氧运动或抗阻运动干预均可达到减轻体重的效果。目前,肥胖人群的规模日益扩大,其中向心性肥胖占很大比例,内脏周围脂肪过多堆积会严重危害身体健康。任华等[8]对高脂饲料诱导的肥胖大鼠进行了为期8周的游泳运动干预,发现运动组大鼠的体重显著低于对照组,且运动组大鼠的腹腔脂肪重量也显著低于对照组。本研究观察到,8周的有氧运动干预减少了肥胖大鼠肾周脂肪和附睾脂肪的堆积,而抗阻运动干预同样减少了肾周脂肪和附睾脂肪量。以上研究结果提示,有氧运动或抗阻运动均能有效降低内脏脂肪,尤其是肾周脂肪和附睾脂肪重量,从而达到降低体重的目的。另外,夏书宁[9]对肥胖大鼠进行10周的跑台运动干预后发现,大强度运动组、中等强度运动组和小强度运动组大鼠脂体比都显著低于对照组,而大强度运动组大鼠脂体比也显著低于中等强度运动组和小强度运动组。这与本实验研究结果一致,相对于安静对照组大鼠,8周的跑台有氧运动干预显著降低了肥胖大鼠的脂体比。但是,本研究中抗阻运动干预并没有使大鼠脂体比出现明显降低,提示,有氧运动在减少内脏脂肪堆积方面的作用可能更加显著。
肥胖者体内通常伴随着血脂异常现象,主要表现为TC、TG、LDLC水平上升,而HDLC水平下降。李荣娟等[4]对II型糖尿病老年男性患者进行18周的不同运动方式干预,发现进行有氧运动或抗阻运动受试者的血清TC、LDLC水平显著低于对照组,而血清TG水平无明显变化;有氧运动组血清HDLC水平与对照组有显著性差异,但抗阻运动组血清HDLC水平显著升高。在李世成等[6]的研究中,肥胖大鼠进行4周的游泳运动干预后其血清TC、TG、LDLC水平都出现明显下降。本研究也观察到了类似的结果,经过8周的有氧运动或抗阻运动干预后,肥胖大鼠的TC、TG、LDLC水平较安静对照组有明显下降,说明,这两种运动方式都能有效改善肥胖大鼠的血脂水平。另外,研究发现运动干预会提高HDLC的水平[7],但在本研究中发现,有氧运动组或抗阻运动组大鼠的HDLC水平不升反降,均显著低于安静对照组。HDLC的主要作用是转运血液中的TC和TG,而本研究中发现,运动干预之后的大鼠血清TC和TG含量明显降低,相应的,无需过多的HDLC即可满足机体的需要,这可能是本研究中未观察到运动干预使大鼠血清HDLC水平上升的原因之一。
APN是调节脂类代谢的重要激素,肥胖个体通常表现出较低的APN水平,影响自身脂代谢[5]。但经过一段时间的运动干预后,肥胖个体的APN水平可出现上升[22,28]。研究证实,APN在肝脏中可与AdipoR2结合激活PPARα,进而发挥生理调节作用,促进脂肪酸的氧化。有研究对SD大鼠进行高脂饲料饲养的同时进行了11周的无负重游泳运动干预,结果发现,有氧运动显著提高了肝脏中APN和PPARα的水平,推测有氧运动可能通过改善高脂饮食大鼠肝脏的APN-PPARα信号通路来调节脂代谢,从而预防高脂饮食大鼠胰岛素抵抗的形成[3]。杨文吉等[11]对非酒精性脂肪肝大鼠进行中等强度的游泳运动干预,结果显示,运动干预后大鼠肝脏中PPARα基因表达显著增加。Fatouros等[22]对老年男性进行了长达6个月的抗阻运动干预,根据运动强度分为小、中、大3个运动强度组,实验结果显示,大强度抗阻运动组受试者的APN水平出现了显著上升,说明抗阻运动在一定程度上也可提高机体APN水平。在本研究中,有氧运动或抗阻运动均提高了大鼠肝脏APN和PPARα的基因表达水平,并且有氧运动比抗阻运动更加有效。虽然血清APN水平在3组间没有显著性差异,但进行有氧运动或抗阻运动干预的大鼠血清APN水平比安静对照组都有所升高。在肝脏中,β氧化是脂肪酸分解的主要形式,而CPT1是调节β氧化的关键限速酶。研究发现,PPARα是CPT1的上游转录因子,可调节CPT1的转录和表达[16]。Cho等[18]利用高脂饲料将小鼠喂养15周后又进行了8周的跑台有氧运动干预,结果发现,有氧运动提高了小鼠肝脏中PPARα和CPT1的基因表达。在本研究中也发现,有氧运动或抗阻运动都提高了肥胖大鼠肝脏CPT1基因的表达水平,而有氧运动的效果更加显著。以上研究结果说明,有氧运动或抗阻运动都能在一定程度上提高“APN-PPARα-CPT1”信号通路中各因子的基因表达水平,促进APN生理作用的发挥。
另一方面,“APN-PPARα-CPT1”信号通路中各因子的蛋白表达水平却与基因表达水平并不一致。从研究结果来看,有氧运动组和抗阻运动组大鼠的APN及PPARα蛋白表达水平与安静对照组没有显著性差异,但抗阻运动组大鼠的APN及PPARα蛋白表达水平显著高于有氧运动组;另外,有氧运动组大鼠的CPT1蛋白表达水平却低于安静对照组。由此可见,在有氧运动或抗阻运动的干预下,“APN-PPARα-CPT1”信号通路中各因子的蛋白表达水平并没有随基因表达水平的上升而提高。根据研究结果推测,本研究中有氧运动或抗阻运动干预均显著降低了肥胖大鼠的体脂和血脂水平,在一定程度上改善了脂代谢状况,脂代谢水平的提升可能负反馈抑制了“APN-PPARα-CPT1”信号通路中各因子的蛋白表达,最终在长期的运动干预下形成了新的脂代谢稳态,但该假设还需进一步研究论证。
4 结论
经过8周的有氧运动或抗阻运动干预,肥胖大鼠肝脏“APN-PPARα-CPT1”信号通路中各因子的基因表达水平都有了显著提高,在一定程度上减轻了肥胖大鼠的体重、减少了体脂堆积并改善了血脂水平。相对于抗阻运动,有氧运动对肥胖大鼠肝脏“APN-PPARα-CPT1”信号通路及脂代谢的影响更加显著。
[1] 柏友萍, 许晓东, 孙骏, 等. 减肥运动处方对超重肥胖大学生腰臀比及血浆内脂素、脂联素的影响[J]. 成都体育学院学报, 2013, 39(10): 80-85.
[2] 丁凡. 团体健身操、抗阻运动和混合运动对防治肥胖效果的影响[D]. 武汉: 武汉体育学院, 2010.
[3] 高品操, 徐广艳, 常永娜, 等. 有氧运动联合KGM对高脂膳食大鼠胰岛素抵抗形成中肝脏Adiponectin/PPARα通路的影响[J]. 中国老年学杂志, 2014, 34(2): 417-419.
[4] 李荣娟, 李锋. 不同运动方式对2型老年男性糖尿病患者血糖、血脂等指标的影响研究[J]. 广州体育学院学报, 2017, 37(2): 99-101.
[5] 李诗言, 姜涛, 曲仁伟. 肥胖大鼠血清及肝脏中脂联素水平的研究[J]. 中国实验诊断学, 2014, 18(10): 1597-1599.
[6] 李世成, 邵雄杰, 甄达文, 等. 运动对肥胖大鼠血清脂联素、血脂及体脂水平的影响[J]. 中国运动医学杂志, 2009, 28(1): 41-44.
[7] 李旭武, 翁锡全, 林文弢. 间歇低氧运动对胰岛素抵抗大鼠体成分及血脂指标的影响[J]. 广州体育学院学报, 2014, 34(4): 93-96.
[8] 任华, 衣雪洁. 长期有氧运动对肥胖大鼠肝脏LKB1-AMPK-ACC 信号传导通路的影响[J]. 沈阳体育学院学报, 2015, 34(4): 92-97.
[9] 夏书宇. 不同强度跑台运动对高脂饮食大鼠脂肪组织PPARγ/脂联素/TNF-α mRNA的影响[J]. 成都体育学院学报, 2015, 41(3): 98-102.
[10] 徐建方, 张漓, 冯连世, 等. 不同运动方式对肥胖青年身体慢性炎症状态的影响[J]. 体育科学, 2015, 35(10): 30-36.
[11] 杨文吉, 崔旭妍, 郑晟琳, 等. 有氧运动对非酒精性脂肪肝大鼠肝细胞PPARα mRNA表达的影响[J]. 现代生物医学进展, 2014, 14(10): 1855-1860.
[12] AFSHIN A, FOROUZANFAR M H, REITSMA M BHealth effects of overweight and obesity in 195 countries over 25 years[J]. N Engl J Med, 2017, 377(1): 13-27.
[13] ANGULO P. GI epidemiology: nonalcoholic fatty liver disease[J]. Aliment Pharmacol Ther, 2007, 25(8): 883-889.
[14] ASRIH M, JORNAYVAZ F R. Diets and nonalcoholic fatty liver disease: the good and the bad[J]. Clin Nutr, 2014, 33(2): 186-190.
[15] BORG P, KUKKONEN-HARJULA K, FOGELHOLM MEffects of walking or resistance training on weight loss maintenance in obese, middle-aged men: a randomized trial[J]. Int J Obes Relat Metab Disord, 2002, 26(5): 676-683.
[16] CANNON C P. Mixed dyslipidemia, metabolic syndrome, diabetes mellitus, and cardiovascular disease: clinical implications[J]. Am J Cardiol, 2008, 102(12A): 5L-9L.
[17] CHANDLER P C, VIANA J B, OSWALD K DFeeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet[J]. Physiol Behav, 2005, 85(2): 221-230.
[18] CHO J, LEE I, KIM DEffect of aerobic exercise training on non-alcoholic fatty liver disease induced by a high fat diet in C57BL/6 mice[J]. J Exerc Nutr Biochem, 2014, 18(4): 339-346.
[19] DOMINGOS M M, RODRIGUES M F, STOTZER U SResistance training restores the gene expression of molecules related to fat oxidation and lipogenesis in the liver of ovariectomized rats[J]. Eur J Appl Physiol, 2012, 112(4): 1437-1444.
[20] EVERETT L, GALLI A, CRABB D. The role of hepatic peroxisome proliferator-activated receptors (PPARs) in health and disease[J]. Liver, 2000, 20(3): 191-199.
[21] FAN J G, FARRELL G C. Epidemiology of non-alcoholic fatty liver disease in China[J]. J Hepatol, 2009, 50(1): 204-210.
[22] FATOUROS I G, TOURNIS S, LEONTSINI DLeptin and adiponectin responses in overweight inactive elderly following resistance training and detraining are intensity related[J]. J Clin Endocrinol Metab, 2005, 90(11): 5970-5977.
[23] FRUEBIS J, TSAO T S, JAVORSCHI SProteolytic cleavage product of 30-kDa adipocyte complement-related protein increases fatty acid oxidation in muscle and causes weight loss in mice[J]. Proc Natl Acad Sci USA, 2001, 98(4): 2005-2010.
[24] HORNBERGER T A, FARRAR R P. Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat[J]. Can J Appl Physiol, 2004, 29(1): 16-31.
[25] HUNG J, MCQUILLAN B M, THOMPSON P LCirculating adiponectin levels associate with inflammatory markers, insulin resistance and metabolic syndrome independent of obesity[J]. Int J Obes (Lond), 2008, 32(5): 772-779.
[26] KERSTEN S, SEYDOUX J, PETERS J MPeroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting[J]. J Clin Invest, 1999, 103(11): 1489-1498.
[27] KUBOTA N, YANO W, KUBOTA TAdiponectin stimulates AMP-activated protein kinase in the hypothalamus and increases food intake[J]. Cell Metab, 2007, 6(1): 55-68.
[28] ZENG Q, ISOBE K, FU LEffects of exercise on adiponectin and adiponectin receptor levels in rats[J]. Life Sci, 2007, 80(5): 454-459.
Effects of Different Exercise Training on Lipid Metabolism by Activating Hepatic Adiponectin Signaling Pathway in Obese Rats
LI Liang1, WANG Xiao-jing2, FANG Hua-yu2, KONG Xi-liang2, XU Jian-fang1,LU Ying-li1, FENG Lian-shi1
1. China Institute of Sport Science, Beijing 100061, China; 2. Qufu Normal University, Qufu 273165, China.

1002-9826(2018)05-0070-07
10.16470/j.csst.201805011
G804.7
A
国家体育总局体育科学研究所基本科研业务费资助项目(基本16-54, 基本17-06)。
李良,男,助理研究员,博士,主要研究方向为运动与能量代谢、运动营养、青少年健康促进, E-mail: liliang @ciss.cn。
冯连世,男,研究员,博士,主要研究方向为运动训练监控、高原(低氧)训练, E-mail:fengls98@126.com。

