ANXA2 siRNA对甲状腺未分化癌细胞凋亡及放疗敏感性的影响
杨慧慧,阚全娥,于 璐,刘明博
1)河南省人民医院内分泌科 郑州 450003 2)河南省人民医院放疗科 郑州 450003
甲状腺未分化癌在全部甲状腺癌中约占1%,其恶性程度高,发展迅速,大部分甲状腺未分化癌并非由碘所引起[1],而放射治疗对于非碘导致的病灶治疗效果最为显著。膜联蛋白A2(Annexin A2,ANXA2)是膜联蛋白家族成员之一,能够通过调控钙离子通道进而影响细胞的生长、凋亡过程[2]。ANXA2在肝癌、胃癌、肾透明细胞癌、食管癌组织中表达上调,参与癌细胞的生长过程[3-6]。本研究以甲状腺未分化癌细胞8505c为对象,探讨干扰ANXA2对癌细胞增殖、凋亡及放疗敏感性的影响,以期为甲状腺未分化癌的治疗提供理论依据。
1 材料与方法
1.1材料8505c细胞购自郑州大学。ANXA2小干扰RNA(ANXA2 siRNA)、阴性对照序列(NC siRNA)为山东维真生物科技有限公司产品,Q6000紫外分光光度计为美国Quawell公司产品,RT-PCR试剂盒、Lip2000转染试剂为美国Thermo公司产品,BCA定量检测试剂盒为碧云天生物技术研究所产品,Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司。ANXA2、p38、磷酸化p38(p-p38)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)、GAPDH多克隆抗体均为武汉金开瑞生物工程有限公司产品,胰蛋白酶、胎牛血清、RPMI 1640培养基为美国Gibco公司产品。
1.2细胞分组及转染8505c细胞用含体积分数10%胎牛血清的RPMI 1640细胞培养液培养,分为对照组、阴性对照组(NC组)和干扰组,其中NC组和干扰组分别转染NC siRNA和ANXA2 siRNA,对照组不做处理。
1.3RT-PCR检测细胞中ANXA2mRNA的表达培养48 h后,提取3组细胞RNA,反转录为cDNA后行PCR。ANXA2上游引物序列为5’-CCCCACCTCCAGAAAGTAT-3’,下游为5’-TTCAGTCATCTCCACCACA-3’。GAPDH(内参)上游引物序列为5’-CTGGGACGACATGGAGAAAA-3’,下游为5’-AAGGAAGGCTGGAAGAGTGAC-3’。反应条件:94 ℃预变性120 s;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸120 s,35个循环;72 ℃总延伸360 s。采用2-ΔΔCt法计算ANXA2 mRNA的表达水平。实验重复3次。
1.4Westernblot检测细胞中ANXA2蛋白的表达培养48 h后,提取3组细胞总蛋白,BCA定量检测试剂盒检测蛋白浓度。将蛋白样品与5×上样缓冲液以4∶1的比例混合,煮沸5 min,每孔上样40 μL,100 V电压聚丙烯酰胺凝胶电泳120 min。50 mA、4 ℃半干法转膜60 min。最后用50 g/L脱脂奶粉溶液室温封闭90 min。加按1∶1 000稀释的一抗(ANXA2多克隆抗体),4 ℃孵育过夜。再加按1∶2 000稀释的二抗,37 ℃孵育90 min。滴加显色液,曝光,激光成像系统拍照扫描,以目的蛋白与GAPDH条带灰度值的比值表示目的蛋白的相对表达量。实验重复3次。
1.5细胞增殖检测取3组细胞,接种到96孔培养板,每孔加4×104个细胞,每组设6个复孔,以不加细胞的孔为空白调零孔。培养48 h后,常规MTT法检测细胞增殖能力(酶标仪检测波长为490 nm)。细胞存活率=(实验组吸光度-空白调零孔吸光度)/(对照吸光度-空白调零孔吸光度)×100%。
1.6细胞凋亡检测培养48 h后收集3组细胞,胰蛋白酶消化,1 000 r/min离心10 min,采用Annexin V-FITC/PI双染法检测细胞凋亡,计算凋亡率。实验重复3次。
1.7细胞克隆实验将3组细胞接种到6孔培养板,每孔1×106个,过夜培养。随后用6MV-X射线室温垂直照射,剂量为0、2、4、6、8 Gy(0.8 Gy/min)。培养12 d后,冷甲醇固定,姬姆萨染色30 min。观察并计数所形成的细胞集落大于50个的菌落。存活分数为受照射细胞与对照细胞克隆形成率的比值。D0为存活曲线直线部分斜率的倒数。放射增敏比为对照组(或NC组)与干扰组D0的比值。实验重复3次。
1.8Westernblot检测细胞中p38、p-p38、CleavedCaspase-3蛋白的表达对照组、NC组和干扰组细胞培养48 h后,提取细胞中的总蛋白,同1.4方法检测细胞中p38、p-p38、Cleaved Caspase-3蛋白的表达。以目的蛋白与GAPDH条带灰度值的比值表示p38、p-p38、Cleaved Caspase-3蛋白的相对表达量。实验重复3次。
1.9统计学处理采用SPSS 22.0处理数据。采用单因素方差分析比较3组细胞各指标的差异,两两比较采用LSD-t检验,检验水准 α=0.05。
2 结果
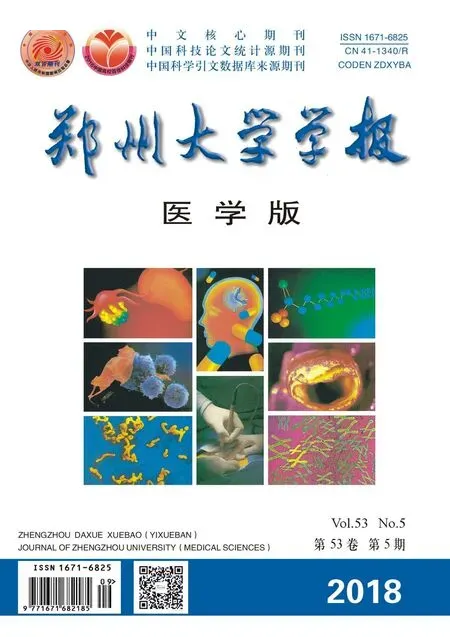
2.1 3组细胞中ANXA2表达水平比较结果见图1、表1。与对照组相比,NC组细胞中ANXA2水平无明显变化,而干扰组细胞中ANXA2 mRNA和蛋白表达水平降低。
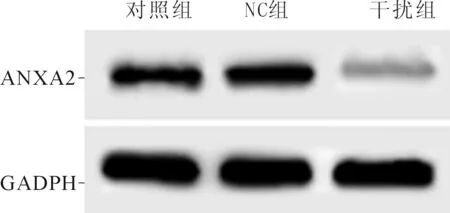
图1 3组细胞中ANXA2蛋白的表达水平表1 3组细胞ANXA2 mRNA和蛋白表达水平的比较
组别nANXA2 mRNAANXA2蛋白对照组31.00±0.020.52±0.07NC组31.04±0.140.53±0.05干扰组30.34±0.05*0.11±0.02*F61.81366.269P<0.001<0.001
*:与其他2组相比,P<0.05
2.2 3组细胞存活率和凋亡率的比较与对照组和NC组相比,干扰组细胞存活率降低,凋亡率升高,结果见表2。

表2 3组细胞存活率和凋亡率比较 %
*:与其他2组比较,P<0.05
2.3 3组细胞放疗敏感性比较见图2。从图2可以看出,干扰组细胞存活分数降低,放疗敏感性增强,相对对照组和NC组的放射增敏比为2.013和2.078。
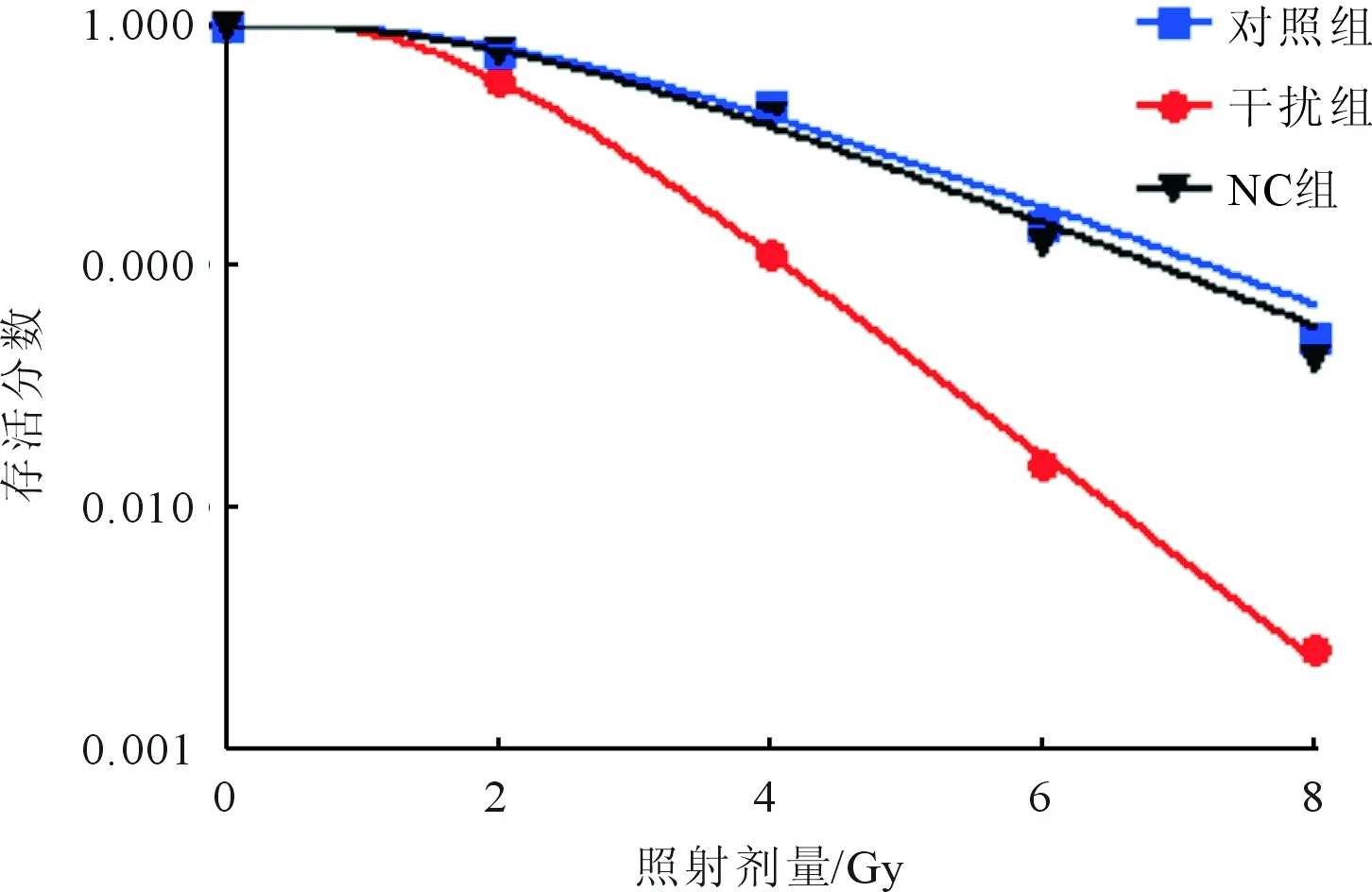
图2 细胞存活曲线
2.4 3组细胞p38、p-p38、CleavedCaspase-3表达水平比较与对照组和NC组相比,干扰组细胞中凋亡相关蛋白Cleaved Caspase-3及p-p38水平均升高。见图3、表3。
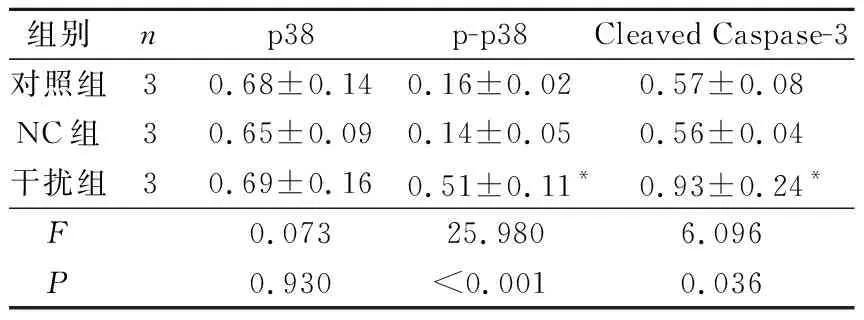
组别np38p-p38Cleaved Caspase-3对照组30.68±0.140.16±0.020.57±0.08NC组30.65±0.090.14±0.050.56±0.04干扰组30.69±0.160.51±0.11*0.93±0.24*F0.07325.9806.096P0.930<0.0010.036
*:与其他2组比较,P<0.05
3 讨论
膜联蛋白家族包含12个蛋白家族成员,是一种与磷脂结合蛋白有关的蛋白家族,该蛋白家族成员生物学功能不同,与细胞有丝分裂、细胞凋亡、细胞衰老等有关[7-8]。ANXA2是膜联蛋白A家族的成员,该基因定位于15q21-q22染色体上,其在胰腺癌、乳腺癌、胃腺癌组织及肝癌细胞中表达上调,而在前列腺癌组织中表达缺失[9-13]。Trojanowicz等[14]在甲状腺乳头癌中发现ANXA2高表达。
Jimenez等[15]的研究表明,敲除结直肠癌细胞caco2的ANXA2基因后,细胞的生长能力与野生型的caco2细胞相比明显下降,细胞凋亡率升高。孙梦瑶[16]通过siRNA干扰胃癌细胞SGC-7901中ANXA2的表达,发现细胞增殖能力下降,凋亡能力没有变化。本研究结果显示,干扰ANXA2的表达后,甲状腺未分化癌细胞存活率降低,凋亡率升高,说明干扰ANXA2能够抑制甲状腺未分化癌细胞增殖,诱导细胞凋亡。
p38信号通路参与癌细胞生长过程。Wang等[17]的研究表明,苦参碱能够通过促进p38磷酸化而抑制Hela细胞增殖。癌细胞的凋亡与多种基因的调控有关,是细胞内多种信号途径传导的最终结果。Li等[18]研究表明,甲状腺癌中p38信号通路激活受到抑制,而激活p38信号通路能够通过促进Cleaved Caspase-3蛋白表达诱导甲状腺未分化癌细胞凋亡。本研究结果发现,干扰ANXA2后,甲状腺未分化癌细胞8505c中Cleaved Caspase-3、p-p38水平升高。提示干扰ANXA2能够促进甲状腺未分化癌细胞中p38信号通路激活,促进Caspase-3活化,从而抑制细胞增殖,诱导凋亡。
甲状腺未分化癌是一种非碘摄取的病灶,这种病灶放射治疗效果最为显著。本研究结果显示干扰ANXA2的表达后,8505c细胞存活分数降低,放疗敏感性增加。
综上所述,干扰ANXA2能够抑制甲状腺未分化癌细胞增殖,促进细胞凋亡,增强放疗敏感性,其机制可能与p38信号通路有关。本研究结果为靶向ANXA2治疗甲状腺未分化癌提供了理论基础。