固相萃取柱净化-超高效液相色谱-串联质谱法快速测定液态乳中14 种真菌毒素
孙晓冬,郝 杰,毛 婷,邵瑞婷,姜 洁*
(北京市食品安全监控和风险评估中心,北京 100094)
真菌毒素是某些真菌在特定条件下产生的具有毒性的次级代谢产物,可广泛污染农作物及其副产品[1-3],并会引起动物或人类急性或慢性中毒[4-5],部分真菌毒素还具有致畸、致癌、致突变作用[6-7],对健康造成极大的威胁。目前已知能产生真菌毒素的真菌有150多种,产生的真菌毒素有300多种,按其主要菌种[8-9]可以分为曲霉菌毒素,如黄曲霉毒素和棕曲霉毒素等;镰刀菌毒素,如脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、T-2毒素等;以及青霉菌毒素。而液态乳中残留的真菌毒素主要有不同种类的镰刀菌毒素和黄曲霉毒素[10-12]。
近年来,随着对真菌毒素认识的提高以及对其广泛的关注,真菌毒素的检测分析技术得到了长足的发展和进步。目前对多种真菌毒素同时检测的净化方法主要有免疫亲和色谱法[13]、凝胶渗透色谱法[14-15]、QuEChERS(quick, easy, cheap, effective, rugged, safe)法[16-17]等,免疫亲和色谱法有较强的选择性但价格较高,凝胶渗透色谱时间长且难以鉴别分离组分,QuEChERS净化效果有限且稀释倍数较大,净化后低浓度的待测分析物可能无法满足检测要求[18-19]。Oasis PRiME HLB是一种新型固相萃取柱[20-24],国内外文献中使用该固相萃取柱作为净化手段的检测方法有很多,但鲜少应用在液态乳中真菌毒素的检测。Oasis PRiME HLB的吸附剂是由亲脂性二乙烯苯与亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成大孔共聚物,亲水亲酯,有独特的水浸润平衡特性,能有效吸附乳制品中富含的磷脂等基质干扰物而对待测物无吸附,降低基质效应,且无需进行吸附剂的活化和平衡步骤,无需淋洗,及后续氮吹复溶,操作简单,节省时间和有机溶剂的消耗,方法稳定可靠。本实验采用Oasis PRiME HLB固相萃取柱进行样品净化,快速准确筛查液态乳中多种真菌毒素。其具有前处理简单、分析时间短、灵敏度较高以及定性定量可靠的优势,满足了液态乳中安全风险突发事件的快速应急处理工作中高通量、高可靠性确证和定量分析的要求,能够为企业及相关安全监管部门提供有利的技术支撑。
1 材料与方法
1.1 材料与试剂
液态乳从北京市各大市场、超市随机抽取。
黄曲霉毒素B1(纯度98.0%,CAS号:1162-65-8)、黄曲霉毒素B2(纯度98.0%,CAS号:7220-81-7)、黄曲霉毒素G1(纯度98.0%,CAS号:1165-39-5)、黄曲霉毒素G2(纯度98.0%,CAS号:7241-98-7)、黄曲霉毒素M1(纯度98.0%,CAS号:6795-23-9)、赭曲霉毒素A(纯度98.0%,CAS号:303-47-9)、玉米赤霉烯酮(纯度99.0%,CAS号:17924-92-4) 美国O2si公司;橘霉素(纯度97.0%,CAS号:518-75-2) 加拿大TRC公司;T-2毒素(纯度99.0%,CAS号:21259-20-1)、伏马毒素B1(纯度99.0%,CAS号:116355-83-0)、伏马毒素B2(纯度99.0%,CAS号:116355-84-1)、脱氧雪腐镰刀菌烯醇(纯度99.9%,CAS号:51481-10-8)ROMER国际贸易有限公司;青霉酸(纯度99.0%,CAS号:90-65-3) 百灵威科技有限公司;杂色曲霉素(纯度99.0%,CAS号:10048-13-2) 美国Sigma公司;乙腈、甲醇(均为色谱纯) 美国Thermo Fisher公司;甲酸(色谱纯) 德国CNW Technology GmbH公司;Oasis PRiME HLB固相萃取柱(6 mL/200 mg)美国Waters公司。实验用水为Milli-Q制备的超纯水。
1.2 仪器与设备
Acquity UPLC I-class超高效液相色谱系统、Xevo TQ-S三重四极杆质谱仪(配有电喷雾离子源及Masslynx 4.1 SCN803软件系统) 美国Waters公司;Milli-Q纯水仪美国Millipore公司;3K18高速冷冻离心机 美国Sigma公司。
1.3 方法
1.3.1 标准溶液的配制
各标准品于10 mL棕色容量瓶中用甲醇溶解,并定容到刻度,配制成1 000 μg/mL的标准储备液,转入棕色样品瓶中于-20 ℃保存,有效期3 个月。
1.3.2 样品前处理
称取5.00 g样品于离心管中,加入10 mL 0.1%酸化乙腈,涡旋振荡3 min至充分混匀,超声5 min后,于4 ℃、10 000 r/min离心5 min,取上清液2 mL过PRiME HLB固相萃取柱,1 mL乙腈淋洗,收集全部流出液,40 ℃氮气吹至近干,0.1%甲酸溶液-甲醇(1∶1,V/V)1 mL复溶,过0.22 μm滤膜,待仪器分析。
1.3.3 液相色谱条件
色谱柱:Waters Acquity UPLC HSS T3(100 mm×2.1 mm,1.8 μm);流速0.3 mL/min;柱温40 ℃;流动相:A为乙腈,B为0.1%甲酸溶液;梯度洗脱条件:0~2.00 min 5%~25% A,2.00~6.00 min 25%~60% A,6.00~7.00 min 60%~95% A,7.00~8.00 min 95% A,8.00~9.00 min 95%~5% A,9.00~12.00 min 5% A;进样量10 μL,进样温度10 ℃。
1.3.4 质谱条件
电喷雾离子源;多反应监测模式(multiple-reaction monitoring,MRM)正离子模式;毛细管电压2.00 kV;离子源温度150 ℃;锥孔气流量150 L/h;脱溶剂气温度350 ℃;脱溶剂气流量650 L/h。14 种真菌毒素的色谱及质谱采集参数见表1。
表1 14 种真菌毒素的色谱及质谱采集参数Table 1 Chromatographic and spectral acquisition parameters for the determination of 14 mycotoxins
2 结果与分析
2.1 色谱-质谱分析
2.1.1 流动相的选择
考察采用甲醇或乙腈为流动相A,水或0.1%甲酸溶液或5 mmol/L乙酸铵为流动相B对14 种真菌毒素测定的影响。结果表明:选择流动相为乙腈和0.1%甲酸溶液能明显提高目标峰的信号强度,化合物的峰形得到了很好的改善,其中不同的流动相B对化合物的色谱峰优化效果比较明显,因为14 种真菌毒素在电喷雾离子源正离子模式生成加氢离子,当流动相中加入0.1%甲酸时,化合物基团结合质子带正电荷,在电喷雾离子源正离子模式下就很容易得到加氢离子,能有效提高离子化效率;加入0.1%甲酸还能调节溶液的pH值,以改善化合物的峰形,有效防止峰拖尾。图1为不同流动相B条件下脱氧雪腐镰刀菌烯醇、伏马毒素B2、青霉酸3 种化合物的色谱图。
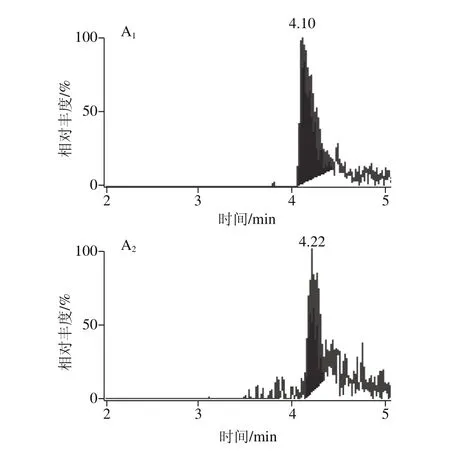
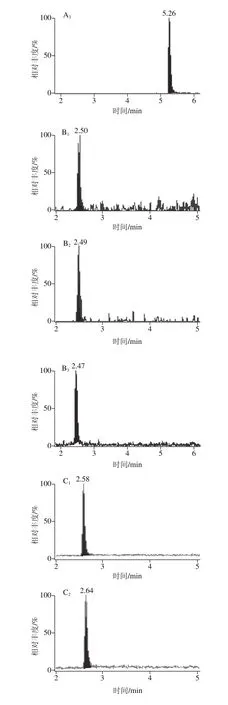
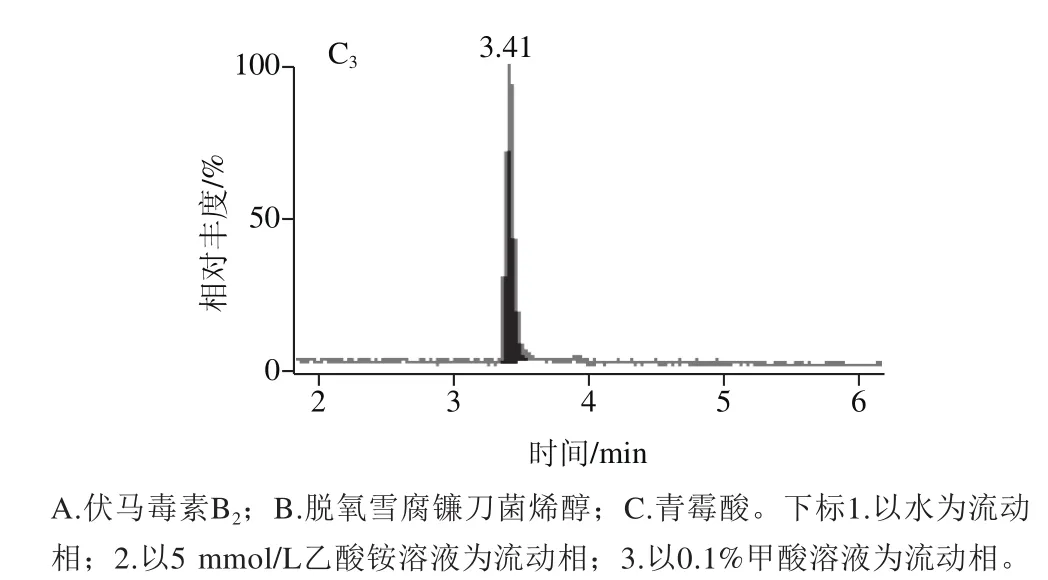
图1 不同流动相的MRM色谱图Fig. 1 MRM chromatograms with different mobile phases
2.1.2 色谱柱的选择
考察Waters UPLC HSS T3(100 mm×2.1 mm,1.8 μm)、Waters UPLC BEH C18(100 mm×2.1 mm,1.7 μm)两种常用类型的色谱柱对14 种真菌毒素测定的影响。结果表明:两种色谱柱对14 种真菌毒素的分离效果没有很大的优势区别,但Waters UPLC HSS T3色谱柱的色谱图基线噪音较低,目标物色谱峰的信号强度较高,故实验选择Waters UPLC HSS T3(100 mm×2.1 mm,1.8 μm)色谱柱作为分析柱。图2为两种色谱柱中14 种真菌毒素的提取总离子流图。
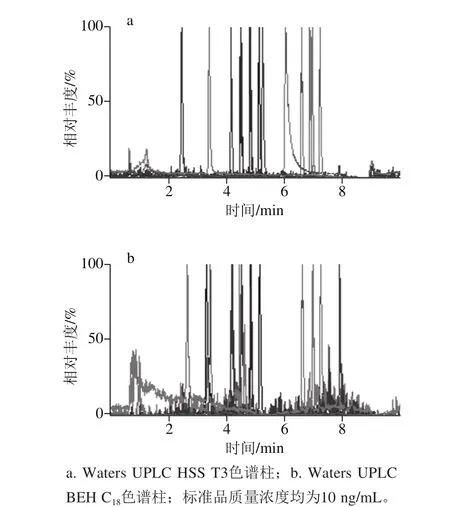
图2 14 种真菌毒素的总离子流色谱图Fig. 2 Total ion current chromatograms of 14 mycotoxins on different columns
2.1.3 母离子和子离子的选择
取100 ng/mL的各化合物标准溶液放在蠕动泵进样器上,设定流动相速率为0.1 mL/min,蠕动泵流速20 μL/min,混合模式进样,调节毛细管电压、锥孔电压、脱溶剂气的温度、脱溶剂气的流速、锥孔气流速等质谱参数,尽可能得使目标物响应信号达到最高。
使用仪器软件自动调谐功能为每个母离子自动筛选出最佳的锥孔电压和碰撞电压从而得到在该碎裂条件下的2 个子离子。对得到的子离子结合化合物的结构式和碎裂规律[25-27]进行再次分析,以验证仪器自动筛选的子离子功能的准确性。
2.2 前处理方法的优化
2.2.1 提取溶剂的优化
快速测定液态乳中14 种真菌毒素需要通用、快速、回收率效果好的前处理方法,本研究考察的前处理方法需要能有效净化基质中的干扰。取质量浓度为50 ng/mL的真菌毒素混合标准溶液,以大梯度流动相比例条件下,使用Waters UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱分离,超高效液相色谱-串联质谱仪进样,根据色谱的分离原理,在反相液相色谱中,固定相是非极性或弱极性的,而流动相是极性的,因此极性强的组分易溶于流动相先出柱,极性弱的组分与固定相结合较紧密后出柱。按保留时间对14 种真菌毒素的极性大小进行排序,分别为脱氧雪腐镰刀菌烯醇、青霉酸、黄曲霉毒素M1、黄曲霉毒素G2、橘霉素、黄曲霉毒素G1、黄曲霉毒素B2、黄曲霉毒素B1、伏马毒素B1、赭曲霉毒素A、伏马毒素B2、T-2毒素、玉米赤霉烯酮、杂色曲霉素,再结合14 种化合物的化学结构分析其键的极性和键在空间分布的对称性验证各化合物极性大小的准确性,最终结果一致。选取14 种真菌毒素中极性有较大差异的脱氧雪腐镰刀菌烯醇、橘霉素、伏马毒素B1、玉米赤霉烯酮4 种化合物作为依据,样品在相同加标量10 μg/kg的情况下,分别考察乙腈、0.1%酸化乙腈、甲醇不同提取液的回收率,结果如图3所示。
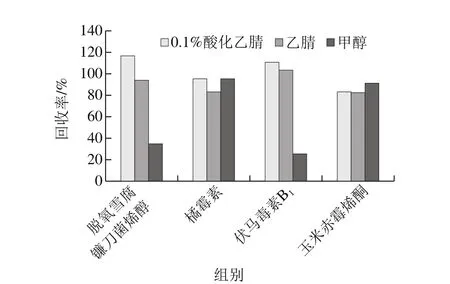
图3 不同提取溶剂的回收率Fig. 3 Comparison of mycotoxin recoveries with different extraction solvents
实验过程中发现,乙腈和甲醇分别作为提取溶剂时,乙腈能有效沉淀液态乳中的蛋白质等大分子物质,同时前处理过程中还采取4℃冷冻高速离心,沉淀效果明显,甲醇则无明显沉淀现象,提取回收率较差,故不做考虑。如图3所示,使用0.1%酸化乙腈作为提取溶液时,脱氧雪腐镰刀菌烯醇、橘霉素、伏马毒素B1、玉米赤霉烯酮均可以达到较好和较为稳定的回收率。
2.2.2 净化条件的优化
样品在使用相同提取试剂和相同加标量10 μg/kg的条件下,以总体回收率较差的脱氧雪腐镰刀菌烯醇、T-2毒素、伏马毒素B2、青霉酸4 种化合物作为依据,分别考察QuEChERS 5982-5650(4 g MgSO4,1 g NaCl,1 g柠檬酸钠,0.5 g三水合二柠檬酸二钠)、Oasis PRiME HLB固相萃取柱、C18固相萃取柱、MycoSep 227多功能净化柱共4 种净化条件的效果比较。回收率结果和净化效果对比如图4和图5所示。

图4 回收率结果对比图Fig. 4 Comparison of mycotoxin recoveries with different cleanup columns
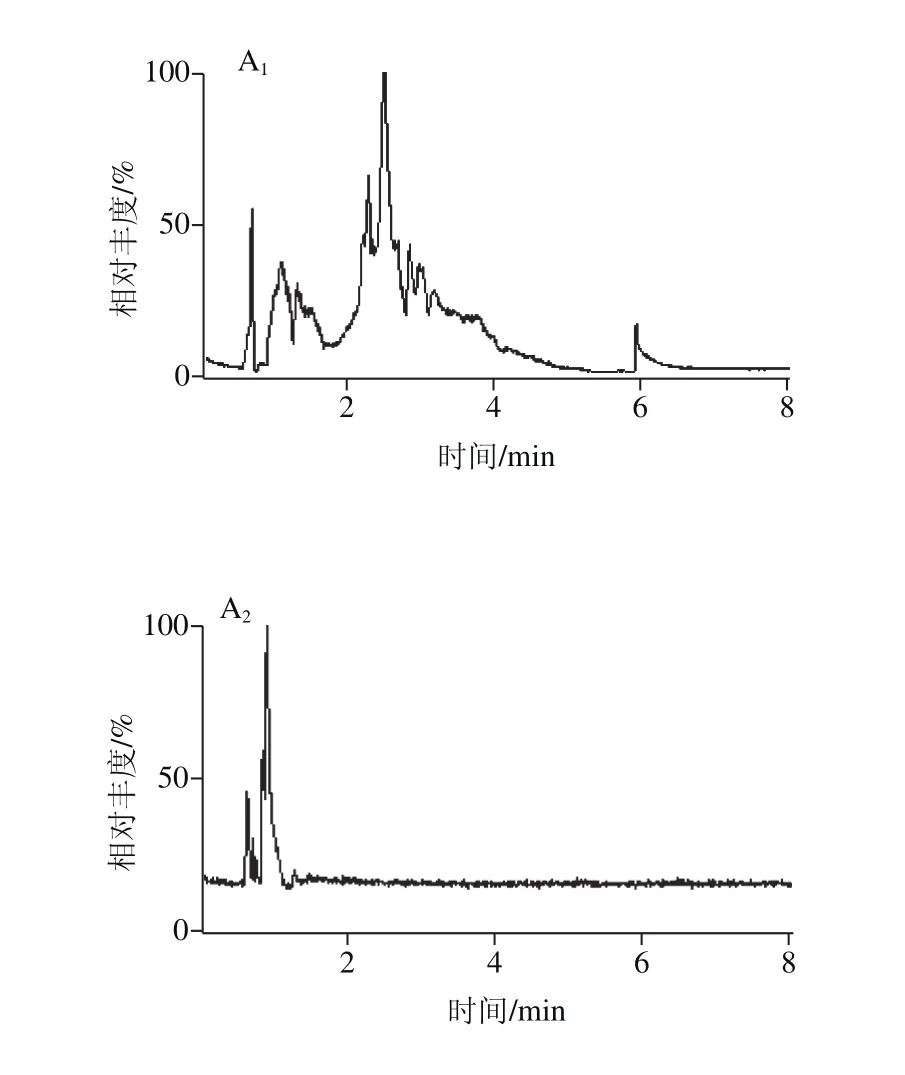

图5 不同净化方式对磷脂净化效果的比较Fig. 5 Comparison of different methods for the cleanup of phospholipids
净化过程中发现,C18固相萃取柱和MycoSep 227多功能净化柱操作复杂且流速较慢,回收率没有明显的优势,故不做考虑。QuEChERS是一种基质分散固相萃取技术,利用吸附剂填料与基质中的杂质相互作用,吸附杂质从而达到除杂净化的目的,这种净化模式和pass-through净化很相似,但是基质分散固相萃取是一阶净化(理论塔板数为1),而pass-through净化是多阶净化,且QuEChERS方法的回收率低于Oasis PRiME HLB固相萃取柱;Oasis PRiME HLB吸附剂可以吸附样品中非极性干扰物而不影响任务目标物的回收率,特别是对于液态乳中含有的卵磷脂、脑磷脂和神经鞘磷脂等基质干扰物[28-29],去除效果明显,降低基质效应的影响,其特殊设计的筛板、填料以及制作工艺,使得溶液流速更顺畅更快速,节省时间和溶液,从而达到用简便的过滤式样品制备流程实现洁净样品净化的目的。如图4和图5所见,样品使用Oasis PRiME HLB固相萃取柱净化处理后,基质干扰物少,回收率稳定且高于其他3 种。
2.2.3 复溶溶液的选择
当选择流动相0.1%甲酸溶液-乙腈(1∶1,V/V)作为复溶溶液时,个别化合物的峰形差,灵敏度降低,而选择0.1%甲酸溶液-甲醇(1∶1,V/V)作为复溶溶液时,化合物的峰形较好,灵敏度有所提高,能够准确定性和定量,对脱氧雪腐镰刀菌烯醇这个化合物尤为明显,因为甲醇是供质子溶剂,促进了脱氧雪腐镰刀菌烯醇酚羟基邻位上的甲氧基在溶液中的电离平衡向分子方向移动,使得溶液中分子状态的脱氧雪腐镰刀菌烯醇增多,响应增强,灵敏度提高[30-31],故选择0.1%甲酸溶液-甲醇(1∶1,V/V)作为复溶溶液。图6为不同复溶溶液的14 种真菌毒素色谱图。
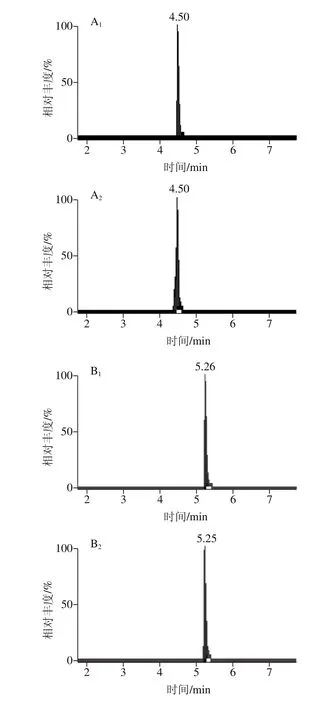
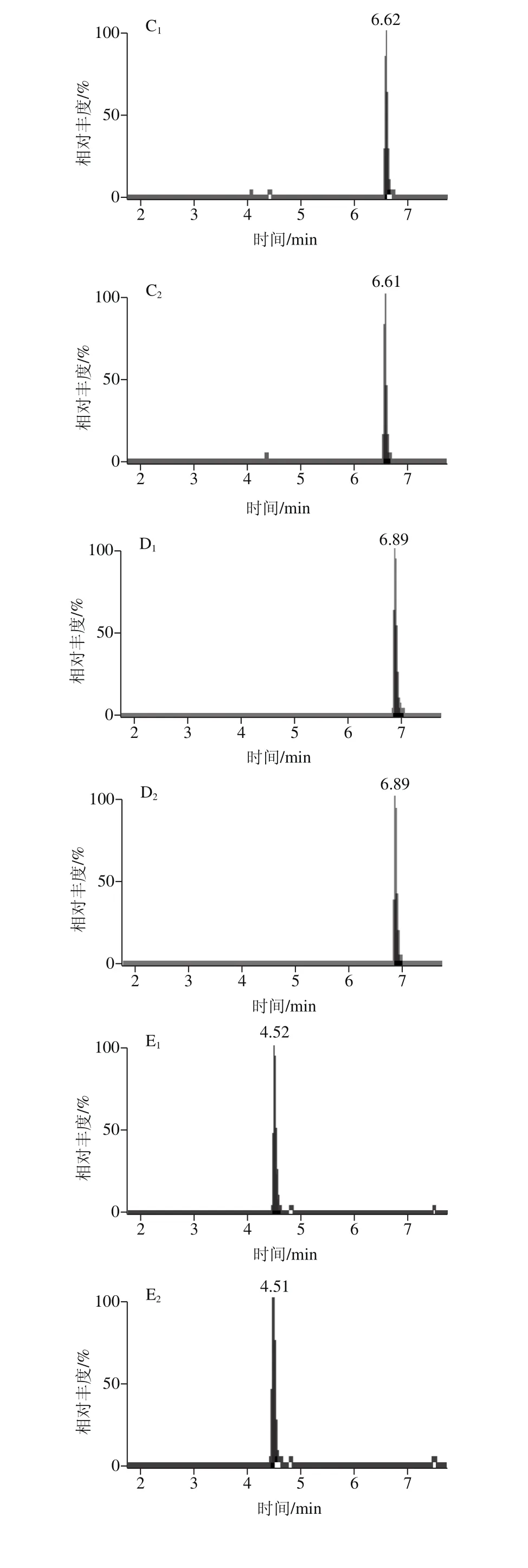

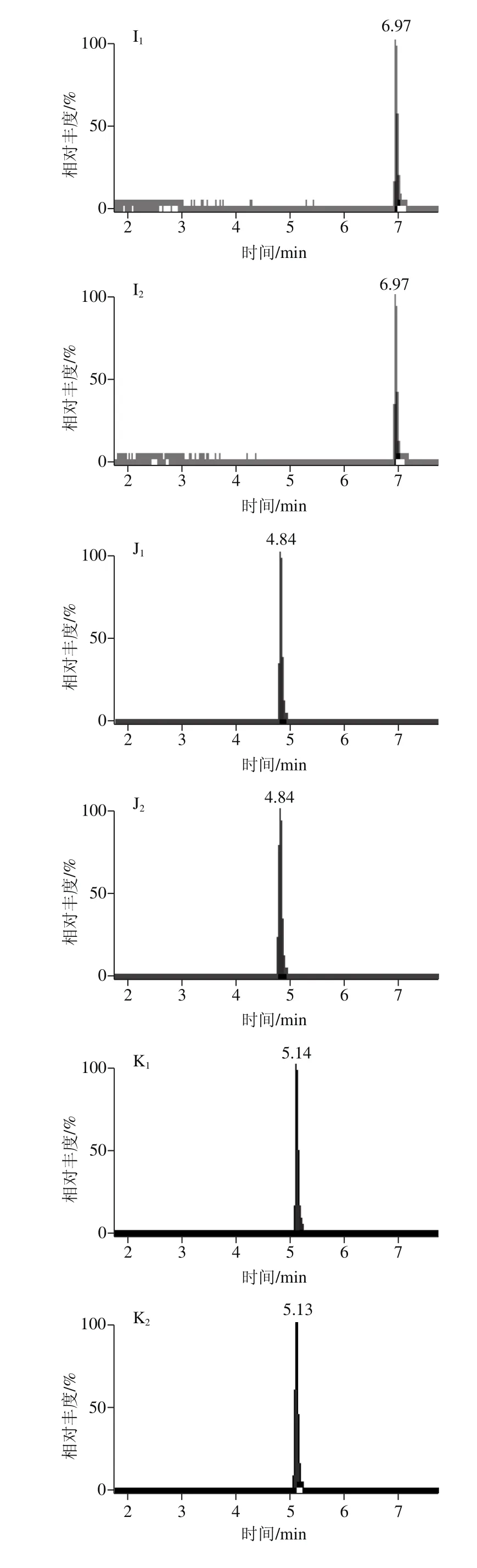
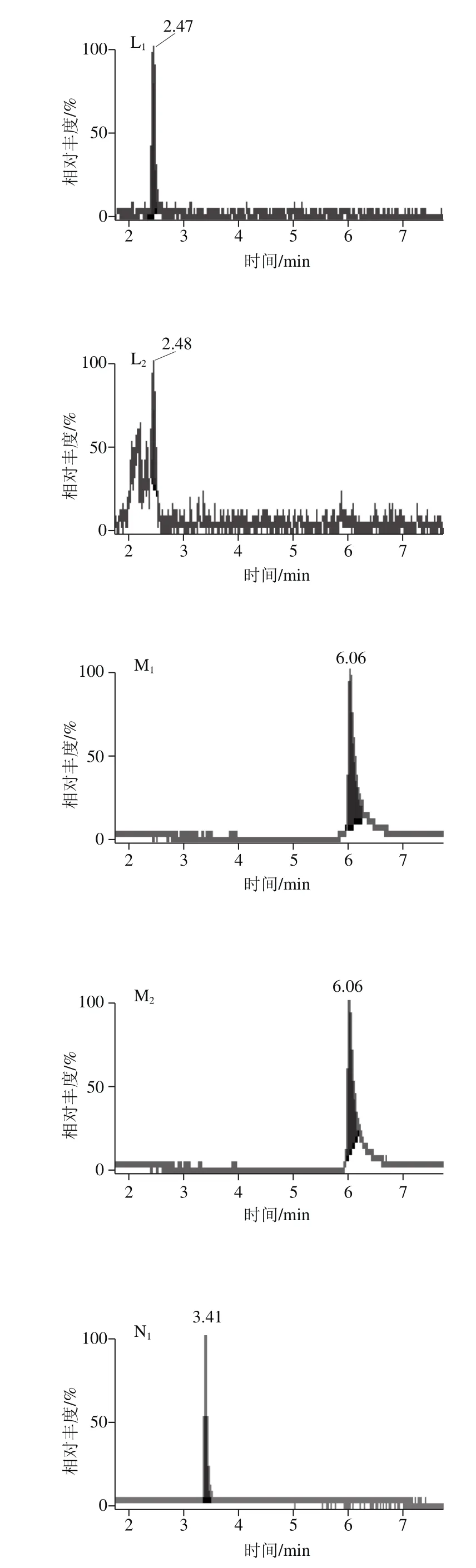
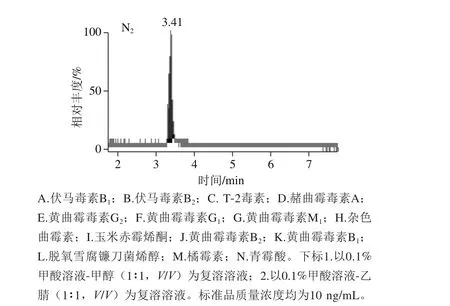
图6 不同复溶溶液的14 种真菌毒素MRM色谱图Fig. 6 MRM chromatograms of 14 mycotoxins dissolved in different solvents
综上所述,使用0.1%酸化乙腈作为提取溶剂,Oasis PRiME HLB固相萃取柱作为净化方法,0.1%甲酸溶液-甲醇(1∶1,V/V)作为复溶溶液可以达到14 种真菌毒素较好的前处理提取净化效果,目标化合物的回收率均在80%以上。
2.3 方法学验证
2.3.1 标准曲线的绘制
根据14 种真菌毒素响应的强弱,配制不同的系列质量浓度的混合标准工作溶液,14 种化合物的线性范围由0.5~100 ng/mL,相关系数均大于0.99。线性方程、相关系数和线性范围见表2。

表2 14 种真菌毒素的线性方程、相关系数、线性范围Table 2 Liner equations, correlation coefficients and liner ranges for 14 mycotoxins
2.3.2 方法的灵敏度和精密度
根据GB/T 2761—2017《食品中真菌毒素限量》,液态乳中黄曲霉毒素M1的限量值为0.5 μg/kg,参考GB/T 27404—2008《实验室质量控制规范 食品理化检测》附录F检测方法确认的技术要求中有关方法灵敏度、回收率和精密度的实验要求。研究液态乳中14 种真菌毒素测定方法的定量限及回收率。取空白样品,添加不同系列水平的混合标准溶液,绘制基质加标工作曲线。在基质中加入不同量的混合标准溶液,制成加标阳性样品,进行前处理,将得到的样品上机检测,得到信噪比不低于10的目标化合物的最低加标浓度,即为本方法在基质中的定量限。取空白基质,3 个不同水平的加标量,其中黄曲霉毒素M1取定量限、最高残留量及其他任意浓度水平点进行加标;其他未规定有最高残留量的真菌毒素,取1、2、10 倍定量限进行加标。经过前处理并上机检测,每个水平做6 组平行实验,计算回收率及相对标准偏差。方法定量限、回收率和相对标准偏差见表3。3 个添加水平时,平均回收率为67.7%~112.7%,相对标准偏差为0.43%~7.28%。

表3 14 种真菌毒素的方法定量限、回收率和相对标准偏差Table 3 LOQs, recoveries and RSDs of 14 mycotoxins
2.4 方法应用
应用本方法对随机抽取的液态乳样品进行了测定,共计50 个样品,同时做11 个质控样品。在11 个质控样品中检出了真菌毒素的残留,其余样品均未检出,结果见表4。
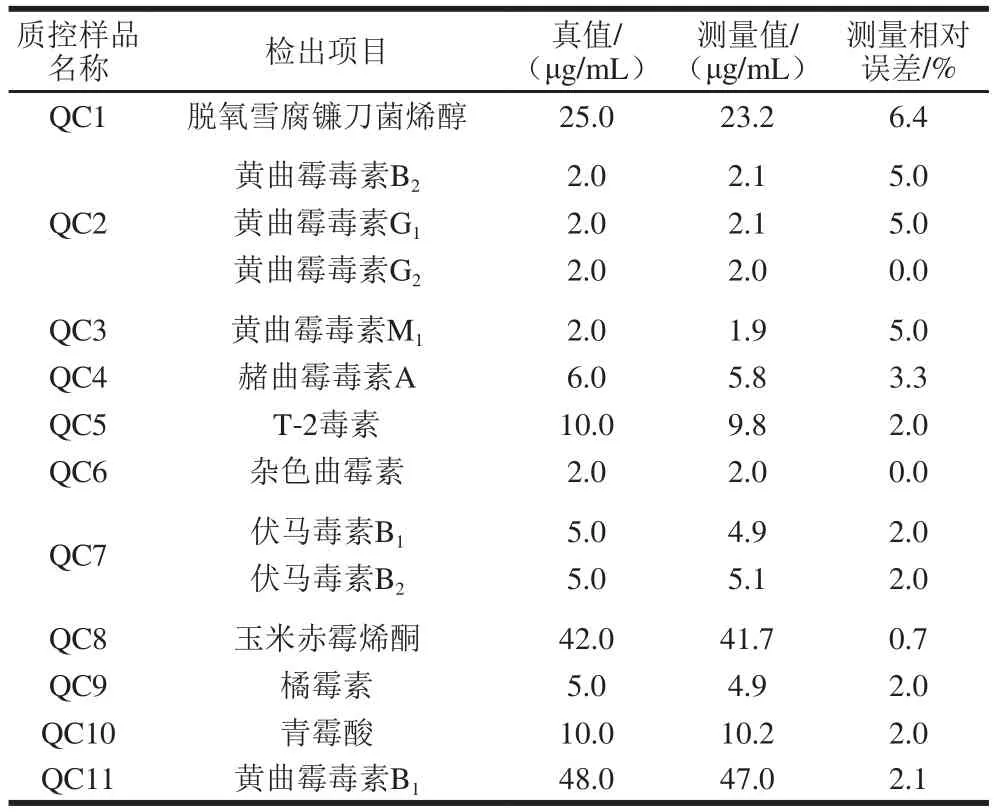
表4 11 个质控样品中真菌毒素的残留结果Table 4 Contents of mycotoxins in 11 quality control samples determined by the method developed in this study
3 结 论
本实验利用固相萃取柱Oasis PRiME HLB的有效净化手段,结合超高效液相色谱-串联质谱法研究建立了液态乳中14 种真菌毒素的测定方法,该方法准确、快捷,并且进行了方法学验证和实际样品的应用,结果表明:14 种真菌毒素的定量限(RSN≥10)为0.5~5 μg/kg,高、中、低3 个添加水平条件下,平均回收率为67.7%~112.7%,相对标准偏差为0.43%~7.28%,实际样品的测量相对误差为0.0%~6.4%,可实现液态乳中14 种真菌毒素的同时定性和准确定量分析,适合用于液态乳中安全风险突发事件的快速应急处置工作,能够为企业及相关安全监管部门提供有利的技术支撑。

