沉默ERRα对Bak1、Bcl2腺病毒转染骨细胞的影响研究
黄佳纯,柴爽,黄宏兴,汪悦东
(1.广州中医药大学,广东 广州 510006;2.广州中医药大学第三附属医院,广东 广州 510240)
雌激素对妇女骨骼所具有的重要作用众所周知,雌激素水平的下降加速了骨质流失并增加了骨质疏松症发展的可能性[1]。儿童期时雌激素主要作用于骨骺的融合,到了成年期则用于维持骨小梁骨量结构[2]。有研究[3]发现,骨质疏松症患者的B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2)表达下降,老年大鼠的Bcl2蛋白水平亦有所降低[4],骨质疏松症与性别、年龄相关,其发生与雌激素的缺乏和衰老的关系密切。本实验前期研究[5]表明,Bcl2基因沉默后MG63细胞存活率降低,而Bak1基因沉默后MG63细胞存活率升高,表明Bcl2/Bak1在调控MG63细胞凋亡平衡当中发挥重要作用,Bcl2基因沉默后MG63细胞碱性磷酸酶(alkaline phosphates,ALP)表达降低,而Bak基因沉默的MG63细胞ALP表达增强,说明Bcl2/Bak在调节成骨活动中起到了重要作用。本文在此基础上,进一步探讨雌激素相关受体α(estrogen-related receptor alpha,ERRɑ)与Bcl2家族蛋白对骨质疏松症的作用影响,现报道如下。
1 资料与方法
1.1 主要试剂和仪器 人成骨肉瘤细胞(MG63)由中国科学院上海细胞所细胞库提供,Opti-MEM培养基、胎牛血清、DMEM培养基、Pen/Strep从Gibco公司购买;Bak1(D4E4) Rabbit mAb、Bcl2(50E3) Rabbit mAb、ERRɑ(E1G1J) Rabbit mAb均自CST公司购入;HRP-Goat Anti-Mouse IgG、HRP-Goat Anti-Rabbit IgG均从Jackson公司购入;逆转录试剂盒、荧光定量PCR试剂盒、Lipofectamine 2000、TRIzol Reagent、One Shot®Stbl3TM E.coli感受态细胞、bP Clonase Ⅱ enzyme mix、LR Clonase Ⅱ enzyme mix、Taq DNA聚合酶均购自Invitorgen公司;Age Ⅰ、EcoR Ⅰ、Pac Ⅰ、T4 DNA连接酶购自NEb公司;MTT、RIPA细胞裂解液、EGTA均购自Sigma公司;DMSO购自广州化学试剂厂;Calcium Indicators购自Molcular Probes公司;蛋白酶抑制剂/磷酸化抑制剂均于Merck公司购买;抗骨形态发生蛋白4(bone morphogenetic protein-4,BMP-4)抗体、抗骨桥蛋白(osteopontin,OPN)抗体、抗Runt相关转录因子2(runt-related transcription factor 2,Runx2)抗体、抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-ɑ)抗体于abcam公司购入;抗结缔组织生长因子(connective tissue growth factor,CTGF)抗体购自Santa公司;胶回收/纯化试剂盒、质粒提取试剂盒均购自北京天根生物有限公司;DH5ɑ感受态细胞购自北京鼎国生物有限公司;蛋白酶K购自上海碧云天生物有限公司;三氯甲烷、异丙醇、无水乙醇等均为国产分析纯试剂。超净工作台(SW-CJ-1FD 中国江苏苏净);细胞培养箱(DHP-9052 中国上海-恒);电泳仪、电转仪、蛋白转印仪、凝胶成像系统(伯乐);普通PCR仪(TCS 中国博日);荧光定量PCR仪(AbI 7500 美国Thermo);酶标仪(美国Thermo);倒置荧光显微镜(IX73 美国OLYMPUS);微孔板震荡器(Scientific industries);高速低温离心机(beckMan-22R);微量核酸定量仪(Thermo NanoDrop)。
1.2 方法
1.2.1 细胞培养和总RNA提取 MG63细胞以1×106细胞/mL接种于T75,于5% CO2、饱和湿度下在DMEM高糖培养基中培养。待长至约80%融合时消化、收集细胞,传代。舍弃旧培养基,以预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞3次,尽可能吸尽液体后加入1 mLTrizol破碎溶解细胞,提取总RNA,逆转录合成cDNA。
1.2.2 目的基因沉默重组腺病毒载体构建 ERRɑ沉默重组腺病毒载体(Ad-shERRɑ)构建:经逆转录反应、聚合酶链式反应(polymerase chain reaction,PCR)扩增目的基因、重组质粒构建、同源重组构建重组腺病毒质粒、重组腺病毒颗粒的包装、重组腺病毒滴度测定、重组腺病毒感染MG63细胞,实时荧光定量核酸扩增检测系统(real-time quantitative PCR detecting system,qPCR)检测Ad-shERRɑ重组腺病毒感染MG63后ERRɑ的表达以确定ERRɑ沉默重组腺病毒载体构建成功。
Bak1及Bcl2沉默重组腺病毒载体(Ad-shBak1、Ad-shBcl2)构建:构建shRNA腺病毒载体并用其转染MG63细胞,筛选出shRNA腺病毒载体沉默效率最好的进行逆转录反应及定量PCR反应,通过Western blot检测shRNA腺病毒质粒沉默效率后进行腺病毒包装。
1.2.3 细胞转染 MG63细胞培养24 h后,感染空载病毒组命名为NC对照组,感染Bak1和ERRɑ沉默重组腺病毒命名为Ad-shERRɑ+Ad-shBak1组,感染Bcl2和ERRɑ沉默重组腺病毒命名为Ad-shERRɑ+Ad-shBcl2组,同时感染Bak1、Bcl2和ERRɑ沉默重组腺病毒命名为Ad-shERRɑ+Ad-shBak1+shBcl2组四组,感染复数(MOI)为50。重组腺病毒感染48h后,分别消化收集细胞,qPCR、Western blot检测ERRɑ、Bcl2、Bak1在MG63细胞中的表达,以确定过表达重组腺病毒感染MG63后ERRɑ、Bcl2、Bak1基因发生转录。qPCR实验结果利用AbI7500公司自带的PCR系统软件分析,观察扩增曲线,分别计算出各组样本的结果并进行组间比较。
1.2.4 细胞增殖、ALP活性、钙离子浓度检测 MG63细胞感染重组腺病毒48h后,弃旧培养基,消化收集细胞,分别采用MTT法检测MG63细胞增殖,用酶标仪490 nm测定光密度值(OD)。ALP活性的测定:MG63细胞感染重组腺病毒48 h后,收集对数期MG63细胞制成细胞悬液,每孔加入2 mL细胞悬液后置于37℃,5% CO2,饱和湿度条件下培养24 h,于冰上放置考马斯亮蓝蛋白定量后测定ALP活性。细胞钙离子浓度的检测:消化、收集细胞,PBS洗涤3次。取细胞悬液,加入Calcium Orange Indicator,置细胞培养箱中孵育1 h上机,加入10% Triton 100后再加入CaCl2,吹打均匀,避光孵育10 min,测定荧光值。
1.2.5 骨调节蛋白BMP-4、CTGF、OPN、Runx2、TNF-ɑ检测 MG63细胞感染重组腺病毒48 h后,舍弃旧培养基,消化收集细胞,离心,提取总蛋白,样品蛋白处理后测定蛋白浓度,上样、电泳、转膜,封闭,一抗4℃孵育过夜后在室温下洗涤3次,室温下二抗孵育后洗涤3次,将膜蛋白放入暗匣中曝光进行显影和定影,化学发光显色后使用Image J软件处理系统分析各组目标蛋白带的光密度值进行图像分析。

2 结 果
2.1 Ad-shERRɑ、Ad-shBak1、Ad-shBcl2对各组MG63细胞增殖、ALP活性、钙离子浓度的影响结果(见表1,见图1) 与NC对照组比较,(Ad-shERRɑ+Ad-shBak1)组细胞活性、ALP活性明显升高,钙离子浓度明显降低,差异有统计学意义(P<0.01);(Ad-shERRɑ+Ad-shBcl2)组细胞活性、ALP活性均降低,钙离子浓度明显升高,差异有统计学意义(P<0.01);(Ad-shERRɑ+Ad-shBak1+shBcl2)组的钙离子浓度降低(P<0.01),细胞活性、ALP活性亦下降,但差异不明显(P>0.05)。与(Ad-shERRɑ+Ad-shBak1)组比较,(Ad-shERRɑ+Ad-shBcl2)组与(Ad-shERRɑ+Ad-shBak1+shBcl2)组细胞活性、ALP活性明显下降,钙离子浓度明显升高,差异有统计学意义(P<0.05)。与(Ad-shERRɑ+Ad-shBcl2)组比较,(Ad-shERRɑ+Ad-shBak1+shBcl2)组的细胞活性、钙离子浓度降低,差异有统计学意义(P<0.01),ALP活性稍升高但差异无统计学意义(P>0.05)。
2.2 Ad-shERRɑ干预Bak1、Bcl2重组腺病毒转染的各组MG63细胞中骨调节蛋白的影响结果(见表2,见图2~3) 与NC对照组比较,(Ad-shERRɑ+Ad-shBak1)组BMP-4、TNF-ɑ均降低,而CTGF、OPN、Runx2均升高,差异有统计学意义(P<0.05);(Ad-shERRɑ+Ad-shBcl2)组BMP-4、CTGF、OPN、Runx2均降低,而TNF-ɑ升高,差异有统计学意义(P<0.01);(Ad-shERRɑ+Ad-shBak1+shBcl2)组BMP-4、CTGF、OPN、Runx2、TNF-ɑ均降低,差异有统计学意义(P<0.05)。与(Ad-shERRɑ+Ad-shBak1)组比较,(Ad-shERRɑ+Ad-shBcl2)组和(Ad-shERRɑ+Ad-shBak1+shBcl2)组CTGF、OPN、Runx2和(Ad-shERRɑ+Ad-shBcl2)组BMP-4、TNF-ɑ均降低,而(Ad-shERRɑ+Ad-shBak1+shBcl2)组TNF-ɑ升高,差异有统计学意义(P<0.01),(Ad-shERRɑ+Ad-shBak1+shBcl2)组BMP-4虽亦降低但差异无统计学意义(P>0.05);与(Ad-shERRɑ+Ad-shBcl2)组比较,(Ad-shERRɑ+Ad-shBak1+shBcl2)组BMP-4、CTGF、OPN均升高,而TNF-ɑ降低,差异有统计学意义(P<0.01),Runx2基本持平,差异无统计学意义(P>0.05)。
3 讨 论
雌激素相关受体ERR分α、β、γ3种亚型,迄今仍未发现其相应配体,其中对ERRα在肿瘤、冠心病、糖尿病等疾病中的功能作用研究受到较大的关注[6]。雌激素相关受体ERR和雌激素受体ER的序列在DNA结合域上相似度高达68%,在配体结合E域等蛋白的其他部分仅36%的相似度,这也许是ERRα不能与雌激素结合的原因之一[7-8],但不少数据均强调了ERRα在调节骨代谢中的重要地位[9],Shoukry等[10]以200例绝经后骨质疏松症妇女和180例健康且年龄匹配的绝经后妇女作对照,通过AluI的PCR片段长度多态性,证明了ER-b AluI G/A和ERRa 23-重复多态性与骨密度(bone mineral density,BMD)的关联,说明了ER-b和ERRa多态性可能对sRANKL水平产生影响。Huang等[11]的研究也表明了ERRα/Gls信号通路在MSCs成骨分化中发挥重要作用。近些年来,ERRα在绝经后骨质疏松发生发展中的地位逐步被提高,其有望成为防治骨质疏松症的新靶点[12]。
B细胞淋巴瘤2家族蛋白介导内源性凋亡通路[13],根据家族内各蛋白的功能和结构可将其分成三个主要亚家族:4指Ad-shBcl2+Ad-shBak1组抗凋亡BCL2蛋白(BCL2,MCL1,BCLxL,BCLW,BFL1),促凋亡效应因子(BAK,BAX,BOK)和促凋亡蛋白BH3[14],BCL2家族成员不仅能调控线粒体的凋亡,还能通过对Ca2+信号的调节而诱导细胞凋亡[15-16]。Song等人[3]发现与年轻大鼠相比,老年大鼠Bcl2蛋白水平降低了20%,并且老年大鼠的Bax蛋白水平比年轻大鼠高11%。国内刘嘉眉等[4]检测绝经后妇女患者髋关节置换手术中取下股骨头或股骨颈中松质骨成骨细胞中Caspase蛋白和Bcl2蛋白,发现骨质疏松症组中Bcl2表达下降,即骨质疏松症组中细胞凋亡情况较对照组严重。国内外的研究均表明,衰老或患骨质疏松症都会降低Bcl2的表达量。
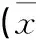
表1 Ad-shERRɑ干预Bak1、Bcl2重组腺病毒转染的各组MG63细胞增殖、ALP、钙离子浓度影响±s)

表2 Ad-shERRɑ干预Bak1、Bcl2重组腺病毒转染的各组MG63细胞中骨调节蛋白的影响±s,c/(μmol·L-1)]

图1 各组MG63细胞增殖、ALP活性、钙离子浓度检测结果(GraphPad prism 5)

注:1指NC对照组;2指Ad-shBcl2组;3指Ad-shBak1组;
图2 各组MG63细胞中(BMP-4、CTGF、OPN、Runx2、TNF-ɑ)蛋白灰度分析(凝胶电泳法)
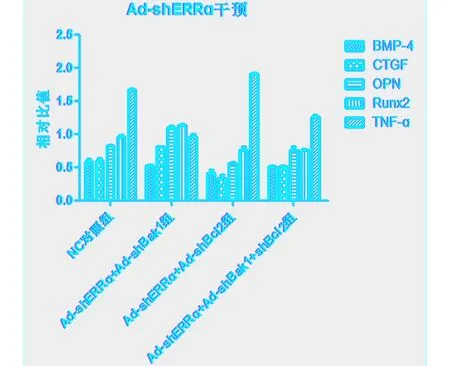
图3 各组MG63细胞中BMP-4、CTGF、OPN、Runx2、TNF-ɑ检测结果
骨形态发生蛋白的表达对于骨骼的发育重塑至关重要[17],有研究[18]表明,BMP4可促进骨组织愈合时的血管生成和骨的再生,还可诱导间充质干细胞向成熟的软骨细胞分化,增多软骨的细胞外基质,有助于骨和软骨组织的修复[19]。结缔组织生长因子是一种细胞外基质分泌蛋白,可促进体外培养的破骨细胞前体细胞增殖,促进其分化为成熟多核破骨细胞,使破骨细胞的骨吸收功能被激活[20],Hendesi等[21]实验说明,CTGF通过αvβ1整合素增强成骨细胞黏附,通过对细胞骨架的重组和Rac1的激活促进成骨细胞分化。骨桥蛋白可参与各种生物活动包括基质重组和组织钙化,产生各种促炎细胞因子和趋化因子,以及抑制细胞凋亡活动,在骨的形态发生和重塑上起着重要作用[22]。有体外实验[23]表明,Runx2在未成熟成骨细胞达到了最高的表达水平,而在成骨细胞成熟时表达减少了。体内实验[24]说明,Runx2基因敲除的小鼠骨形成减少而导致骨质下降。肿瘤坏死因子α是一种强大的破骨细胞激活因子,是骨代谢和骨重塑的重要调节因子,可以刺激破骨细胞的分化,属于骨吸收因子。TNF-α可降低成骨细胞分化的特殊标志物,还可以调控BMP-2的表达,可抑制成骨细胞的分化[25]。Liao等[26]实验证明,TNF-α诱导的细胞氧化应激是通过增加活性氧簇(reactive oxygen species,ROS)的合成速率和降低ROS的消除速率来实现的。综上所述,BMP-4、CTGF、OPN、Runx2、TNF-α蛋白的表达均与成骨细胞的增殖分化息息相关。
本实验前期研究表明[5],沉默Bak1基因后MG63细胞细胞活性升高,成骨活动增加,细胞内钙离子浓度降低,沉默Bcl2基因后MG63细胞细胞活性降低,成骨活动减少,钙离子浓度升高,而Bak1+Bcl2联合沉默组与对照组在各观察指标上差异无统计学意义。本实验研究中用沉默Bak1、Bcl2腺病毒载体转染MG63细胞,再用沉默ERRα进行干预,进一步研究不同组别MG63细胞的增殖、ALP活性、钙离子浓度和相关蛋白的情况。实验结果表明,沉默ERRα的干预能提高Bak1沉默腺病毒转染MG63细胞活性,降低细胞钙离子浓度,促进BMP4、CTGF、OPN、Runx2等蛋白的表达和抑制TNF-α的表达,且能降低Bcl2沉默腺病毒转染MG63细胞活性,升高细胞钙离子浓度,抑制BMP4、CTGF、OPN、Runx2等蛋白的表达和促进TNF-α的表达;而对于被沉默Bak1、Bcl2同时转染的MG63细胞,其细胞钙离子浓度和蛋白表达量均降低,对细胞活性的影响不明显。BMP4、CTGF、OPN、Runx2为促成骨蛋白,TNF-α可削弱成骨分化,结合本实验及前期研究[5]可说明,ERRα的沉默可能间接减弱了雌激素对成骨的作用,进一步强调了雌激素相关受体在骨代谢中的地位。
2014 年美国国家骨质疏松症基金会的预防和治疗骨质疏松症临床医生指南[27]认为,人体99%的钙储量在骨骼中,当外源性钙供应不足时,骨组织从骨骼吸收出钙,释放到血液,以保持血清钙水平的恒定。胞内高浓度的Ca2+可激活Ca2+依赖性酶,使DNA发生断裂,细胞骨架破坏,最终诱导细胞凋亡[28]。绝经后的雌激素水平急速下降,使破骨细胞形成和成骨细胞凋亡的速度加快,从而导致骨流失[29],骨是Ca2+的重要储存场所,当骨量下降,Ca2+浓度升高,加速了骨细胞的凋亡,二者之间的相互作用或许是骨质疏松症发生的关键。Bcl2蛋白是钙信号的主要抑制因子之一[15-16],因此,ERRα和Bcl2基因与胞内Ca2+浓度间的关系是值得探讨的。
总之,此次研究证实了沉默ERRα对沉默Bak1、Bcl2腺病毒载体转染的MG63细胞增殖分化具有影响,这为诊治骨质疏松提供了新的思路。然而本实验存在一定局限,没能更深入探讨其具体作用方式,故需在此基础上对ERRα、Bak1、Bcl2三者间共同作用及与其他信号通路的联系进行进一步的研究和探讨。

