脑胶质瘤组织NPAS2时钟基因启动子区甲基化与预后的关系
杜权 董晓巧 俞文华 朱强 车志豪 王昊 杨定博 沈永锋 江力
脑胶质瘤是中枢神经系统常见的恶性肿瘤,其发病率高,预后不佳[1-3]。昼夜节律紊乱与肿瘤的发生、发展密切相关[4-5]。时钟基因编码的蛋白质可以调节昼夜节律[6-7]。研究表明,时钟基因启动子区甲基化可以改变目的基因表达状态,从而影响脑胶质瘤的生长[8-10]。NPAS2时钟基因属于抑癌基因,其蛋白表达低水平与结直肠癌预后不良相关[11],也预示着脑胶质瘤患者生存期缩短[12]。NPAS2时钟基因启动子区甲基化可以降低基因相关蛋白表达,参与帕金森病的发生、发展[13]。本研究通过检测脑胶质瘤NPAS2时钟基因启动子区甲基化状态,进而分析其与患者临床特征及预后的关系,现将结果报道如下。
1 对象和方法
1.1 对象 选取2005年6月至2010年6月本院行手术治疗的102例初发脑胶质瘤患者为研究对象。其中男63例,女39例;年龄>60岁42例,≤60岁60例;WHO分级:Ⅰ~Ⅱ级49例,Ⅲ~Ⅳ级53例;肿瘤部位:幕上86例,幕下16例;肿瘤全切除72例;术后辅助化疗56例;术后辅助放疗77例;肿瘤类型:星形细胞瘤68例,其他34例;肿瘤直径>5cm 32例,≤5cm 70例;术前卡氏评分(KPS)<80分60例,≥80分42例。所有患者均为汉族人,均未合并其他恶性肿瘤,其直系亲属均无胶质瘤病史。
1.2 指标检测 术中获取脑胶质瘤组织及癌旁正常组织,采用甲基化特异性PCR检测NPAS2时钟基因启动子甲基化状态。使用DNA组织提取试剂盒(规格250次,批号Z3105,美国Promega公司)提取基因组DNA,使用甲基化特异性PCR试剂盒(规格60次,批号EM101,美国Millipore公司)对基因组DNA进行亚硫酸氢钠修饰,修饰后的DNA进行PCR扩增。时钟基因的引物参照文献[13],产物于4%琼脂糖凝胶上进行电泳,在紫外仪下观察并记录结果。为了确定甲基化特异性PCR检测结果,以甲基转移酶处理的基因组DNA作为阳性对照,未经处理的基因组DNA作为阴性对照。
1.3 统计学处理 应用SPSS 19.0统计软件。计数资料用率表示,组间比较采用χ2检验。利用Kaplan-Meier法绘制生存曲线并计算患者5年总生存期,生存期以表示,采用log-rank检验分析生存差异;采用Cox比例风险回归模型分析影响5年总生存期的独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 脑胶质瘤组织与癌旁正常组织NPAS2时钟基因启动子区甲基化频率比较 脑胶质瘤组织NPAS2时钟基因启动子区甲基化频率为19.6%(20/102),与其癌旁正常组织甲基化频率5.9%(6/102)比较,差异有统计学意义(χ2=8.64,P<0.05)。
2.2 脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态与临床特征的关系 脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态与患者性别、年龄、肿瘤部位、肿瘤类型、肿瘤直径、术前KPS、肿瘤全切除、术后辅助放化疗等均无关(均P>0.05);但与WHO分级有关,Ⅲ~Ⅳ级脑胶质瘤组织NPAS2时钟基因启动子区甲基化频率明显高于Ⅰ~Ⅱ级脑胶质瘤组织,差异有统计学意义(P<0.05),见表 1。
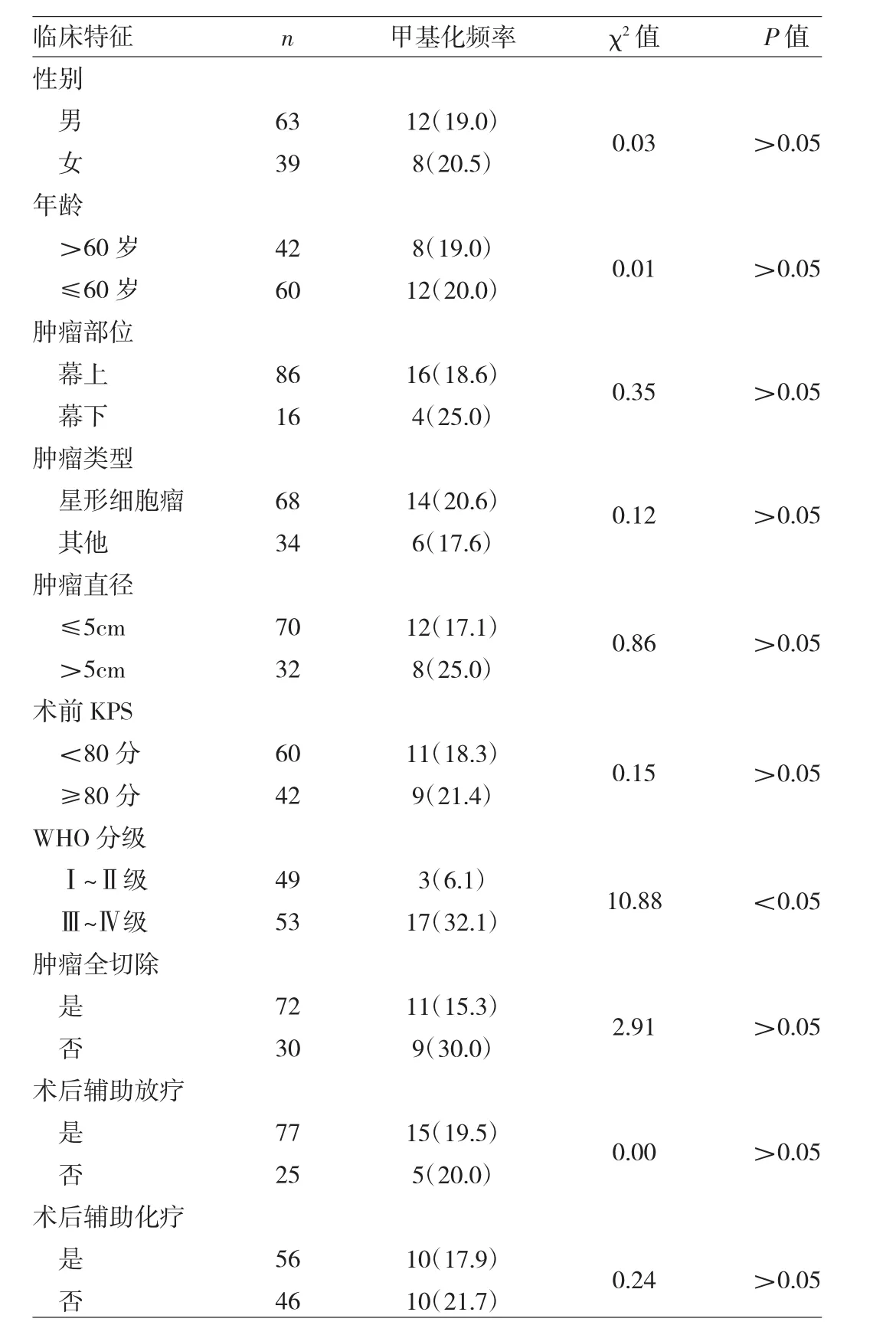
表1 脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态与临床特征的关系[例(%)]
2.3 脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态与5年总生存期的关系 脑胶质瘤患者5年总生存期为(30.4±2.0)个月,生存曲线见图1。患者5年总生存期与其肿瘤直径、术前KPS、WHO分级、肿瘤全切除、术后辅助放化疗、脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态均有关(均P<0.05),与性别、年龄、肿瘤部位、肿瘤类型均无关(均P>0.05),见表2。
2.4 影响5年总生存期的因素 经Cox比例风险回归模型分析,肿瘤全切除与否(HR=0.585,95%CI:0.353~0.969,P<0.05)、肿瘤直径(HR=1.970,95%CI:1.196~3.243,P<0.05)、WHO 分级(HR=1.786,95%CI:1.110~2.874,P<0.05)、脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态(HR=2.115,95%CI:1.223~3.656,P<0.05)是影响患者5年总生存期的独立危险因素。

图1 脑胶质瘤患者的生存曲线

表2 脑胶质瘤患者5年总生存期比较
3 讨论
昼夜节律是一种普遍的自然现象,它的存在使生物体的生理、生化、行为等生命现象表现为以24h为周期的振荡。昼夜节律发生的物质基础是分子计时器,即昼夜节律生物钟。它是由一组特异的核心元件组成,包括Clock、Bmal1、Pers、Crys、Tim 等基因及其相关蛋白产物。生物节律的基本分子机制是这些核心元件构成的转录-翻译负反馈环。这个机制本质上是内源性的,但同时会受环境信号的导引,尤其是光信号。哺乳动物的主生物钟被定位在下丘脑视交叉上核,当它受到异常刺激后,机体的昼夜节律可发生改变,严重时会引发疾病。到目前为止,维持生物钟运行的确切分子调控过程尚未清楚[4-7]。
肿瘤的发生、发展与昼夜节律系统的紊乱密切相关,时钟基因可能通过复杂的网络调节系统来影响肿瘤细胞的增生或凋亡[8-12]。基因启动子区甲基化是时钟基因蛋白表达功能改变的重要方式[13]。Per1、Per2、Cry1、Cry2、Clock、Bmal1和NPAS2等时钟基因的甲基化与胃癌、肝癌和乳腺癌等恶性肿瘤的发生、发展密切相关[14-16]。关于时钟基因甲基化的研究是目前肿瘤研究的热点,明确某些时钟基因的甲基化状态有助于研究个体化的治疗手段,从而提高恶性肿瘤的治愈率。
NPAS2是昼夜节律系统中重要的时钟基因,是肿瘤抑制基因[11]。NPAS2蛋白可以抑制体外培养的癌细胞生长,NPAS2的表达水平与结直肠癌病理分级和预后密切相关[11]。高级别胶质瘤NPAS2表达明显下降,NPAS2高表达胶质瘤患者生存期明显延长[12]。本研究发现,胶质瘤组织和癌旁正常组织NPAS2基因启动子区均有甲基化,而胶质瘤组织甲基化频率明显升高。本研究进一步分析发现,NPAS2时钟基因启动子区甲基化状态与患者性别、年龄、肿瘤部位、肿瘤类型、肿瘤全切除、术后辅助放化疗、肿瘤直径、术前KPS等均无关,但与WHO分级有关,胶质瘤组织WHO分级越高,NPAS2时钟基因启动子区甲基化频率越高。生存分析结果提示,除肿瘤全切除、WHO分级、肿瘤直径外,NPAS2时钟基因启动子区甲基化也是影响脑胶质瘤患者5年总生存期的独立危险因素。考虑原因是NPAS2时钟基因启动子区甲基化可能会使NPAS2蛋白表达减少,从而解除对脑胶质瘤生长的抑制,促进脑胶质瘤的发展,最终影响患者的临床预后。
综上所述,NPAS2时钟基因启动子区甲基化可能参与脑胶质瘤的发生、发展,其甲基化程度与脑胶质瘤恶性程度呈正相关,也是影响患者长期生存的危险因素。临床检测脑胶质瘤组织NPAS2时钟基因启动子区甲基化状态,有利于分析和预测患者的临床预后,同时协助脑胶质瘤恶性程度分级,指导临床进一步治疗。

