罗格列酮对慢性阻塞性肺疾病炎症损伤的保护机制研究
陈丽朱,罗 京
0 引言
慢性阻塞性肺疾病(COPD)是以气流受限不可逆为特征的慢性炎症性肺部疾病[1]。研究显示,其发病率高,预后差,在美国,每年约有10 000人死于COPD,高居美国疾病死亡率第4位[2]。在我国,COPD患病率在40岁以上人群约为9.9%,因此,控制或减少COPD是一个重大的公共健康问题。研究显示,降糖药罗格列酮具有抗炎、抑制肿瘤、拮抗凋亡和调节免疫等功效[3-4],本研究拟用罗格列酮干预COPD大鼠,探讨罗格列酮对COPD大鼠的保护作用及潜在机制。
1 材料与方法
1.1 实验动物、试剂和设备 健康成年雄性SD大鼠30只,体重(220±20)g,购自武汉大学实验动物中心。罗格列酮(Sigma,美国);脂多糖(Sigma,美国,1 mg/ml);水合氯醛(武汉谷歌生物)。PI3K(CST,USA)、AKT(CST,USA)、p-AKT(CST,USA)、白细胞介素(IL)-6、IL-1β和肿瘤坏死因子(TNF-α)ELISA试剂盒(RD,美国);引物(擎科生物),逆转录仪(Eppendorf),逆转录试剂盒(GeneCopoeia,USA),紫外分光光度计(Thermo fisher,美国),显微镜(Olympus BX51,日本)和成像系统(HITMAS-30,日本)。
1.2 实验动物分组 30只SD大鼠随机均分为对照组(C组)、模型组(COPD组)和罗格列酮组(RGZ组)。采用烟雾暴露联合气道滴入脂多糖构建大鼠COPD模型。RGZ组在烟雾暴露前30 min给予罗格列酮(20 μg/只)灌胃,C组和COPD组给予等量生理盐水灌胃,共30 d,具体剂量参考文献[5]。COPD组和RGZ组大鼠每天置于烟室4次,每次1 h,共30 d。从第15天起,RGZ组和COPD组大鼠气道内注入200 μl脂多糖,C组正常饲养,具体操作参考文献[5]。在第30天,利用腹腔注射水合氯醛麻醉大鼠后,行气管插管,采用AniRes2003动物肺功能呼吸系统测定各组大鼠肺顺应性(CL)、第0.3秒用力呼气容积(FEV0.3%)与用力肺活量(FVC)之比和用力呼气流量(MMEF);此外,用PBS灌洗左侧支气管肺泡。将BALF离心、重悬,送医院检验科,利用血细胞分析仪检测中性粒细胞数和中性粒细胞之比,并收集右肺和血清,-80 ℃冰箱冻存。
1.3 肺组织病理检查 取肺组织放置于4%甲醛固定48 h后,石蜡包埋,切片,制片,HE染色观察肺组织病理形态。
1.4 ELISA检测血清中和BALF中炎症细胞因子表达水平 取各组血清和BALF,按照ELISA试剂盒说明书操作步骤检测血清和BALF中IL-6、TNF-α和IL-1β表达水平。
1.5 RT-PCR检测肺组织炎症细胞因子mRNA水平 取右肺组织,提取RNA,检测RNA含量,反转录,上样,IL-6、IL-1β和TNF-α引物序列如表1所示,扩增条件为:变性94 ℃ 10 s→退火59 ℃ 45 s→60 ℃ 1 min×35个循环,利用图像分析仪器进行扫描分析,具体步骤参见文献[6]。
1.6 Western blot检测肺组织蛋白表达 取肺组织,提取总蛋白。采用10%的聚丙烯酰胺凝胶进行电泳,按说明书进行Western blot实验,检测PI3K、AKT和p-AKT表达、最后采用ECL试剂盒显影并成像。每组实验重复3次,具体步骤参见文献。
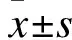
2 结果
2.1 各组大鼠一般情况 C组大鼠毛发白皙,光滑,活动性良好,无咳嗽,饮食良好,体重增加率为81.12%±10.23%,COPD组大鼠毛发萎黄,大量脱落,活动性差,经常出现咳嗽,饮食明显减少,体重增加率为55.13%±5.12%,一般情况较对照组明显变差。RGZ组大鼠毛发少量萎黄和脱落,活动性较差,偶尔出现咳嗽,饮食欠佳,体重增加率为72.46%±6.21%,一般情况优于COPD组。
2.2 罗格列酮对各组大鼠肺组织病理形态的影响 C组肺泡壁完整,肺泡间隔均匀一致,肺泡腔充气好,无炎症细胞浸润。COPD组与C组比较,肺泡间隔明显增厚,肺泡壁厚度明显变薄,肺泡腔萎陷,管腔变窄,萎缩肺泡陷明显增多,可见大量炎症细胞浸润。RGZ组与COPD组比较,肺泡间隔大多正常,肺泡腔充气良好,可见少量萎缩肺泡,炎症细胞浸润明显减少,见图1。
2.3 罗格列酮对各组大鼠肺功能的影响 与C组比较,COPD组大鼠CL、FEV0.3%/FVC和MMEF均明显降低(P<0.05);与COPD组比较,RGZ组大鼠CL、FEV0.3%/FVC和MMEF均明显增高(P<0.05),提示罗格列酮可明显改善COPD大鼠肺功能,见表2。
2.4 罗格列酮对各组大鼠肺脏中PI3K、p-AKT和AKT表达水平的影响 Western blot结果显示,与C组比较,COPD组大鼠肺脏PI3K和p-AKT表达明显上调(P<0.05),而两组AKT表达水平差异无统计学意义(P>0.05);与COPD组比较,RGZ组大鼠肺脏中PI3K和p-AKT表达进一步增加(P<0.05),而两组AKT表达水平差异无统计学意义(P>0.05),见图2。结果显示,罗格列酮可促进PI3K/AKT信号通路激活。
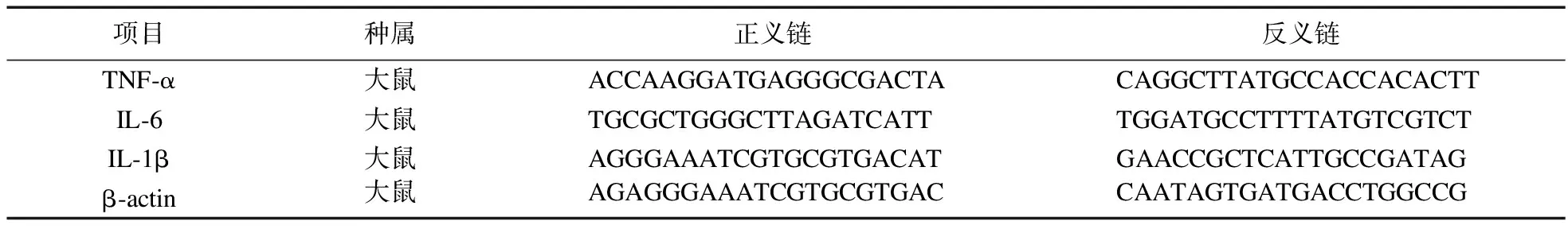
表1 RT-PCR引物序列

表2 罗格列酮对CL、FEV0.3%/FVC和MMEF的影响
注:与C组比较,**P<0.01;与COPD组比较,#P<0.05
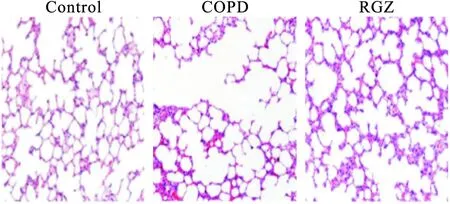
图1 HE检测罗格列酮对肺组织病理损伤的影响(200×)

图2 Western blot检测罗格列酮对PI3K、AKT、p-AKT表达水平的影响
注:与C组比较,*P<0.05,**P<0.01;与COPD组比较,#P<0.05
2.5 罗格列酮对各组大鼠BALF中白细胞计数和中性粒细胞百分比的影响 与C组比较,COPD组BALF中白细胞计数和中性粒细胞百分比均明显增加(P<0.05);与COPD组比较,RGZ组BALF中白细胞计数和中性粒细胞百分比均明显降低(P<0.05)。见表3。
2.6 罗格列酮对各组大鼠肺脏TNF-α、IL-6和IL-1β mRNA表达的影响 与C组比较,COPD组肺脏中TNF-α、IL-6和IL-1β mRNA表达水平均明显增高(P<0.05);与COPD组比较,RGZ组肺脏中TNF-α、IL-6和IL-1β mRNA表达水平均明显减少(P<0.05),见表4。

表3 罗格列酮对BALF中白细胞计数和中性粒细胞百分比的影响
注:与C组比较,**P<0.01;与COPD组比较,#P<0.05
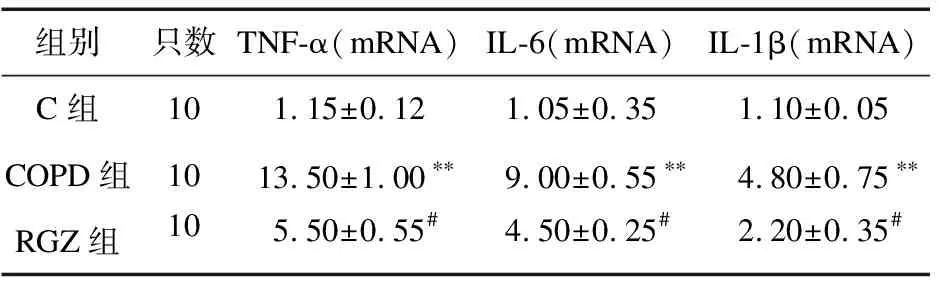
表4 罗格列酮对TNF-α、IL-6和IL-1β mRNA表达水平的影响
注:与C组比较,**P<0.01;与COPD组比较,#P<0.05
2.7 罗格列酮对各组大鼠血清中TNF-α、IL-6和IL-1β表达量的影响 与C组比较,COPD组血清中TNF-α、IL-6和IL-1β表达量均明显升高(P<0.05);与COPD组比较,RGZ组血清中TNF-α、IL-6和IL-1β表达量均明显降低(P<0.05),见表5。
2.8 罗格列酮对各组大鼠BALF中TNF-α、IL-6、IL-1β表达量的影响 与C组比较,COPD组BALF中TNF-α、IL-6和IL-1β表达量均明显升高(P<0.05);与COPD组比较,RGZ组BALF中TNF-α、IL-6和IL-1β表达量均明显降低(P<0.05),见表6。

表5 罗格列酮对血清中TNF-α、IL-6、IL-1β表达量的影响
注:与C组比较,**P<0.01;与COPD组比较,#P<0.05
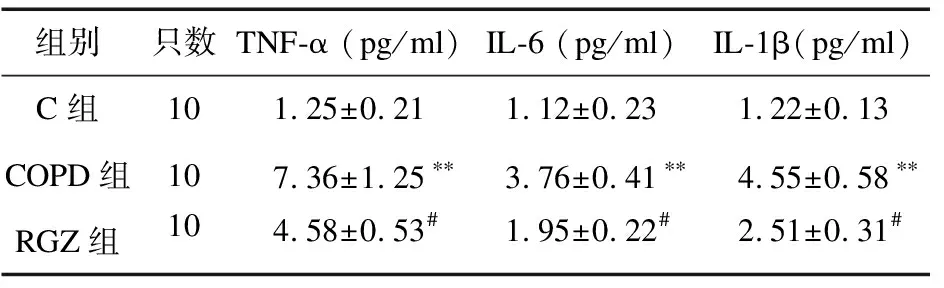
表6 罗格列酮对BALF中TNF-α、IL-6、IL-1β表达量的影响
注:与C组比较,**P<0.01;与COPD组比较,#P<0.05
3 讨论
COPD是临床上常见的一种呼吸道气流严重受限且不能完全可逆的支气管肺部疾病,其气流受限表现为缓慢而持续的进展。其致病病因包括机体抵抗力下降、过敏、反复感染、吸入有毒有害物质以及反复严重感染等[1-2]。其病理基础为肺实质和支气管的慢性炎症,缓慢而持续的进展,引发肺功能下降乃至衰竭[7-9]。因此,抑制或减轻肺部炎症是改善COPD的有效治疗途径。
罗格列酮为噻唑烷二酮类抗糖尿病药,其作用机制为通过提高机体对胰岛素的敏感性以控制高血糖。罗格列酮是过氧化物酶体增殖激活受体γ(PPAR-γ)的强效激动剂之一,而PPAR-γ广泛分布于肺组织等器官[3-4]。既往研究显示,PPAR-γ激动剂可通过激活PPAR-γ核受体,调节炎症反应、自由基清除及血糖降解等[3-4]。因此,罗格列酮可能有助于改善COPD。
本实验通过烟熏暴露联合气管内滴入(脂多糖)的方法构建大鼠COPD模型。模型组大鼠一般情况表现为毛发萎黄,大量脱落,活动性差,经常出现咳嗽,饮食明显减少,体重增加,病理学结果显示,大鼠肺泡间隔明显增厚,肺泡壁厚度明显变薄,肺泡腔萎陷,管腔变窄,萎缩肺泡陷明显增多,可见大量炎症细胞浸润。肺功能检测结果显示,CL、FEV0.3%/FVC和用力呼气流量均明显降低,肺组织、血清和BALF TNF-α、IL-6、IL-1β表达量明显增加,BALF中白细胞计数和中性粒细胞百分比均明显增高,这与既往研究报道一致[6],提示成功模拟构建了COPD大鼠模型。本研究进一步证实了COPD可导致炎症反应的激活和炎症细胞的浸润,肺组织病理损伤,肺功能降低及临床不适症状的出现,严重影响患者生活质量乃至预后。罗格列酮预处理可明显改善大鼠一般状态,减轻肺组织病理结构改变和肺功能的降低,减轻炎症细胞因子表达和炎症细胞浸润。因此,罗格列酮对COPD大鼠有明显的保护作用,其作用机制与抑制炎症相关,但具体机制不明。
PI3K是体内介导信号传递的重要分子,可通过磷酸化其下游的蛋白激酶B(AKT)调节各种细胞功能,如增殖、凋亡、转化、炎症和趋化等,并在COPD等呼吸道疾病的发病机制中起关键作用[10-11]。结果显示,COPD可以促进PI3K/AKT信号通路的激活,而罗格列酮可以进一步促进PI3K/AKT的激活,这与既往研究显示PPAR-γ激动剂可促进PI3K/AKT信号通路的激活一致。
综上所述,罗格列酮可通过抑制炎症而对COPD有保护作用,其作用机制与激活PI3K/AKT信号通路相关。本研究为临床防治COPD提供了新的选择。

