威宁紫苏原花青素提取及抗氧化活性
闫莉莉,禄 露,鲁连芳
威宁紫苏原花青素提取及抗氧化活性
闫莉莉,禄 露,鲁连芳
(铜仁学院 材料与化学工程学院,贵州 铜仁 554300 )
基于单因素实验和正交实验,获得了威宁紫苏叶片原花青素的最佳提取工艺,主要参数为:乙醇浓度85%、料液比1:25、微波功率(300 W)、微波时间30 s,该工艺条件下原花青素的粗得率为6.4 mg/g,纯化制品得率为0.64%,样品纯度为86.54%。当所提取的原花青素浓度为0.008 mg/mL时,对羟基自由基清除率可达54.21%,对Fe3+的总还原能力最强。说明紫苏原花青素具有一定的抗氧化活性。
紫苏; 原花青素; 抗氧化活性
0. 引言
紫苏()为唇形科一年生草本植物[1],主要分布于我国江苏、云南和贵州等20多个省市。威宁县地处海拔2200米,气候环境适宜紫苏生长,紫苏资源丰富。紫苏为药食同源植物,其叶富含氨基酸、原花青素、紫苏宁和矢车菊素3,5-二葡糖苷等特有的活性物质和营养成分[2-3]。近年来,关于紫苏中紫苏籽油[1]、花色素苷[4]、咖啡酸[5]、黄酮类及微量元素[6]等活性成分研究较多,而对其中原花青素的提取及抗氧化活性的相关报道较少。
原花青素(Oligomeric proanthoyanidins, OPC),是一种富含双黄酮衍生物的天然多酚化合物,具有很强的抗氧化和清除自由基活性[7],可广泛应用于护肝解毒[8]、消炎抗癌[9-10]、降血压[11]、治疗心血管[12]等疾病。目前市售的原花青素产品多来源于黑枸杞[13]、葡萄籽[14]、黑莓[15]和紫薯[16]提取物,而紫苏提取物的原花青素产品较少。
为充分利用贵州威宁县当地资源,对紫苏叶原花青素的提取工艺和抗氧化活性进行研究,为原花青素资源的开发提供参考。
1.材料与方法
1.1.材料与试剂
新鲜紫苏叶片采自于贵州省威宁县。
主要试剂有:原花青素标准品(UV≥95%,20 mg/支,购于国家标准物质网);甲醇、无水乙醇、石油醚、丙酮、水杨酸、硫酸亚铁、双氧水、三氯化铁、三氯乙酸、铁氰化钾均为分析纯;0.05 mol·L-1磷酸缓冲液由0.05 mol·L-1Na2HPO4溶液和0.05 mol·L-1K2HPO4溶液组成,使用前按一定比例混合,并调节好pH值;实验用水为超纯水。
1.2.主要仪器
T6新世纪型紫外-可见分光光度计(北京普析通用有限公司);MM823EC8-PS(X)型微波炉(广东美的集团有限公司);KA-1000型低速台式离心机(800~4000 rmp,杭州艾普仪器设备有限公司)。
1.3 方法
1.3.1.原花青素的提取
取自然晾干的紫苏叶,用粉碎机粉碎,称取紫苏干粉2.00 g,加入一定量80%乙醇溶液,在一定微波功率下加热处理1 min,然后在4000 r/min条件下离心5 min,上清液用石油醚萃取除去叶绿素等杂质,部分待测样品用热稀酸处理,得到酒红色的原花青素离子。
1.3.2.最佳提取条件的确定
保持其他条件不变,分别考察浸提剂浓度、料液比、微波时间、微波功率对原花青素提取得率的影响,并用正交试验确定各因素最佳值。
1.3.3.紫苏叶原花青素的纯化
对1.3.2中最佳工艺所得原花青素,采用结晶纯化法[17]。原花青素提取液置于60%的甲醇中,并于室温浸泡6 h,以60~70 ℃水浴加热15 min,将提取液减压浓缩,待液体浓缩成浆糊状时停止操作,再用乙醇和乙醚洗涤浓缩物,用温水溶解不溶部分,过滤以后加入等体积的乙醇于冰箱静置5 h,再一次过滤将杂质除去,将滤液在30~40 ℃条件下减压蒸干,取残渣并溶于冷蒸馏水,向容器中加入2倍的乙醇,放置冰箱静置12 h,待容器底析出棕色晶体,为进一步提纯,再次将其溶解于60 ℃的50%乙醇中,过滤后将滤液在30~40 ℃下减压浓缩,在冰箱静置12 h,结晶分离后,即得棕色原花青素。
1.3.4.原花青素的含量测定
以原花青素标准品配制一系列标准溶液,绘制标准曲线,同等条件下,测定原花青素提取液的吸光度,然后根据标准曲线计算紫苏原花青素的浓度,按公式(1)换算出原花青素的得率,并按公式(2)计算纯度。
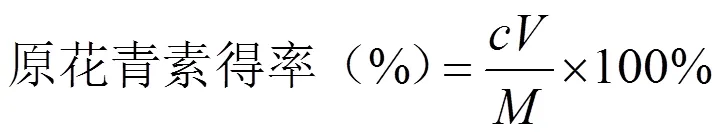
式中,c为原花青素浓度,mg/mL;V为溶液体积,mL;M为原料质量,mg。
本研究根据垃圾填埋场的特点,建立了沼气产气模型,并进行了相应沼气发电机组的设计;根据沼气机组的余热特点,提出了利用余热进行发电的方案。利用沼气发电机组发电,不仅解决了沼气的去处问题,还通过发电产生了一定的效益。利用机组余热,通过ORC循环进行发电,进一步提高了沼气发电的效率,具有节能环保高效的特点。
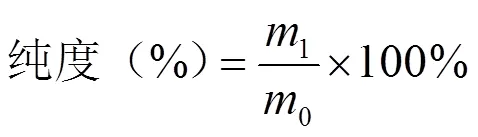
式中,m1为产物中原花青素的质量,mg;m0为产物质量,mg。
1.3.5.紫苏叶原花青素·OH清除率的测定
采用Fenton法进行测定。在25 mL反应体系中,依次加入3 mL 7.5 mmol/L FeSO4、1%H2O2溶液,摇匀后再加3 mL 6 mmol/L水杨酸,摇匀并于37 ℃水浴中加热15 min,在波长为510 nm处测其吸光度A0。然后分别加入一定量不同浓度的待测液,继续水浴加热15 min,取出测其吸光度Ax,并按(3)式计算·OH的清除率。

式中,A0为未加待测样品吸光值,Ax为加待测样品的吸光值。
1.3.6.紫苏叶原花青素总还原能力的测定
分别取浓度为0.002、0.003、0.004、0.005 L、0.006、0.007、0.008 mg/ mL的原花青素试样1 mL,分别依次加入pH=6.6的磷酸缓冲液2.5 mL和1%铁氰化钾(K3Fe(CN)6)溶液2.5 mL,待混合均匀后于50℃水浴20 min,再加入质量分数为10%三氯乙酸溶液2.5 mL混合,取混合液2.5 mL,再加入质量分数为0.1%氯化铁2.5 mL和蒸馏水2.5 mL,混合静置10 min,在波长为700 nm处测其吸光度。
2.结果与分析
2.1.原花青素标准曲线的制作
y=2.3761x+0.012 (R2=0.9985) (4)
2.2.单因素实验
2.2.1.乙醇浓度的影响
在浸提时间为35 s、微波功率为440 W、料液比为1:20、提取1次的条件下,不同乙醇浓度对紫苏原花青素得率的影响如图2所示。随着乙醇的浓度增加,得率逐渐增加,但当乙醇浓度达到80%时,如果再增加浓度,原花青素的得率会下降,因此,最佳浸提浓度应在80%左右。
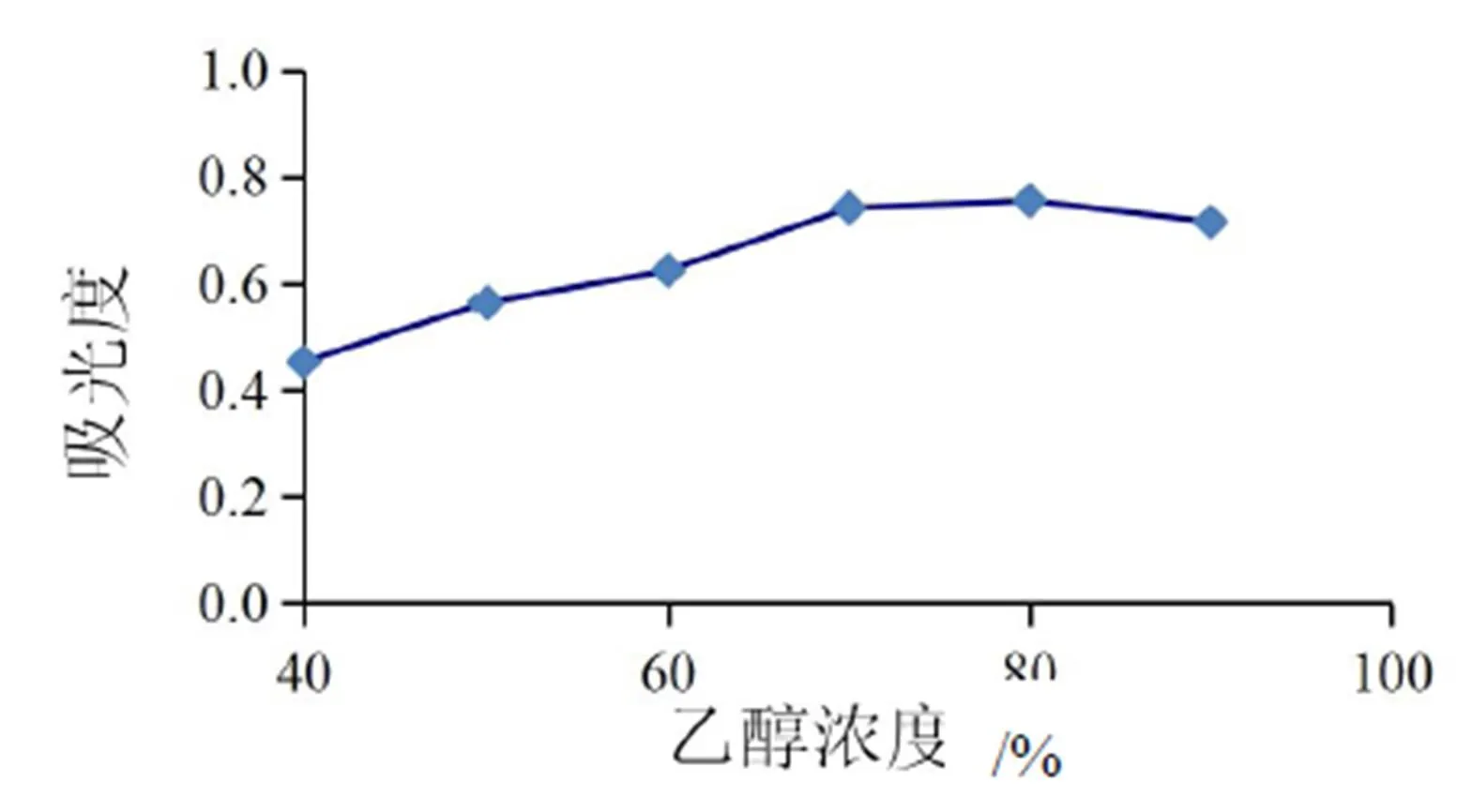
图2 浓度乙醇对原花青素提取的影响

图3 料液比对原花青素提取的影响
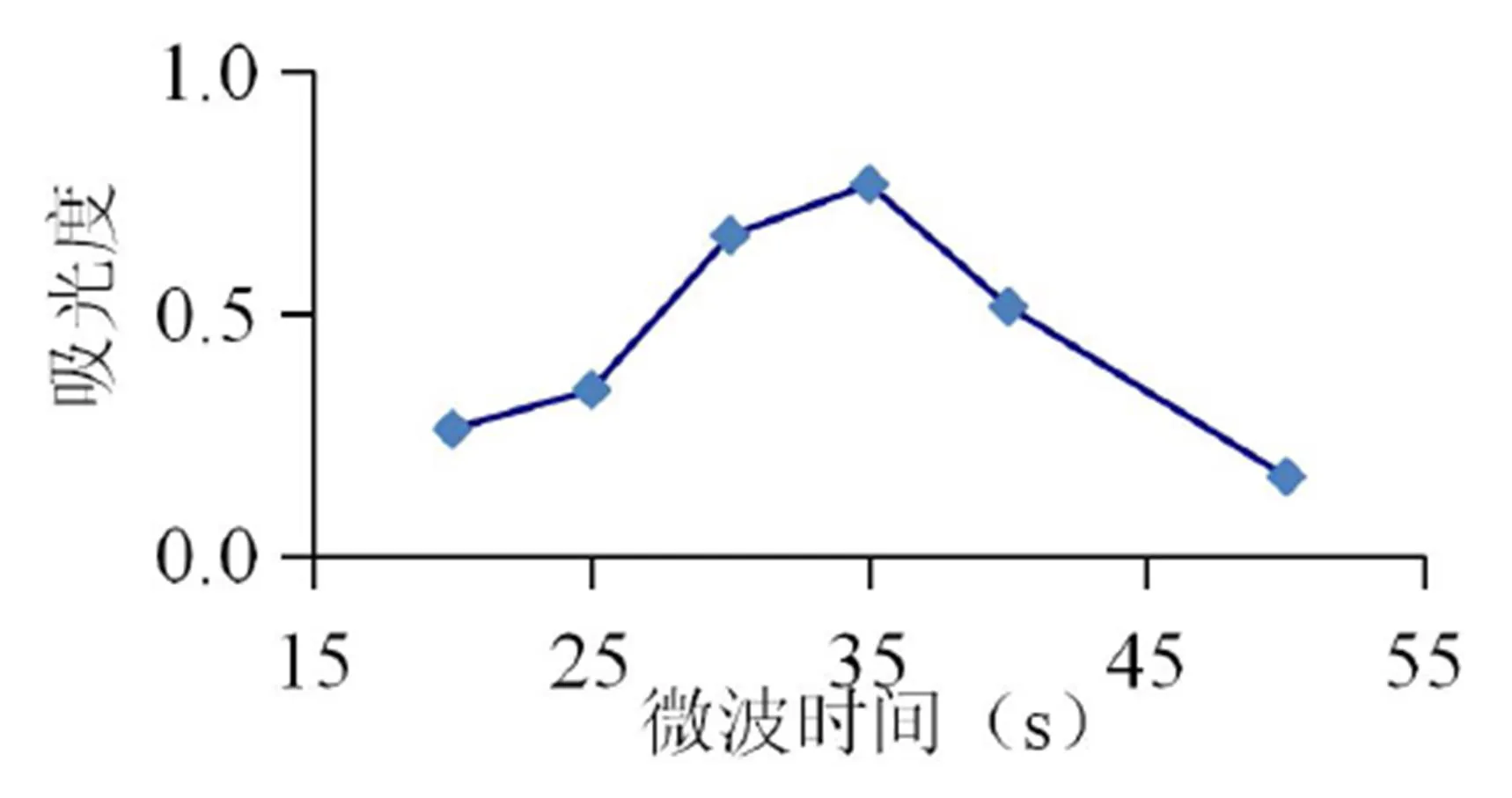
图4 微波时间对原花青素提取的影响
2.2.2.料液比的影响
在乙醇浓度为80%、提取时间为35 s、微波功率440 W、提取1次的条件下,不同料液比对紫苏中原花青素浸提效果如图3所示。可知,随着料液比的不断增加,得率呈逐渐降低的趋势,当料液比增加到1:20时,得率相对最高。
2.2.3.提取时间的影响
在乙醇浓度80%、微波功率440 W、料液比为1:20、提取1次的条件下,微波时间对紫苏原花青素得率的影响如图4所示。可知,随着微波时间的加长,得率不断增加,当微波时间超过35 s时,乙醇挥发较多,得率降低。
2.2.4.微波功率的影响
在乙醇浓度80%、微波时间为30 s、料液比为1:20、提取1次的条件下,微波功率对紫苏花青素得率的影响如图5所示。可知,随着微波功率的增加,得率不断增加,当微波功率大于440 W时,原花青素得率下降。
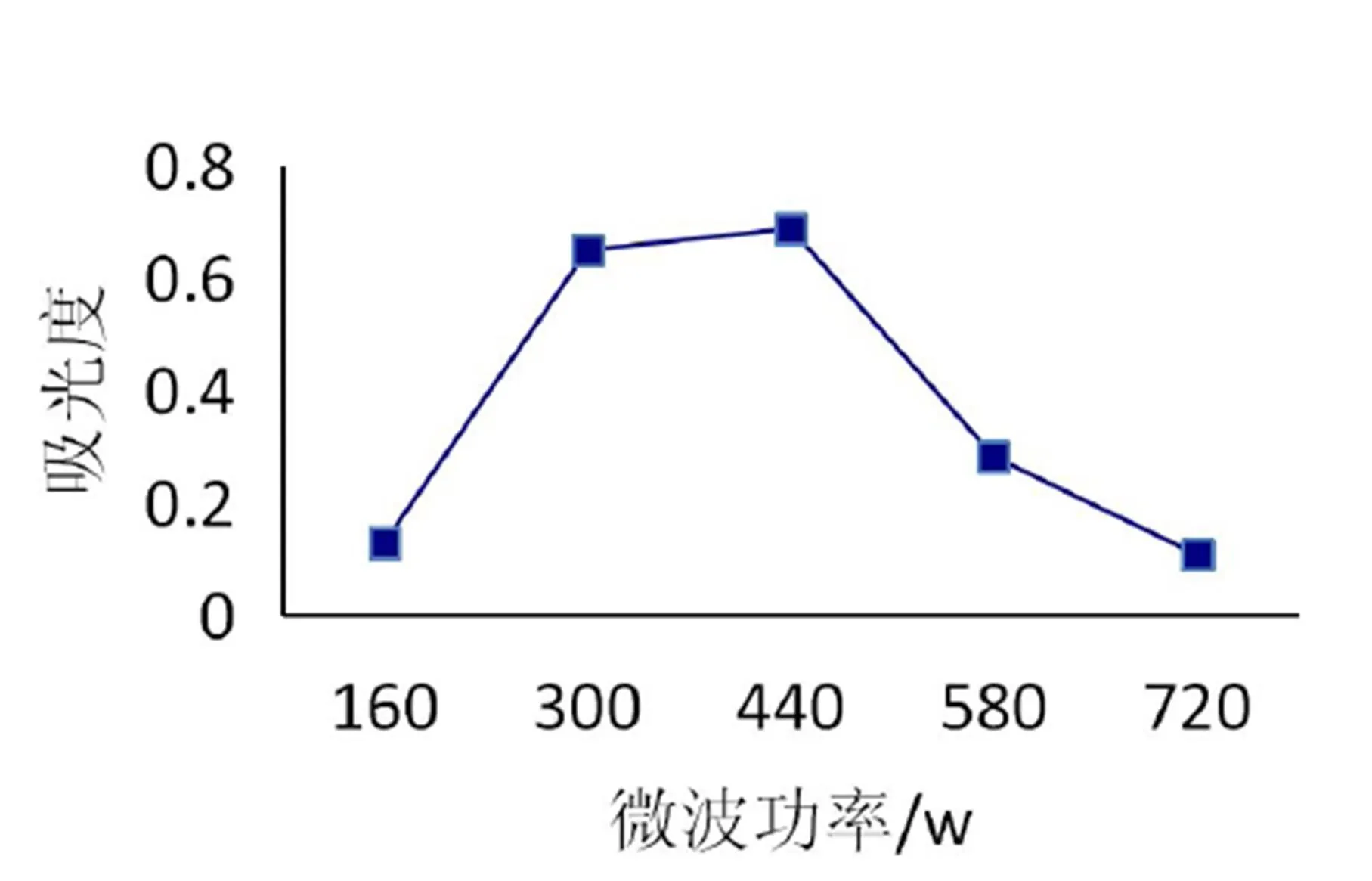
图5 微波功率对原花青素提取的影响
2.3.正交实验结果
在单因素实验基础上,采用四因素三水平的正交试验对微波时间,微波功率,乙醇浓度,料液比四个因素进行优化,每组实验做三次平行实验。因素水平如表1所示。
表1 正交实验设计因素与水平
Tab.1 factors and levels of orthogonal experiment
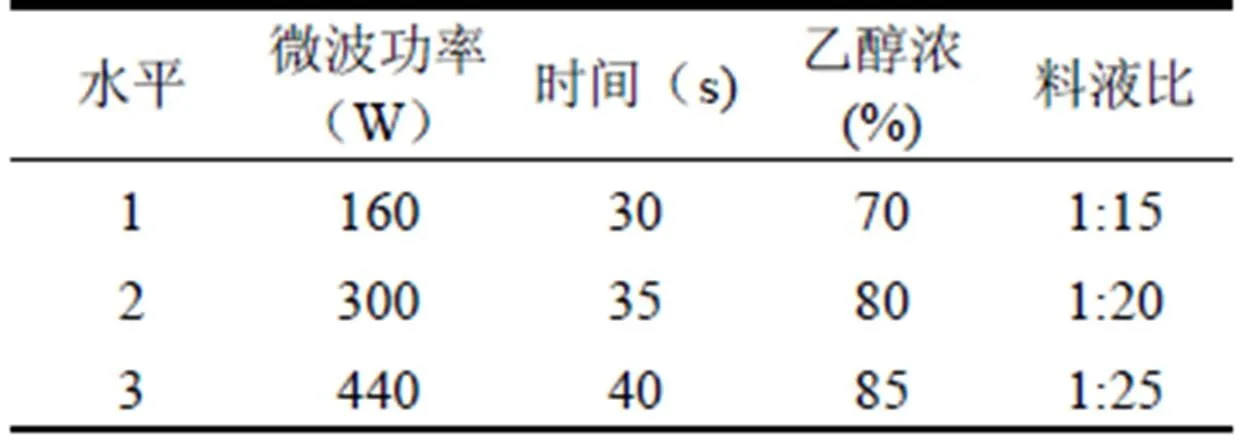
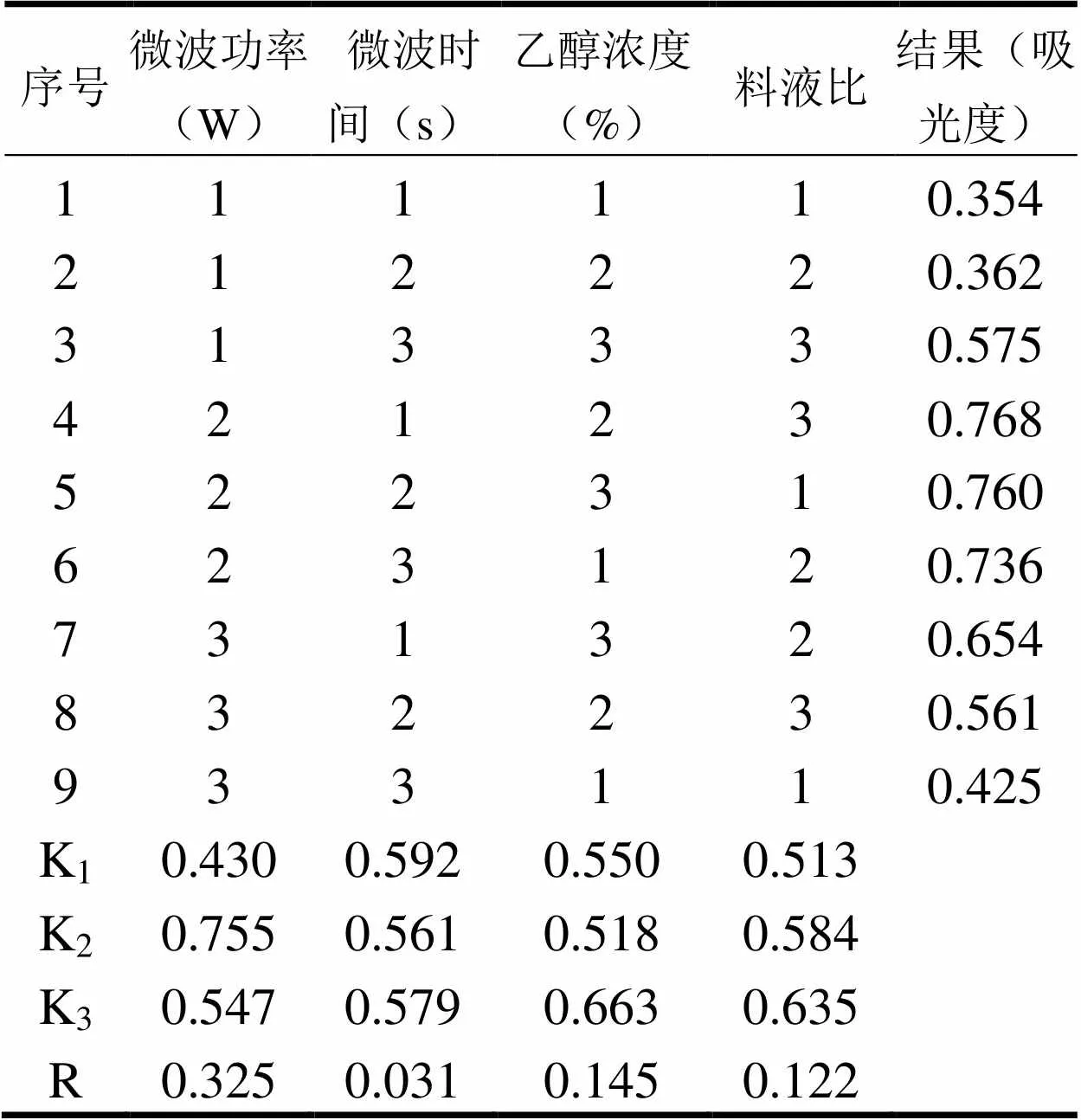
表2 正交实验结果
正交实验结果如表2所示。可看出A因数的极差最大,故影响紫苏中原花青素的得率最大因素为微波功率,其次是乙醇浓度、料液比,影响最小的因素为微波时间,根据K值的大小可知,紫苏原花青素提取的最优条件为A2B1C3D3,即微波功率为300W,微波时间为30 s,乙醇浓度为85%,料液比为1:25。此条件下原花青素的粗得率为6.4 mg/g。
2.4.原花青素的纯化及含量测定
采用1.3.3和1.3.4方法对原花青素进行纯化并计算含量,原花青素的粗得率为6.4 mg/g,纯化后得率为0.64%,样品纯度为86.54%。
2.5.抗氧化活性分析
原花青素浓度与羟基清除率之间的关系如图6所示。由图可知,随着原花青素浓度不断增加,清除率逐渐增大,当原花青素浓度达到0.008 mg/ mL时,清除率可达到54.21%。
2.6.总还原能力分析
原花青素的总还原能力如图7所示。由图可以看出,在实验浓度范围内,原花青素对Fe3+的总还原能力与其浓度成正比,当浓度为0.008 mg/ mL时还原能力最强。
3.结论
通过单因素实验,并在正交试验的基础上,得出在提取时间为30 s、微波功率为300 W、乙醇浓度为85%、料液比为1:25的条件下可达最佳提取效果,得到原花青素的浸提取量为6.4 mg/g。通过结晶法纯化的原花青素得率为0.64%,纯度为86.54%,且具有较强的清除羟基自由基能力和还原能力。

图6 原花青素对Fenton体系产生·OH的清除作用
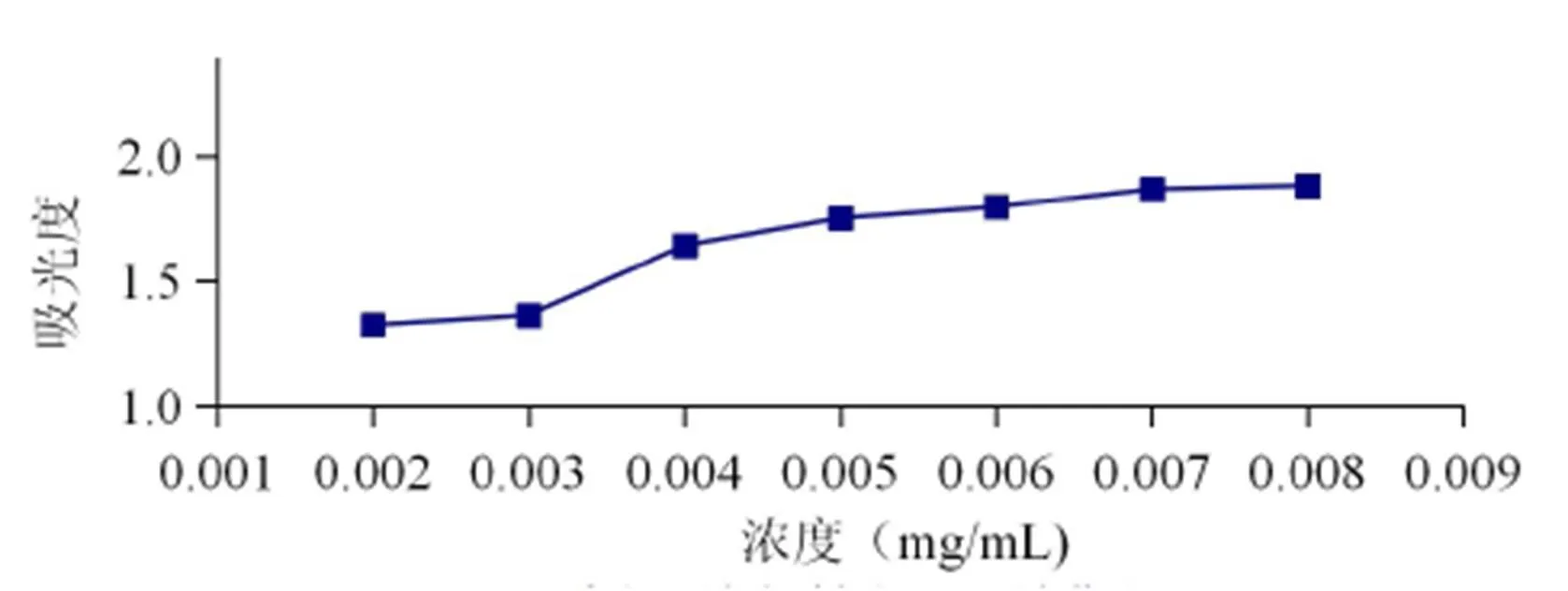
图7 原花青素总还原能力
[1] 王仙萍,李敏,张敏琴,等.贵州紫苏资源收集以及叶色多样性分析[J].中国农学通报,2013,29(10):132-136.
[2] 李钰,吴卫,苏华,等.响应面法优化紫苏籽粕超声辅助提取原花青素工艺[J].食品科学, 2014,35(4):50-54.
[3] 余晓曦,孟凌华,余奇文.紫苏宁和矢车菊素3,5-二葡糖苷对免疫效应细胞增值格局的调节作用[J].2012, 28(6):522-525.
[4] 蔡宁晨,苏平,刘晓霞,等.紫苏叶花色苷抗氧化作用的研究[J].中国食品学报,2012,12 (11):32-36.
[5] 胡惠军,谷丽华,侴桂新.HPLC法测定紫苏叶中咖啡酸、野黄芩苷和迷迭香酸的含量[J].上海中医药大学学报,2016,4(30):80-84.
[6] 陈永康,赵志刚,孙丽娟.液相色谱-飞行时间质谱法快速鉴定紫苏叶中的化学成分[J].医学导报,2013,3(32):371-374.
[7] 鄢又玉,沈丹华,王红娟,等.火棘原花青素制备及抗氧化功效研究[J].食品研究与开发,2015,36(4):35-39 .
[8] 贺玉玲,罗俊容,肖瑶,等.原花青素对成纤维细胞衰老的影响[J].医药卫生,2017(1):205-206 .
[9] 杨慧,马培,林明宝.紫苏叶化学成分、抗炎作用及其作用机制研究进展[J].中国药理学与毒理学杂志,2017,31(3):279-286.
[10] 王昱骄,王雪,王颖忱,等.蓝莓提取物花青素对人胃癌 MGC-803 细胞增殖抑制的影响[J].临床研究,2016(6):36.
[11] 张蕾,吕宁,展雯琳.原花青素的生物活性[J].安徽化工,2016,43(3):1-2.
[12] 杨芙莲,陈旭清,李凡.甜荞麦壳中原花青素提取及抗氧化性研究[J].陕西科技大学学报,2014,32(3):101-105.
[13] 古丽巴哈尔·卡吾力,常占瑛,哈及尼沙,等.黑果枸杞花青素的提取工艺及抗氧化活性研究[J].西北药学杂志,2017,32(4):455-460.
[14] 李春阳,许时婴,王璋.DPPH法测定葡萄籽原花青素清除自由基的能力[J].食品与生物技术学报,2006,25(2):102-106.
[15] 徐怀德,闫宁环,陈伟,等.黑莓原花青素超声波辅助提取优化及抗氧化性研究[J].农业工程学报,2008,24(2):264-269.
[16] 田喜强,董艳萍.超声波辅助提取紫薯花青素及抗氧化性研究[J].中国酿造,2014,33(1):77-80.
[17] 孙建霞,张燕胡,小松,等.花青素的提取、分离以及纯化方法研究进展[J].食品与发酵工业,2008,34(8):111-117.
Extraction and Antioxidation Properties of Oligomeric Proanthoyanidins fromin Weining County
YAN Lili, LU Lu, LU Lianfang
( College of Material and Chemical Engineering, Tongren University, Tongren 554300, Guizhou, China )
Based on single factors and orthogonal experiments, the optimum extraction conditions of oligomeric proanthoyanidins fromleaves in Weining county was obtained: ethanol concentration 85%, solid-liquid ratio 1:25, microwave power 300 W, microwave time 30 s. The crude yield of oligomeric proanthoyanidins was 6.4 mg/g. The yield of purified products was 0.64%, and the purity of samples was 86.54%. The scavenging rate of hydroxyl radical reached 54.21%, and the total reduction ability of Fe3+was the strongest at the concentration of oligomeric proanthoyanidins 0.008 mg/mL.It shows that perilla seed anthocyanin has certain antioxidant activity.
, oligomeric proanthoyanidins, antioxidant activity
R284.2
A
1673-9639 (2018) 09-0001-05
2018-03-30
贵州省普通高等学校产学研基地(黔教合KY 字[2015]346);贵州省教育厅大学生创新创业训练中心项目 (2016SJDCZX001);2017 年第二批产学合作协同育人项目(201702108094)。
闫莉莉(1984-),女,河南周口人,硕士,讲师,研究方向:电分析化学与抗氧化,E-mail: yanli0919@126.com.
(责任编辑 杨凯旭)(责任校对 谢 勇)

