氮氧化物在高压下生成亚硝酸的实验研究
于帅帅, 刘敦禹, 陈 军
(上海理工大学 能源与动力工程学院,上海市动力工程多相流动与传热重点实验室,上海 200093)
降低CO2排放是当前能源与环境领域主要关心的问题[1],富氧燃烧捕集封存技术是一种直接减少煤燃烧排放CO2的重要手段[2]。但是,利用物理压缩捕集CO2又大大增加了富氧燃烧技术的成本,以往研究表明,资源化回收燃烧产物是减少富氧燃烧技术成本的重要途径。阎维平等[3]提出富氧燃烧锅炉尾气在高压捕集CO2时资源化回收稀硝酸(HNO3)。NO在高压、低温、氧气充足的条件下容易被氧化为NO2,有水存在时,生成的NO2会转化成HNO3,回收HNO3可以降低电厂发电成本。以往实验研究尚未注意到实验反应的气液质量守恒问题。Ting等[4]在研究NO、O2和H2O构成高压反应体系的反应机制和气液质量平衡时发现,进口气相中氮元素相关成分的质量总量大于出口气相与液相相加的质量总量,认为质量不守恒的原因在于HNO3。
笔者总结了以往研究,认为加压资源回收过程中氮氧化物质量不守恒的原因可能是亚硝酸(HONO)未被准确定量。同时鉴于HONO是大气氧化性指标OH自由基的重要前体物,HONO的准确定量一直是公认难题。自1979年,Platt等[5]首次利用差分吸收光谱法[6-7]在大气中测得HONO质量浓度以来,HONO在大气化学中的重要性逐渐被熟知[8]。笔者通过模拟富氧燃烧压缩捕集CO2过程,采用差分吸收光谱法测量实验中产生的HONO和NO2气相产物质量浓度,采用分光光度法[9-10]测量亚硝酸根NO2-和硝酸根NO3-等液相产物浓度,以获得含氮物质的气液质量守恒规律。
1 实验原理
1.1 氮氧化物的吸收原理
氮氧化物的吸收反应包括气相反应和液相反应,发生的化学反应如下:
气相反应
2NO(g)+O2(g)2NO2(g)
(1)
2NO2(g)N2O4(g)
(2)
NO(g)+NO2(g)N2O3(g)
(3)
NO(g)+NO2(g)+H2O(g)2HONO(g)
(4)

(5)
液相反应
2NO2(l)+H2O(l)HONO(l)+HNO3(l)
(6)
2N2O3(l)+2H2O(l)+O2(g)2HONO(l)+
2HNO3(l)
(7)
(8)
NO(g)+NO2(g)+H2O(l)2NOHO(l)
(9)
1.2 测量原理
气体质量浓度的测量主要采用差分吸收光谱法。由于各气体分子结构不同,其在不同光谱波段的吸收特性也不同,差分吸收光谱法就是利用气体在紫外到近紫外波段对光选择性吸收的特性来测量不同气体的质量浓度。当一束入射光强为I0的光穿过测量介质时,由于各组分气体的辐射吸收,出射光强变为I。
根据朗伯比尔定律可得:
(10)
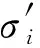
(11)
其中,光强I0、I和吸收腔长度L可在实验中测得,NO2和HONO的吸收截面参考文献[12]和文献[13]的数据,对式(11)进行反演拟合,可获得气体质量浓度ρi。
NO2在340~400 nm波段都有吸收,HONO在近紫外吸收峰为341.8 nm、354.2 nm和368 nm,实验中用到的光源中心波长为355 nm,半峰全宽为15 nm。计算利用最小二乘拟合方法,拟合波段为紫外340~370 nm波段。
液体中离子浓度的测量采用分光光度法。NO3-测量原理如下:利用NO3-在220 nm波长处的吸收情况来定量测定硝酸盐氮。但是溶解的有机物在220 nm处也会被吸收,而NO3-在275 nm处没有被吸收。因此,在275 nm处进行另一次测量,以校正硝酸盐氮值。NO2-测量原理如下:在磷酸介质中,被测量的NO2-与氨基苯磺酰胺反应生成重氮盐,再与乙二胺二盐酸盐生成红色燃料,在540 nm波长处测定吸光度,根据比尔定律可得亚硝酸盐氮浓度。
光源辐射通过被测溶液时,被测溶液的吸光度与被测溶液的浓度成正比。关系式为:
(12)
式中:A为吸光度;K为摩尔吸收系数;d为比色皿的长度;c为物质的浓度。
2 实验装置
实验装置如图1所示,主要包括耐高压鼓泡反应器、耐高压质量流量控制器、光源、非球面镜片和光谱仪。耐高压质量流量控制器(Sevenstar)用来控制进入耐高压鼓泡反应器的气体流量,气体分别为1%φ(NO)、纯度为99.999%的N2和纯度为99.999%的O2,实验中采用316不锈钢管作为气体传输管路,气体体积流量为2 L/min。利用耐高压质量流量控制器配出一定比例的混合气体,气体首先经旁路进入NOx分析仪(Thermo 42i型化学发光 NOx分析仪),测定混合后气体中氮氧化物的质量浓度。然后经三通阀转换方向后,气体进入耐高压鼓泡反应器中(304不锈钢耐高压鼓泡反应器),利用减压阀来控制其压力。从耐高压鼓泡反应器出来的气体分为2部分:一部分通入烟气分析仪测量NO气体质量浓度;另一部分通入光学吸收腔,利用差分吸收光谱法反演得到HONO和NO2气体的质量浓度。
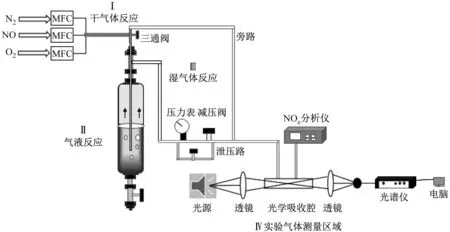
图1 高压反应、测量装置流程图
宽带光源(氙灯)发出的光通过非球面镜片(直径25 mm,聚焦100 mm)耦合进入吸收腔,出射光经过光纤耦合进入光谱仪(型号QE65000,Ocean Optics)狭缝,光谱仪再将光谱数据传送到电脑,这样可以实现连续光谱信号的采集保存。图2给出了一组典型的实验拟合结果。
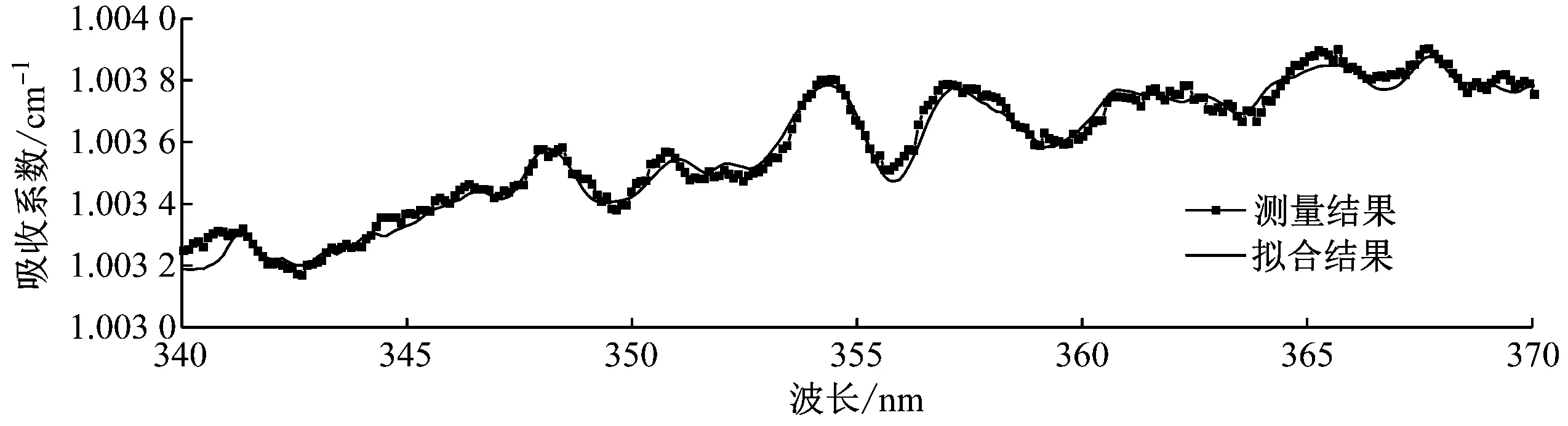
(a) 实验拟合结果和测量结果
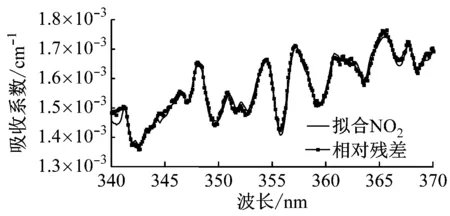
(b) NO2拟合结果及其相对残差
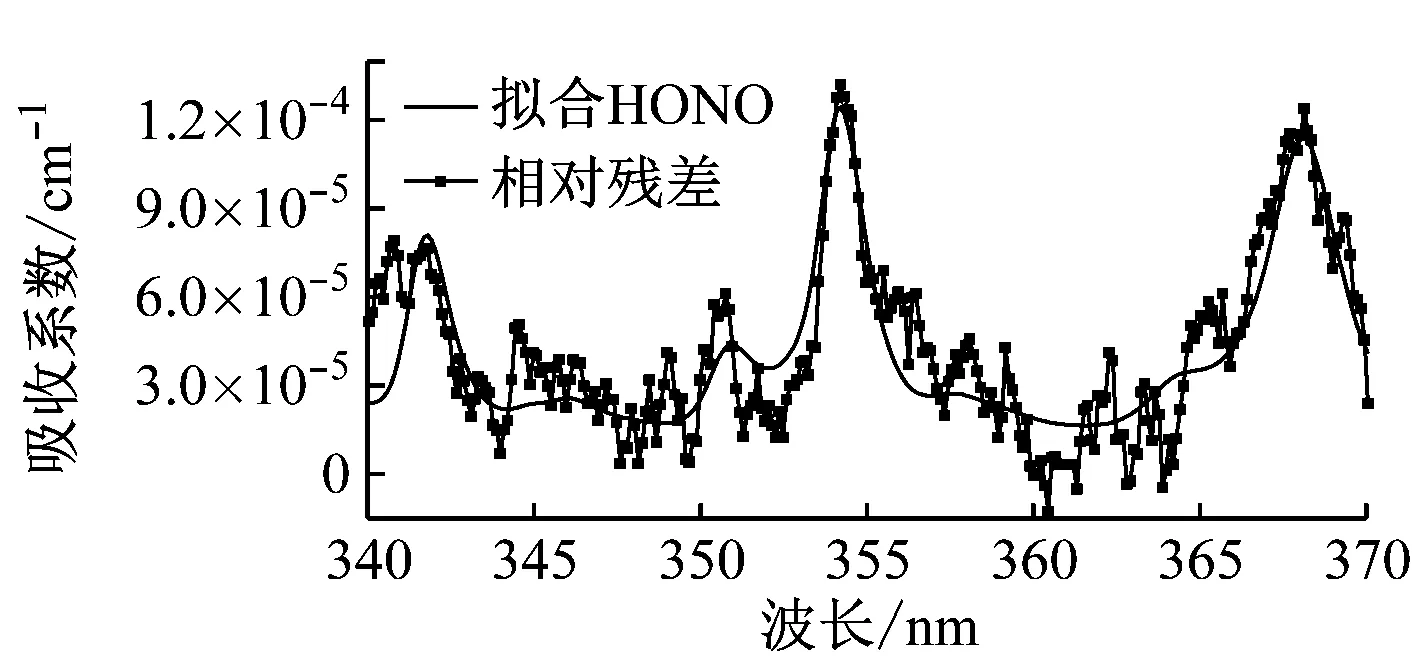
(c) HONO拟合结果及其相对残差
(d) 3次多项式拟合结果
(e) 实验拟合残差
3 实验分析与结果
实验研究分为气相实验和液相实验两部分[14]。
气相实验和液相实验都在耐高压鼓泡反应器中进行,其中进气流量由耐高压质量流量控制器控制。反应后的气体通过光学吸收腔,利用差分吸收光谱法反演得到NO2和HONO气体的质量浓度。
实际富氧燃烧烟气检测中,NO质量浓度从四五百到几千mg/m3不等[14-17],其中本文气相实验时选取的NO质量浓度为589 mg/m3、904 mg/m3、1 205 mg/m3、1 507 mg/m3和1 808 mg/m3,液相实验时采用的NO质量浓度为603 mg/m3。实际工业锅炉压力一般为2~3 MPa,由于耐高压鼓泡反应器的限制,实验模拟压力选择0.5~2 MPa,与实际工业锅炉压力部分相符,进一步实验将采用高压反应釜。本文实验中气相反应压力为0.1 MPa、0.8 MPa、1.5 MPa和2 MPa,液相反应压力为0.5 MPa、1 MPa、1.5 MPa和2 MPa。
3.1 气相实验
气相实验是指NO在高压下与O2反应生成NO2的实验,此实验过程没有水的参与。实验开始前向实验装置中通大约15 min的N2,吹净实验装置中杂质气体。通过3个耐高压质量流量控制器配比出一定浓度的混合气体,然后将混合后的气体通入耐高压鼓泡反应器中进行反应,反应后生成的NO2质量浓度运用吸收光谱技术来反演获得,反应后剩余的NO质量浓度利用NOx分析仪测量获得。测量结果见表1,其中NO转化率是指反应前后NO的质量浓度差除以反应前NO质量浓度的值。
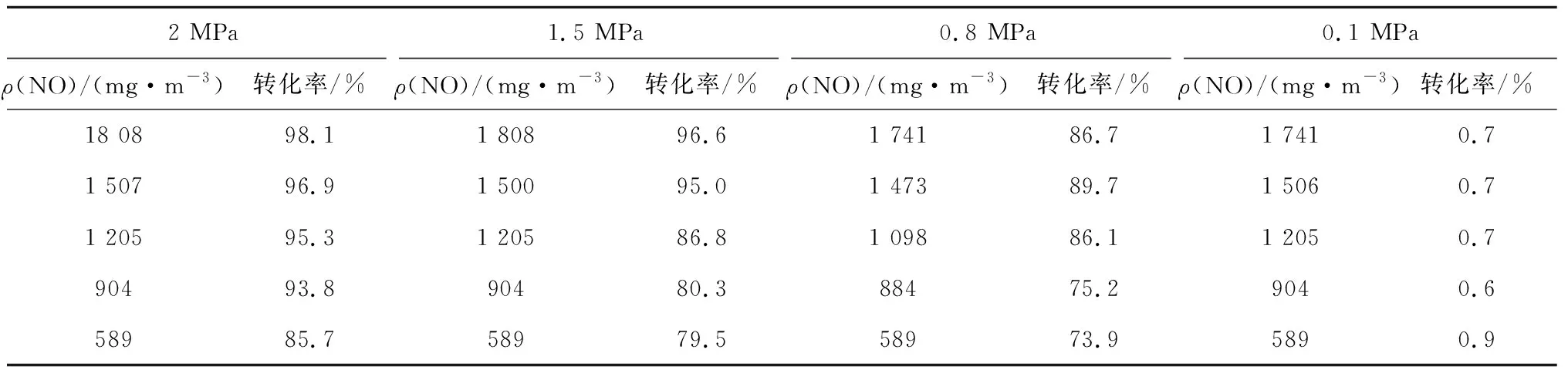
表1 不同压力、质量浓度下NO与O2反应后的NO转化率
由表1可知,混合气体在常温(25 ℃)常压下的NO转化率小于1%,可认为常压下N2、O2和NO并不反应。而当质量浓度相同时,随着压力升高NO转化率相应增大;当压力相同时,随着质量浓度的增大NO转化率也显著增大。当压力为2 MPa时,NO转化率可达到98%。
3.2 液相实验
液相实验开始前先在耐高压鼓泡反应器中加入500 mL的去离子水,用来研究高压下NO与O2的混合气体与水反应时的浓度变化[18-19]。因为实验结束后需要测量水中NO3-和NO2-的浓度,所以每组实验时间必须相同,本文实验持续时间同为1 h。耐高压鼓泡反应器加水后,通入603 mg/m3NO气体进行反应,反应后的气体一部分通入烟气分析仪来测NO质量浓度,另一部分通入光学吸收腔,得到HONO和NO2的质量浓度。耐高压鼓泡反应器里的液体收集好后交由检测单位来测量其中NO3-和NO2-的浓度。液相实验与气相实验的反应产物有很大不同,在液相实验中,反应后生成的NO2质量浓度大幅减小,因为产生的NO2大部分被水吸收生成了NO3-和NO2-。
图3给出了0.5 MPa压力下,NOx与H2O反应气相产物分布。整个实验过程持续100 min,其中0~15 min实验开始向旁路通入气体;21~81 min为气体反应过程,测得反应后NO质量浓度约为301 mg/m3,HONO质量浓度约为52 mg/m3,NO2质量浓度约为226 mg/m3。从81 min到实验结束为N2吹扫装置残留气体过程。由图3可知,整个实验过程中各组分气体质量浓度基本保持稳定。
图4给出了不同压力下NOx与H2O反应的气液产物分布。由图4可知,NO的质量浓度随着压力的升高明显减小,与气相实验结果相比,液相条件下NO随着压力升高转化更快。在气相实验中,随着压力升高生成NO2的质量浓度不断增大,而在液相实验中随着压力升高NO2的质量浓度不增反降,主要原因是高压下生成的NO2气体与H2O反应生成HONO、NO2-和NO3-,并且结果显示随着压力的升高转化为NO3-的浓度越大,而HONO质量浓度平缓减小。
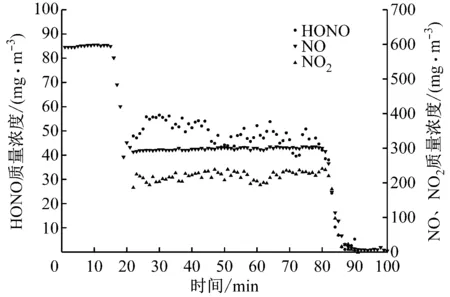
图3 0.5 MPa下NOx与H2O的反应气相产物分布
Fig.3 Distributions of gas phase products after the reaction of NOxwith H2O at 0.5 MPa
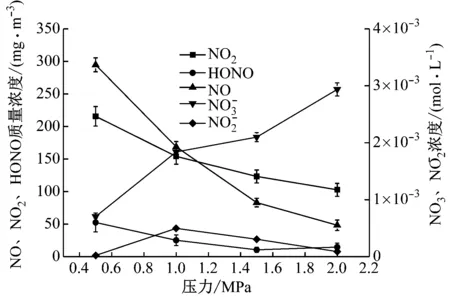
图4 不同压力下NOx与H2O的反应气液产物分布
Fig.4 Distributions of gas and liquid phase products after the reaction of NOxwith H2O at different pressures
之前有学者认为燃烧排放是大气中HONO的来源之一,但已有研究表明机动车排放中ρ(HONO)/ρ(NOx)为0.8%[20]。而在本研究高压资源化回收模拟过程中测得ρ(HONO)/ρ(NOx)为5.5%~10%,二者存在显著差异。
图5给出了不同压力下,N元素在气液相各组分的质量守恒情况。通过积分算出反应进口NO中N的分子数,再算出反应后生成的NO、NO2、HONO以及溶液中NO3-、NO2-的N分子数之和。并分别计算反应后出口气相成分N分子数之和以及气液总成分N分子数之和与进口NO中N分子数总量的比值。由图5可知,总N分子数基本符合质量守恒定律,实验质量守恒的最大误差在10%以内。
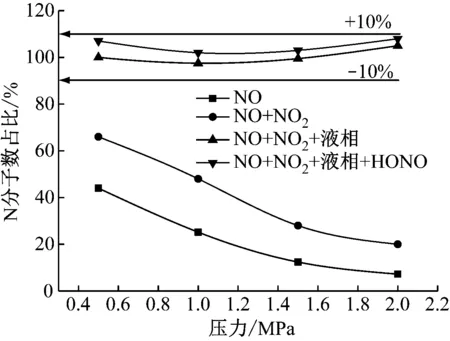
图5 不同压力下气液相组分N分子数占比
Fig.5 Mass balance of nitrogen related products in gas liquid reaction at different pressures
为研究反应后溶液的稳定性,采用N2吹扫反应后液体10 min,获得解析气体质量浓度随时间的动态变化情况,并通过积分计算不同解析气体的总量,折算成溶液中相应成分的浓度。解析气体总量包括耐高压鼓泡反应器中残留气体和溶液中解析气体。
图6给出了溶液解析气体组分NO、NO2和HONO的分布规律。通过计算,实验结束后从耐高压鼓泡反应器中吹扫得到3种气体的物质的量。由图6可知,随着压力的升高,NO物质的量减少得较快,NO2和HONO物质的量略微减少。
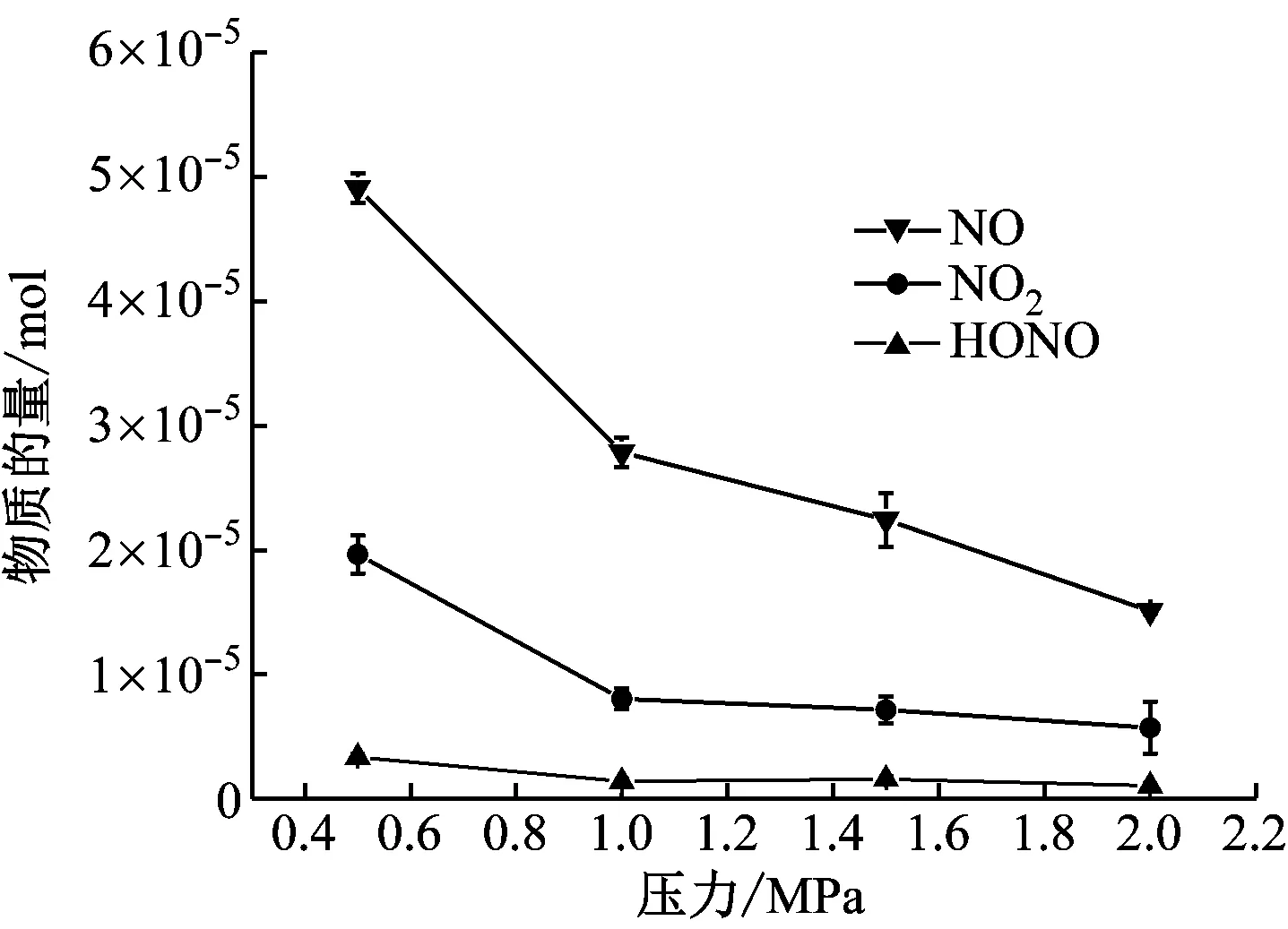
图6 耐高压鼓泡反应器中解析的气体物质的量
图7给出了耐高压鼓泡反应器上部残留的3种气体的分布规律。由图7可知,在1 MPa和1.5 MPa时NO和NO2物质的量先增大后减小,HONO物质的量先略微减小然后基本不变。
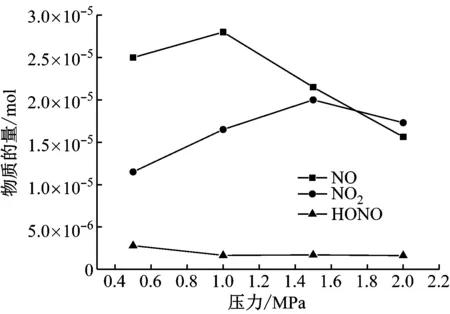
图7 耐高压鼓泡反应器中残留气体组分分布
图8给出了从耐高压鼓泡反应器中吹扫得到3种气体的物质的量之和减去耐高压鼓泡反应器上部残留气体量获得溶液中解析出的3种气体物质的量。由图8可知,随着压力的升高,解析出的3种气体越来越少,表明溶液中的成分越来越稳定。与图4对比可知,0.5 MPa时N相关成分解析出的N物质的量占溶液中总氮物质的量的7%,2 MPa时则为3‰左右。
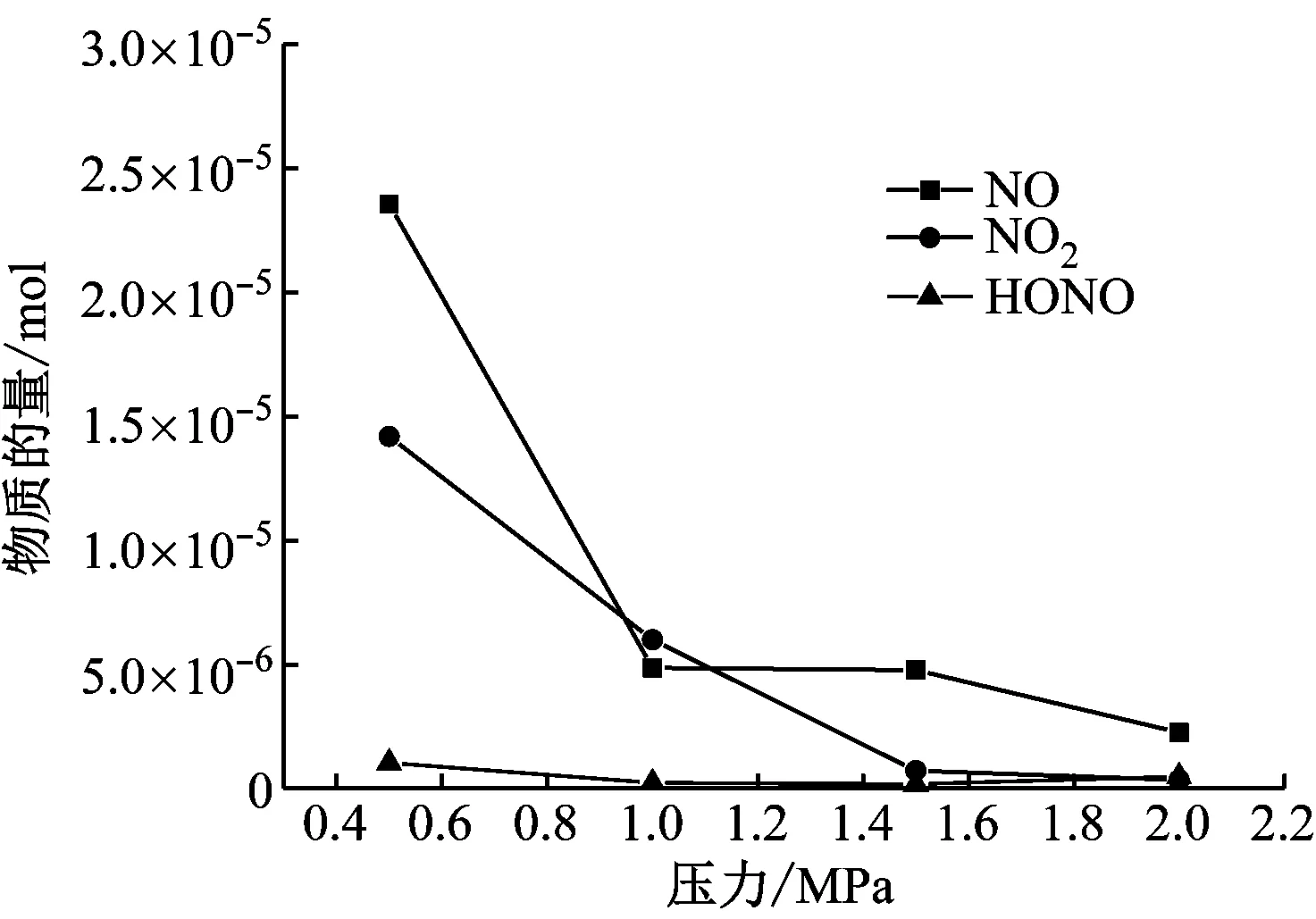
图8 溶液解析气体的组分分布
Fig.8 Distribution of different gas species from desorption of solutions
4 结 论
采用差分吸收光谱法与分光光度法分别测量氮氧化物气相和液相成分分布,通过计算获得的气液产物质量基本守恒。在气相状态下,NO转化率随着压力的升高和质量浓度增大而增大,当压力为2 MPa时,NO转化率达到98%;在液相状态下,随着压力的升高,NO2质量浓度逐渐减小,HONO的质量浓度则缓慢减小,并且HONO的N分子数占总氮比例随着压力的升高逐渐减小。在实验结束吹扫N2时,解析出的HONO物质的量随着压力升高先略微减小后基本不变。
笔者将进一步研究复杂工况下(存在CO2和SO2)HONO的生成规律,并揭示高压下HONO气相均相和气液非均相反应的来源和机制机理。

