miR-7敲减CD4+ T细胞过继转输对小鼠急性肝损伤模型的影响*
岳东旭, 赵娟娟, 陈慧子, 丁 涛, 胡 琳, 潘飞飞, 郭萌萌, 陈 超, 徐 林
(遵义医学院免疫学教研室暨贵州省生物治疗人才基地, 贵州省基因检测与治疗特色重点实验室, 贵州 遵义 563099)
急性肝损伤(acute liver injury, ALI)通常导致肝脏细胞在极短的时间内发生损伤和凋亡,引起肝脏组织正常功能明显降低,严重甚至可导致肝脏功能完全丧失,常伴有凝血功能障碍和黄疸等症状,严重者可发展成为肝性脑病[1]。大量研究报道,CD4+T细胞作为机体免疫系统的重要组成部分,其功能变化在急性肝损伤的发生发展过程中发挥了重要作用,然而其功能调控机制仍有待阐明[2-3]。微小RNA-7(microRNA-7,miR-7)作为微小RNAs(mi-RNAs)家族成员,与机体免疫细胞发育、免疫应答以及免疫相关临床疾病的发生过程密切相关[4]。新近,我们发现敲减(knock down,KD)miR-7的表达可明显加重小鼠的肝脏急性损伤,且伴随肝脏组织中CD4+T细胞的比例及其细胞因子干扰素γ(interfe-ron-γ, IFN-γ)分泌水平的明显上调,推测miR-7可能与CD4+T细胞的活化功能调控有关[5-6]。基于此,本实验利用过继转输实验技术,观察敲减miR-7的CD4+T细胞对小鼠急性肝损伤模型的影响,并分析过继转输的CD4+T细胞在体内的活化和功能的可能变化,以期为后续深入探讨miR-7对CD4+T细胞活化功能的调控作用、急性肝损伤的发生机制和治疗新策略开发提供新的实验依据。
材 料 和 方 法
1 实验动物
无特定病原体(specific pathogen free,SPF)级8~12周龄的FVB/N背景野生型(wild-type,WT)小鼠和FVB/N背景非条件性miR-7基因敲减小鼠[7-9]均饲养于遵义医学院生物医学中心SPF级动物实验室,实验过程中得到遵义医学院实验动物使用委员会的批准和伦理指导(2013016)。
2 主要试剂和仪器
4%多聚甲醛(重庆川东化工公司);HE染色液(泰康医疗);Mouse CD4+CD62L+T Cell Isolation Kit II (Miltenyi Biotec); IC Fixation Buffer、Permeabilization Buffer以及抗小鼠CD4、IFN-γ、CD62L和白细胞介素(interleukin-4, IL-4)流式抗体(eBioscience);RPMI-1640培养基(HyClone);羧基荧光素琥珀酰亚胺酯(carboxyfluorescein succinimidyl ester,CFSE;上海浩然生物技术有限公司)。SW-CJ-2FD型超净工作台(苏州净化设备厂);IX-51倒置显微镜和IX-71倒置荧光显微镜(Olympus);低温高速离心机(Thermo);流式细胞分析仪(Beckman Coulter)。
3 主要方法
3.1脾脏单细胞悬液的制备 断颈法处死伴刀豆球蛋白A(concanavalin A, ConA)诱导的WT和miR-7KD的ALI模型小鼠,75%的乙醇内浸泡5 min,超净台中取出脾脏组织后置于加有10 mL PBS缓冲液的平皿中,然后于200目无菌细胞筛上研磨组织,分别过滤2次;将获得的细胞悬液转移至15 mL 离心管中, 300×g离心10 min;弃上清,弹匀剩余液体和细胞,加入3 mL红细胞裂解液,置于冰上15 min;然后再加入10 mL PBS缓冲液重悬细胞,1 200 r/min,10 min,弃上清,弹匀剩余液体和细胞后,然后加入PBS缓冲液于200目筛网再次过滤,重复洗涤2次,将细胞液收集于新的15 mL离心管中,即得到脾脏组织单细胞悬液。
3.2磁珠分选小鼠脾脏CD4+CD62L+T细胞 取方法3.1中获得的小鼠脾脏组织单细胞悬液进行计数,按照10 μL/107cells 的比例,避光加入CD4+T cell biotin-antibody cocktail II,混匀,放置4 ℃冰箱,15 min;然后加入30 μL PBE(PBS+1%胎牛血清),按照20 μL/107cells的比例,避光加入anti-biotin MicroBeads,混匀,放置4 ℃冰箱,20 min;加入PBE至15 mL,放置离心机中, 300×g离心10 min,弃上清,弹匀剩余液体和细胞,加入2 mL PBE液;准备LS柱置于磁珠分选架上,加入1 mL PBE提前湿润磁珠,将带有抗体的细胞液转移至LS柱,用PBE液冲洗离心管2次,每次2 mL,均转移至LS柱,将液体收集于新的15 mL离心管,既得到CD4+T细胞悬液;进行计数,1 200 r/min离心10 min,缓慢弃上清,弹匀剩余液体和细胞,加入800 μL PBE重悬细胞,按照20 μL/107cell 的比例,避光加入CD62L (L-selectin) MicroBeads,混匀,4 ℃,20 min;加入PBE液至15 mL,于离心机中300×g离心10 min,缓慢弃上清,弹匀剩余液体和细胞,加入2 mL PBE液;准备LD柱置于磁珠分选架上,加入1 mL PBE提前湿润磁珠,将带有抗体的细胞液转移至LD柱,用PBE液冲洗离心管2次,每次2 mL,均转移至LD柱,将液体收集于15 mL离心管,既得到CD4+CD62L+T细胞悬液;将LD柱置于新的15 mL离心管上,加入2 mL PBE液,轻柔缓慢的推动柱芯,将CD4+CD62L+T细胞冲洗下来,重复2次。
3.3过继转输模型的建立 取磁珠分选获得的WT和miR-7KD小鼠脾脏组织中的CD4+CD62L+T细胞,使细胞重悬于PBS缓冲液中,配制单细胞悬液浓度为1×109/L,每1 mL细胞悬液中加入2 μL CFSE,37 ℃孵育10 min后,加入5倍体积的含2%胎牛血清的PBS,轻轻吹匀细胞,终止染色;经不含血清的PBS洗涤3遍。分别按照每只小鼠2×106个细胞经尾部静脉注射给同10周龄WT小鼠(n=6),12 h 后,建立急性肝损伤小鼠模型,48 h后收取相应的结果。
3.4观察小鼠肝脏组织形态学的变化 断颈法处死方法3.3中造模48 h后的WT和miR-7KD小鼠,分别取小鼠的肝脏组织,观察肝脏形态学变化、测量肝脏重量并计算重量指数[10], 重量指数=小鼠脏器/小鼠重量。
3.5HE染色检测小鼠肝脏组织的病理变化 断颈法处死方法3.3中造模48 h后的WT和miR-7KD小鼠,分别取所要观察小鼠的肝脏组织,4%甲醛固定24 h后,石蜡包埋,切片成5 μm厚度,HE染色,显微镜下观察其组织病理学结构变化。
3.6流式细胞术 取制备好的待测肝脏单细胞悬液(1×106~1×107个),用100 μL PBS缓冲液重悬细胞,转移至专用流式管中,分别加入流式抗体CD4-Percp-Cy5.5和CD62L-PE 1 μL,混匀,置于冰上避光孵育30 min,然后用PBS液洗涤2遍,1 200 r/min离心10 min;弃上清,弹匀细胞后,用100 μL PBS缓冲液重悬细胞,加入100 μL IC Fixation Buffer冰上孵育15 min,在加入200 μL Permeabilization Buffer 冰上孵育40 min,1 200 r/min离心10 min,弃上清。分别加入IL-4-APC和IFN-γ-PC5.5各1 μL,混匀冰上孵育40 min,然后用PBS洗涤2遍, 300×g离心10 min,弃去上清,用PBS补至500 μL,混匀,进行流式细胞术检测。
3.7RNA的提取 先将细胞加入1 mL RNAisoTMPlus,反复吹打,室温放置5 min,然后在标本中加入200 μL氯仿,剧烈振荡15 s,室温放置3 min,然后2~8 ℃、10 000×g离心15min,离心后样品分为3层,去水相中液体,转移到新的离心管,按照1 mL TRIzol的比例加入500 μL异丙醇,室温放置10 min,然后2~8 ℃、10 000×g离心10 min,弃去上清,加入1 mL 75%乙醇洗涤沉淀,然后2~8 ℃、7 500×g离心5 min,弃去上清,放置室温干燥5 min,加入25~200 μL无RNsae的水,混匀,放置于-80 ℃。
3.8Real-time PCR检测凋亡分子的相对表达水平 将提取的RNA利用TaKaRa的逆转录试剂盒,按照说明书利用Oligo dT Primer和Random 6-mers引物,使用反转录通用体系,进行反转录反应。反应条件为: 50 ℃ 15 min, 85 ℃ 5 s, 4 ℃保存。Bax的上游引物序列为5’-ATGCGTCCACCAAGAAGC-3’,下游引物序列为5’-CAGTTGAAGTTGCCATCAGC-3’;P53 的上游引物序列为5’-CGTAAACGCTTCGAGATGTTC-3’,下游引物序列为GACTGGCCCTTCTTGGTCTT-3’。Real-time PCR的条件是: 95 ℃ 10 min; 95 ℃ 30 s, 60 ℃ 6 s,共40个循环。结果采用2-ΔΔCt法计算。
4 统计学处理
实验数据以均数±标准差(mean±SD)表示。数据采用GraphPad Prism 5软件分析,组间比较采用两独立样本资料的t检验,以P<0.05为差异有统计学意义。
结 果
1 过继转输模型小鼠肝脏组织的形态学变化
与WT小鼠CD4+CD62L+T细胞转输对照组(WT组)相比,miR-7敲减CD4+CD62L+T细胞转输组(miR-7KD组)小鼠的肝脏组织颜色变浅,肝脏重量明显减轻(P<0.01),但肝脏的重量指数显著增加(P<0.05),见图1。

Figure 1. The morphological changes of the liver from WT and miR-7KD mice with acute liver injury. Mean±SD.n=6.*P<0.05,**P<0.01vsWT group.
图1小鼠肝脏组织形态、重量和重量指数的变化
2 过继转输模型小鼠肝脏组织病理学变化
HE染色结果显示,与对照组相比,miR-7KD转输组小鼠损伤的肝脏细胞明显增加,见图2。
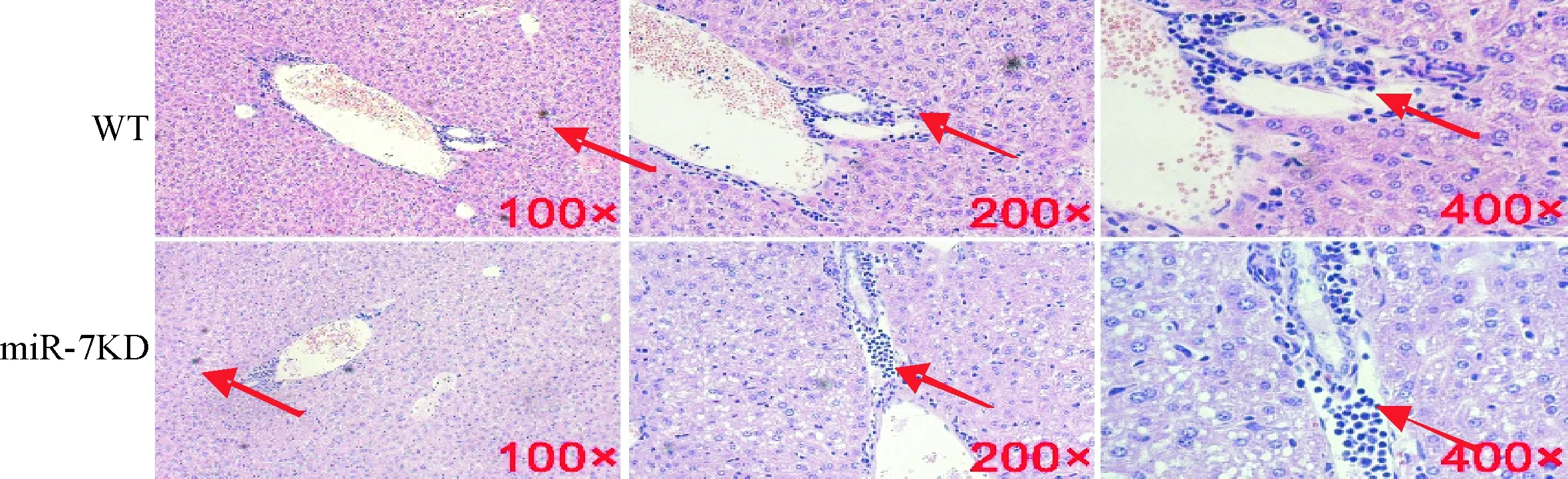
Figure 2. The pathological changes of the liver tissues observed by HE staining. The red arrowheads indicated the areas of the degenerating cells.
图2过继转输CD4+T细胞后小鼠肝脏组织病理学变化
3 ALI模型小鼠肝脏组织凋亡分子表达的变化
Real-time PCR结果显示,与对照组相比,miR-7KD转输组小鼠肝脏组织中促凋亡蛋白分子Bax和P53的mRNA水平均明显升高(P<0.05,P<0.01),见图3。

Figure 3. The mRNA expression levels of Bax and P53 in the li-ver from acute liver injury model mice. Mean±SD.n=6.*P<0.05,**P<0.01vsWT group.
图3过继转输小鼠模型肝脏组织中凋亡蛋白分子的表达变化
4 ALI模型小鼠肝脏组织中CD4+ T细胞活化水平变化
流式细胞术的检测结果显示,与对照组相比,在miR-7KD转输组小鼠的肝脏组织中,转输CD4+T细胞活化膜分子CD62L的表达水平明显降低(P<0.05),见图4。
5 过继转输的CD4+ T细胞分泌细胞因子水平变化
流式细胞术的检测结果显示,与对照组相比,在miR-7KD转输组小鼠的肝脏组织中,CFSE+CD4+T细胞分泌的IFN-γ水平明显升高(P<0.05),而IL-4的表达水平则显著下降(P<0.01),见图5。

Figure 4. The levels of CD62L in the CD4+T cells from acute liver injury model mice. Mean±SD.n=6.**P<0.01vsWT group.
图4过继转输小鼠模型肝脏组织中CD4+T细胞的活化膜分子CD62L的水平
讨 论
微小RNAs是一段内源性非编码RNA分子,对转录后基因表达起重要的负调控作用。新近研究显示,微小RNAs在包括ALI在内的多种肝脏疾病发生中起到了关键调节作用,改变特定miRNA的表达水平可影响肝脏组织损伤的发展进程,如Xuan 等[11]利用腹腔注射CCl4诱导小鼠肝纤维化时,发现当miR-652和miR-29a的表达水平升高,能通过调控β-arrestin 1的表达来抑制小鼠CD4+T细胞的活化,进而减轻小鼠肝纤维化的发生。类似的,Yang等[12]也报道了miR-15a/miR16-1基因敲除之后,CD4+T细胞能够产生更多的IL-22,增强肝脏组织的修复能力。以上数据提示,深入探讨特定miRNA分子在ALI等肝脏疾病发生过程中的调节作用,不仅有助于对相关疾病发生机制的认识,且对后续临床诊断治疗新策略开发均具有积极意义。miR-7作为miRNA家族成员,在包括肝脏等的多个组织、器官及细胞中存在表达,且与组织器官的发育、分化及损伤修复密切相关[13]。近来研究报道miR-7与肝脏相关疾病的发生也密切相关[14]。新近,我们利用ConA诱导ALI小鼠模型,发现miR-7缺乏可明显加重肝脏组织的炎症损伤,同时肝脏组织中CD4+T细胞的活化水平及其细胞因子IFN-γ的分泌水平明显上调[5]。该研究提示miR-7可能是ALI发生的新调控分子。然而,其具体调控机制仍有待阐明。
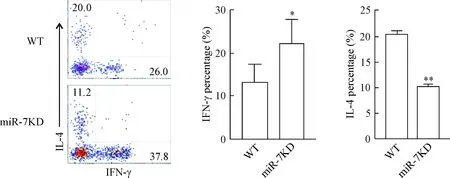
Figure 5. The levels of IL-4 and IFN-γ in the CD4+T cells. Mean±SD.n=6.*P<0.05,**P<0.01vsWT group.
图5转输组小鼠肝脏组织中转输的CD4+T细胞IL-4和IFN-γ的表达情况
过继细胞转输(adoptive cell transfer,ACT)是观察特定细胞群体体内功能改变和效应的重要技术平台[15-16]。我们课题组前期利用ACT实验发现在小鼠自身免疫性肠炎中miR-126KD后,CD4+T细胞活化水平显著升高,提示miR-126在CD4+T细胞体内活化和功能具有重要调控作用[17]。此外,郑晨宏等[18]在ConA诱导的小鼠ALI中,采用过继转输技术观察到CD24缺陷可降低肝细胞STAT1磷酸化来降低CD4+T细胞分泌IFN-γ,进而减轻急性肝损伤的病理损伤。在本实验中,我们也利用过继转输实验,首次观察到过继转输的miR-7敲减小鼠来源CD4+T细胞可显著增加急性肝损伤模型小鼠的肝脏组织损伤,包括肝组织重量明显减轻,重量指数明显增加;HE结果也显示肝脏组织炎性细胞浸润明显增多;同时,肝脏组织促凋亡分子Bax和P53的mRNA水平均显著升高。这些结果表明,miR-7敲减的CD4+T细胞可显著加重急性肝损伤模型小鼠的病理变化。更为重要的是,我们发现在转输组在miR-7KD之后CD4+T细胞活化相关分子CD62L的表达水平明显降低,其细胞因子IFN-γ的表达水平明显增高,IL-4的表达水平则明显下降。与之一致的是,我们在前期相继发现miR-7在活化的CD4+T细胞中明显高表达[7];并且,当miR-7基因敲减后,小鼠脾细胞体外活化能力明显增强,同时伴随了CD4+T细胞比例及细胞因子分泌能力的改变。这些研究结果提示,miR-7可能是通过对CD4+T细胞活化和功能的调控,进而参与急性肝损伤的发生过程。然而,miR-7调控CD4+T细胞活化功能的确切效应和机制仍有待后续研究阐明。
总之,本研究中我们首次发现过继转输miR-7敲减CD4+T细胞可加重急性肝损伤模型小鼠肝损伤,同时CD4+T细胞活化功能增强,为后续深入研究急性肝损伤发生机制和临床诊断治疗新靶标的发现提供了重要前期实验依据。

