紫草素对卵巢癌细胞SKOV3/DDP顺铂耐药的逆转作用
许 静, 郭 哲, 王秋宇, 梁殿迅
(南阳市中心医院妇产科, 河南 南阳 473000)
卵巢癌是常见的妇科恶性肿瘤之一,具有较高的发病率及致死率;且目前治疗方式仍以放化疗为主,而化疗药物的毒副作用及获得性耐药的出现成为影响治疗效果及患者预后的主要因素[1-3]。目前关于肿瘤化疗耐药的研究多是从细胞分子水平寻找相应的靶点,并探讨其个性化治疗的可行性[4];而祖国传统医学在治疗复杂疾病上具有先天的优势,将其用于肿瘤的辅助治疗可显著改善患者预后,提高生存率[5]。紫草素(shikonin, SHI)是从天然紫草的根部提取出的一种脂溶性很强的萘醌类化合物,具有抗炎、抗氧化、抗凋亡和抗肿瘤等功能,具有广阔的临床应用前景[6-7]。早期有研究显示,紫草素可通过调节表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路逆转肺腺癌细胞H1975对埃克替尼的获得性耐药[8];但其在妇科肿瘤中的应用,目前仍需要大量的实验验证。本研究以人卵巢癌细胞系SKOV3及其顺铂(cisplatin,DDP)耐药细胞系SKOV3/DDP为对象,评估紫草素对其顺铂耐药的作用,并从细胞生长及凋亡的角度初步探讨其潜在的作用机制,为紫草素在卵巢癌化疗中的配伍使用提供实验依据和一定的理论基础。
材 料 和 方 法
1 材料与试剂
SKOV3和SKOV3/DDP细胞为本实验室自行冻存;细胞培养用RPMI-1640培养基购自HyClone;紫草素购自Enzo Biochem;注射用顺铂购自齐鲁制药公司;CCK-8细胞活力检测试剂盒购自广州赖德公司;抗细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶2(cyclin-dependent kinases 2, CDK2)、P18、p-Rb、Rb、Bcl-2、Bax、cleaved caspase-3、caspase-3和β-actin抗体均购自江苏碧云天公司;流式细胞周期检测试剂盒及凋亡检测试剂盒均购自南京凯基公司。
2 实验方法
2.1细胞培养 卵巢癌细胞系SKOV3及其顺铂耐药细胞系SKOV3/DDP常规培养于RPMI-1640完全培养基中,培养基中添加10%胎牛血清(FBS)、1%青霉素、1%链霉素,此外SKOV3/DDP细胞的培养基中需间断性加入4 μmol/L顺铂以保证细胞的耐药性。细胞置于37 ℃、5% CO2的细胞培养箱中,并定期换液和传代。
2.2细胞活力测定 采用CCK-8法测定经不同处理后细胞活力的变化,将SKOV3及SKOV3/DDP细胞按照每孔5 000个的密度接种至96孔板中,给予相应的处理,并与药物处理结束前2 h向每孔加入10 μL 的CCK-8试剂,然后将培养板重新置于细胞培养箱中继续孵育2 h,最后用酶标仪检测培养板各孔在450 nm波长处的吸光度(A)值,计算细胞的相对活力。每组设置3个复孔取其均值,同时设只加入培养基的单孔作为空白对照。不同实验的分组设置如下:为了确定顺铂对SKOV3及SKOV3/DDP细胞的IC50,将顺铂的浓度梯度设置为0、3.13、6.25、12.5、25和50 μmol/L;为了确定紫草素的耐药逆转浓度,紫草素的浓度梯度设置为0、1、2、4、6、8和10 μmol/L。选取无细胞毒性作用的一组作为紫草素的耐药逆转浓度。
2.3细胞周期分布的检测 依据公司提供的操作说明书进行实验,首先采用不加EDTA的胰酶消化并离心收集各组细胞,然后向细胞中加入70%的无水乙醇置于4 ℃避光固定过夜。离心洗去乙醇后避光加入碘化丙啶染液作用30 min,最后用流式细胞仪检测Ex=488 nm处的荧光强度,分析各期的细胞百分比。实验分组如下:对照(control)组,不加顺铂及紫草素;紫草素(SHI)组,紫草素浓度为4 μmol/L;顺铂(DDP)组,顺铂浓度为12.5 μmol/L;顺铂及紫草素联用(SHI+DDP)组,顺铂浓度为12.5 μmol/L,紫草素浓度为4 μmol/L。
2.4细胞凋亡检测 依据公司提供的操作说明书进行实验,首先采用不加EDTA的胰酶消化并离心收集各组细胞,然后向细胞中加入Binding Buffer重悬,先后加入Annexin V-FITC及碘化丙啶(propidium iodide,PI)染液孵育,最后用流式细胞仪检测各组在Ex=488 nm及 Em=530 nm处的荧光强度,分析其凋亡率。实验分组同细胞周期检测。
2.5Western blot检测经不同处理后细胞中细胞周期和凋亡相关蛋白的水平 RIPA(含cocktail)萃取各组细胞蛋白并定量,依据定量结果调整上样蛋白量(80 μg)后进行SDS-PAGE。待电泳结束后,将蛋白电转至PVDF膜。脱脂奶粉封闭PVDF膜后,按抗体说明书要求的比例孵育相应的抗体。于暗室中显影,曝光并冲洗胶片。蛋白表达采用ImageJ软件行灰度半定量分析。实验分组同细胞周期检测。
3 统计学处理
所得数据录入SPSS 15.0软件中进行统计学分析。实验结果以均数±标准差(mean±SD)表示,多组间的比较采用单因素方差分析,各组均数间的两两比较用Bonferroni校正的t检验,以P<0.05表示差异有统计学意义。
结 果
1 紫草素及顺铂对SKOV3/DDP细胞活力的影响
本研究首先采用CCK-8法确定SKOV3/DDP细胞对顺铂的耐药性,结果如图1所示,顺铂可浓度依赖性抑制SKOV3及SKOV3/DDP细胞的活力,其中顺铂对SKOV3细胞和SKOV3/DDP细胞的IC50分别为(5.32±1.04) μmol/L和(22.51±3.15) μmol/L;SKOV3/DDP细胞对顺铂具有明显的耐药性,可用于后续实验分析。
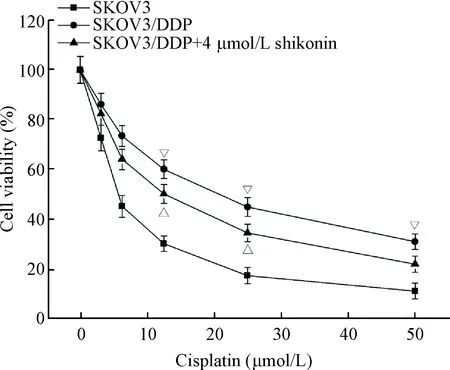
Figure 1. The effect of shikonin on the viability of cisplatin-resis-tant ovarian cancer SKOV3/DDP cells. Mean±SD.n=6.▽P<0.05vsSKOV3 group;△P<0.05vsSKOV3/DDP group.
图1紫草素对卵巢癌耐药细胞SKOV3/DDP细胞活力的影响
CCK-8法细胞活力检测的结果显示,SKOV3/DDP细胞经不同浓度的紫草素处理24 h后,细胞活力随紫草素浓度的增加而有所降低,其中8 μmol/L及10 μmol/L的紫草素可显著抑制细胞活力;处理48 h后,紫草素浓度在6 μmol/L、8 μmol/L及10 μmol/L时的作用较为显著,后续实验选取无抑制活力作用的浓度为紫草素的耐药逆转浓度,即4 μmol/L,见表1。
为进一步检测紫草素是否可逆转卵巢癌细胞SKOV3/DDP的耐药性,本研究采用CCK-8法检测了预孵4 μmol/L紫草素之后,顺铂对SKOV3/DDP细胞的杀伤作用,结果显示,经过4 μmol/L紫草素预孵之后,SKOV3/DDP细胞对顺铂的敏感性显著增加,顺铂的IC50由(22.51±3.15)μmol/L降低至(13.43±3.24)μmol/L,见图1。由此可见,紫草素可逆转卵巢癌细胞SKOV3/DDP的耐药性;且在顺铂浓度为12.5 μmol/L时,差异较为显著,故而后续实验选用此浓度进行处理。
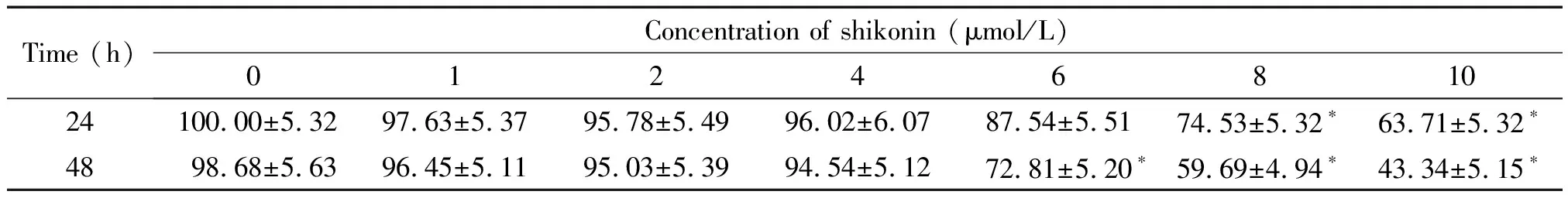
表1 紫草素对SKOV3/DDP细胞活力的影响
*P<0.05vs0 μmol/L group.
2 紫草素和顺铂联用对SKOV3/DDP细胞周期的影响
流式细胞术检测细胞的周期分布,结果显示,相比于对照组,顺铂处理组G0/G1期细胞所占百分比增加(P<0.05),S期细胞所占百分比减少(P<0.05);而紫草素和顺铂联合处理组G0/G1期细胞所占百分比进一步增加,S期细胞所占百分比进一步降低,见图2。这说明在SKOV3/DDP细胞中,相较于单用顺铂,紫草素和顺铂联用可进一步抑制细胞周期由G0/G1期向S期转换。
3 紫草素和顺铂联用对SKOV3/DDP细胞凋亡的影响
流式细胞术及Annexin V/PI双染法检测细胞凋亡的结果显示,相比于对照组,顺铂处理组细胞的凋亡率显著增加(P<0.05);而加入4 μmol/L的紫草素预孵后,细胞凋亡率进一步增加(P<0.05),见图3。这一结果说明紫草素可进一步促进顺铂诱导的SKOV3/DDP细胞凋亡。
4 紫草素和顺铂联用对细胞周期及凋亡相关蛋白水平的影响
Western blot检测结果显示,相比于对照组,顺铂处理组细胞内cyclin D1、CDK2、p-Rb及Bcl-2的蛋白水平有所降低(P<0.05), P18、Bax 及cleaved caspase-3的蛋白水平则呈增加趋势(P<0.05);紫草素和顺铂联合处理组的细胞经4 μmol/L紫草素孵育之后,cyclin D1、CDK2、p-Rb/Rb及Bcl-2的蛋白水平相比于DDP组显著降低(P<0.05); P18、Bax 及cleaved caspase-3的蛋白表达相比于DDP组则进一步增加(P<0.05),见图4。这一结果说明紫草素可影响SKOV3/DDP细胞内周期及凋亡相关因子的蛋白表达。
讨 论
紫草素是从植物紫草中提取的中草药提取物,具有抗肿瘤效应,且自身毒副作用较小。本研究探究了紫草素对卵巢癌细胞化疗耐药性的影响,结果显示紫草素可增加SKOV3/DDP细胞对顺铂的敏感性,具有耐药逆转效应。肿瘤化疗耐药性的获得机制较为复杂,但也是导致化疗失败的主要原因。目前的研究显示,肿瘤细胞抗凋亡能力的增加是肿瘤细胞对化疗药物产生抗性一个重要原因[9-10]。故而本研究进一步检测了合用紫草素之后耐药细胞SKOV3/DDP的细胞活力及凋亡情况,流式细胞术的结果显示在SKOV3/DDP细胞中,相较于单用顺铂及紫草素和顺铂联用均可进一步抑制细胞周期由G0/G1期向S期转换,并促进细胞凋亡。这一结果提示紫草素逆转卵巢癌细胞SKOV3/DDP顺铂耐药的机制包括促进细胞凋亡,抑制细胞生长。
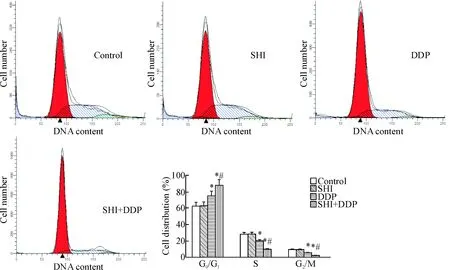
Figure 2. The effect of shikonin (SHI) on the cell cycle distribution of SKOV3/DDP cells. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsDDP group.
图2紫草素对SKOV3/DDP细胞周期的影响
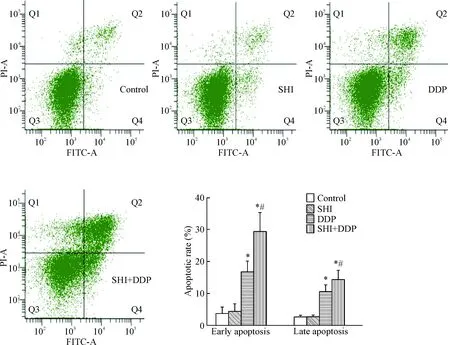
Figure 3. The effect of shikonin (SHI) on the apoptosis of SKOV3/DDP cells. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsDDP group.
图3紫草素对SKOV3/DDP细胞凋亡的影响
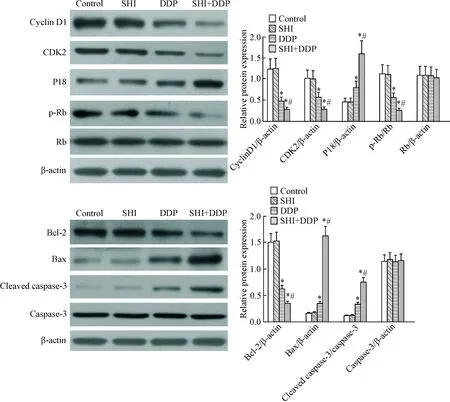
Figure 4. The effect of shikonin (SHI) on the protein levels of cell cycle- and apoptotic-related molecules in the SKOV3/DDP cells. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsC group.
图4紫草素对SKOV3/DDP细胞中细胞周期及凋亡相关因子蛋白水平的影响
为进一步研究紫草素对SKOV3/DDP细胞周期及细胞凋亡的作用机制,本实验采用Western blot检测了周期及凋亡相关调控因子的表达。细胞周期的G1/S转换是细胞周期的关键调控点,正常情况下细胞周期蛋白可与周期蛋白依赖性激酶形成复合物,催化Rb的磷酸化,进而促进细胞周期经G0/G1期进入S期完成DNA的复制;该过程则受到CDK抑制剂的负调控[11-12]。故此本实验检测了cyclin D1、CDK2、CDK抑制剂P18的蛋白表达以及Rb的磷酸化情况。结果显示,相较于顺铂单处理组,紫草素和顺铂联合处理组的细胞,cyclin D1、CDK2和p-Rb/Rb的蛋白水平显著降低, P18的蛋白水平则进一步增加。这提示紫草素可影响周期相关调控因子的表达,进而抑制SKOV3/DDP细胞周期的G1/S转换。
细胞的凋亡大致可分为内、外源2条途径,但无论是何种凋亡途径,最终都会伴随caspase-3家族的激活[13],本实验的检测结果也证实了紫草素可上调cleaved caspase-3的表达,促进耐药细胞SKOV3/DDP的凋亡。Bcl-2和Bax是B细胞白血病/淋巴瘤2家族的2个有效成员,是重要的细胞凋亡调节因子,其中Bcl-2发挥抗凋亡作用,而Bax发挥促凋亡作用,Bcl-2/Bax的比值决定了凋亡易感性,也是启动细胞凋亡的关键环节[14-15]。Bcl-2/Bax比值降低往往与肿瘤细胞的化疗敏感性密切相关[16]。本实验的检测结果显示,相较于顺铂单处理组,紫草素和顺铂联合处理组的细胞Bcl-2的蛋白表达显著降低;Bax的蛋白表达则进一步增加;Bcl-2/Bax失平衡可能是紫草素促进耐药细胞SKOV3/DDP凋亡的机制之一。
综上所述,紫草素联合顺铂使用可显著提高卵巢癌细胞SKOV3/DDP的化疗敏感性,其作用机制可能是通过影响细胞周期调控因子cyclin D1、CDK2、P18和p-Rb的蛋白水平,抑制细胞周期的G1/S转换;同时下调抗凋亡因子Bcl-2,促进细胞经caspase-3发生凋亡,最终导致存活与凋亡的失平衡。

