IgE-FcεRI交联促进过敏性哮喘小鼠动脉粥样硬化的发生发展*
郜珊珊, 周 娟,3, 袁祖贻,3, 王丽君,3△
(西安交通大学 1第一附属医院心血管内科, 2陕西省分子心脏病学重点实验室, 3环境与疾病相关教育部重点实验室, 陕西 西安 710061)
多种炎症免疫性疾病的发生发展都与CD4+T细胞亚群平衡的改变有关,包括动脉粥样硬化(atherosclerosis,AS)和过敏性哮喘(allergic asthma)。经典观点认为AS的慢性炎症是以Th1型免疫反应为主导的[1-3],而过敏性哮喘则是以Th2型免疫反应为主导[4-6],两者代表着CD4+T细胞炎症反应的不同方向,但临床流行病学研究资料对两者的关系仍未有定论。我们前期研究发现过敏性哮喘可以促进ApoE-/-小鼠AS斑块的形成和发展,并导致其稳定性降低[7];Liu等[8]的研究也显示,急、慢性过敏性肺部炎症都可以促进小鼠AS斑块面积增加,病变部位炎性细胞浸润增加,胶原纤维和平滑肌含量减少,以及损伤细胞和凋亡增加[9],但具体机制目前尚不清楚。已有研究表明白细胞介素4(interleukin-4,IL-4)可以诱导B淋巴细胞产生大量免疫球蛋白E(immunoglobulin E, IgE)[10],而IgE可以结合在巨噬细胞和肥大细胞表面的Fc ε受体(Fc ε receptor, FcεR),进而活化靶细胞并促进炎症进展[9,11-12]。Wang等[13]的研究也发现,冠心病患者的血浆IgE水平显著升高,且与斑块不稳定性相关,患者斑块局部尤其是富含巨噬细胞区域的IgE及其受体FcεRI表达水平增高,提示我们IgE-FcεRI交联激活巨噬细胞可能是导致AS进展的一个重要途径。本研究拟在过敏性哮喘ApoE-/-鼠模型中,观察过敏性哮喘加速AS发生发展是否与Th2细胞及其代表性细胞因子IL-4有关,以及IgE-FcεRI交联激活巨噬细胞在其中所发挥的作用。
材 料 和 方 法
1 材料
C57BL/6J背景的ApoE-/-小鼠是本实验室的维持品系,饲养于西安交通大学医学部实验动物中心。卵清蛋白(ovalbumin,OVA)及氢氧化铝均购自Sigma;油红O染料购自Amresco;流式细胞术用抗体和相关试剂购自eBioscience;TRIzol和SYBR®Premix Ex TaqTMII 试剂盒购自TaKaRa;逆转录试剂盒购自Thermo Fermentas;IL-4 ELISA试剂盒购自RayBiotech;IgE ELISA试剂盒购自Cayman Chemical;佛波酯(phorbol 12-myristate 13-acetate,PMA)、离子霉素(ionomycin, Ion)和莫能霉素(monensin,Mon)购自杭州联科生物公司;FITC标记的抗小鼠IgE购自NOVUS;兔抗小鼠FcεRIα抗体及相应的 II 抗购自Santa Cruz;抗IL-4单克隆抗体(monoclonal antibody,mAb)购自R&D;其余试剂均为国产或进口分析纯。Leica恒冷切片机、Olympus BX51正置荧光显微镜、Bio-Rad IQ5实时定量PCR仪和BioTek自动酶标仪来自西安交通大学心内科实验室;Becton流式细胞仪来自西安交通大学医学部中心实验室。
2 方法
2.1动物模型制备和分组 6周龄ApoE-/-小鼠随机分为对照(control)组、哮喘安慰剂干预(asthma)组和哮喘IL-4 mAb干预(IL-4 mAb)组(n=6),其中哮喘模型小鼠于第0、7和14天给予腹腔注射OVA+氢氧化铝佐剂进行致敏(每只0.2 mL,含500 mg/L OVA),并于第14天开始以1% OVA溶液进行雾化吸入激发哮喘发作,每周3次,每次30 min,共计8周,对照组同时给予PBS雾化吸入;此外,哮喘IL-4干预组和哮喘安慰剂干预组分别给予IL-4 mAb(每次100 μg)和生理盐水腹腔注射,每周1次,共8周。
2.2标本采集 所有小鼠于末次激发后24 h处死,眼球采血后收集血清并分装保存于-80 ℃冰箱直至检测。采血后小心剥取并将脾脏均分为两半,一半迅速投入液氮速冻后保存于-80 ℃冰箱用于real-time PCR检测,另一半用RPMI-1640培养液冲洗后转移到200目的钢滤网上进行充分研磨并收集细胞悬液,裂解红细胞2次后重悬并计数细胞,调整细胞密度至8×109/L 待用;取脾后迅速开胸并充分暴露心脏,生理盐水心脏灌流冲净血管及组织中的残留血液,分离并取下主动脉根部,4%多聚甲醛固定1 h,25%蔗糖脱水至组织沉底。滤纸吸干多余水分,OCT 复合物包埋储存于-80 ℃冰箱直至切片。
2.3主动脉根部斑块染色 OCT包埋的主动脉根部连续横切,以见到3 个主动脉瓣为标志,连续收集7 μm 厚的系列冰冻切片共400 μm 长,每张玻片6个切片。-20 ℃冰箱保存切片。油红O染色检测主动脉根部的脂质含量,以斑块面积占管腔横截面积的百分比来代表病变面积的相对大小。同时,采用FITC标记的抗小鼠IgE抗体进行免疫荧光染色检测斑块内的IgE含量,兔抗小鼠FcεRIα抗体及相应的 II 抗进行免疫组织化学染色法检测斑块内的FcεRIα含量,以阳性面积占斑块面积的百分比代表斑块内的IgE和FcεRIα表达含量。
2.4流式细胞术 取2×106脾细胞悬液,加入25 μg/L PMA、1 mg/L Ion和1.7 mg/L Mon,37 ℃培养箱孵育6 h后,1 500×g离心5 min 后弃去上清;洗涤细胞后加入100 μL PBS(含0.25 μL CD4-FITC),4 ℃避光孵育40 min;洗涤细胞后加入200 μL IC Fixation Buffer,避光孵育20 min;然后直接加入1 mL 破膜缓冲液洗涤细胞,1 500×g离心5 min 后弃去上清;加入100 μL 破膜缓冲液(含0.625 μL IL-4-PE),室温避光孵育20 min;洗涤细胞后加入500 μL PBS 重悬细胞,4 ℃保存并于24 h 内上机检测。
2.5脾脏mRNA提取和real-time PCR检测 取小鼠脾脏,TRIzol法提取总RNA,Fermentas逆转录试剂盒将RNA逆转录为cDNA,以管家基因GAPDH为内参照,用SYBR® Premix Ex TaqTMII 试剂盒(TaKaRa)进行real-time PCR反应检测各指标的表达。所有引物序列均由上海捷瑞基因公司合成,见表1。用2-ΔΔCt法分析mRNA的相对表达量。

表1 Real-time PCR引物序列
2.6ELISA方法检测血清细胞因子水平 双抗体夹心ELISA法检测血清IL-4和IgE含量,具体操作方法根据试剂盒说明书进行。
3 统计学处理
用SPSS 20.0统计软件进行数据处理和统计分析。所有数据以均数±标准差(mean±SD)表示,各组数据均经过正态性检验,符合正态分布的数据采用单因素方差分析(one-way ANOVA)进行分析比较,不符合正态分布的数据采用Kruskal-WallisH检验进行分析,以P<0.05表示差异有统计学意义。
结 果
1 小鼠主动脉根部AS斑块面积的改变
采用油红O染色检测各组小鼠主动脉根部AS斑块面积,结果显示过敏性哮喘组小鼠AS斑块面积较对照组有显著增加(P<0.05);而用IL-4 mAb干预哮喘组小鼠8周后,斑块面积被显著抑制(P<0.05),见图1。

Figure 1. The changes of the lesion area in the aortic root of the mice (oil red O staining,×100). Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsasthma group.
图1小鼠主动脉根部AS斑块面积的改变
2 小鼠体内Th2细胞及其代表性细胞因子IL-4 水平的改变
为了检测过敏性哮喘对ApoE-/-小鼠体内Th2细胞含量的影响,我们用流式细胞术检测了CD4+IL-4+T细胞在脾细胞悬液中的百分比,结果显示过敏性哮喘组小鼠体内的Th2细胞水平较对照组显著增加(P<0.05),见图2A;除此之外我们还检测了Th2细胞代表性细胞因子IL-4在脾脏和血清中的表达水平,结果显示过敏性哮喘组小鼠脾脏IL-4 mRNA水平和血清含量均较对照组显著增高(P<0.05),见图2B、C。

Figure 2. The effect of allergic asthma on the proportion of Th2 cells (A) and the level of IL-4 (B and C) in the mice. Mean±SD.n=6.*P<0.05vscontrol group.
图2过敏性哮喘对小鼠体内Th2细胞和IL-4含量的影响
3 小鼠体内IgE和FcεRIα表达水平的改变
我们发现过敏性哮喘状态可以导致ApoE-/-小鼠AS病变加重同时体内的Th2细胞和IL-4水平增高;为了观察IL-4的增高是否会导致IgE和FcεRIα的表达增高以及巨噬细胞活化,我们用免疫荧光/组织化学染色法检测ApoE-/-小鼠主动脉根部AS斑块内IgE和FcεRIα的表达水平,结果显示过敏性哮喘组小鼠主动脉根部斑块内IgE和FcεRIα的表达较对照组显著增加(P<0.05);同时过敏性哮喘组小鼠血清IgE也较对照组明显增高(P<0.05)。 与哮喘组比较,经过8周的IL-4 mAb干预后,增高的IgE和FcεRIα表达水平被显著抑制(P<0.05),血清IgE水平也显著降低(P<0.05),见图3。
4 小鼠体内巨噬细胞活化状态的改变
为了检测小鼠体内巨噬细胞活化状态的改变,我们还用real-time PCR检测了巨噬细胞相关炎性因子单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)、巨噬细胞炎症蛋白1α(macrophage inflammatory protein-1α,MIP-1α)和IL-6 在小鼠脾脏的mRNA表达水平,结果显示过敏性哮喘组小鼠的上述因子表达水平较对照组显著增加(P<0.05),即过敏性哮喘状态下小鼠体内的巨噬细胞活化程度有显著增加。与哮喘组比较,用IL-4 mAb干预过敏性哮喘组小鼠8周后,巨噬细胞相关炎性因子MCP-1、MIP1α和IL-6 在脾脏的mRNA表达水平显著降低(P<0.05),即IL-4抑制状态下巨噬细胞活化程度被显著抑制,见图4。
讨 论
动脉粥样硬化和过敏性哮喘的慢性炎症都与CD4+T细胞亚群的失衡有关,以分泌IFN-γ为主的Th1细胞过度增殖,并进一步活化如巨噬细胞等其它炎性细胞,是AS病变不断进展的重要机制[1-2, 14];而过敏性哮喘则是免疫反应向Th2型偏移所导致的[15],尽管哮喘是一种异质性疾病,但几乎在所有类型哮喘患者的肺部都能检测到有Th2细胞增多,尤其是在过敏性哮喘患者[16]。活化的Th2细胞可以产生细胞因子,如IL-4等,IL-4可以促进B细胞合成变应原特异性的IgE[17],IgE进一步上调并结合于效应细胞表面的FcεR并活化靶细胞合成和分泌多种炎性介质,从而导致炎症不断进展[18-19]。但Th2和IL-4在AS的发生发展中的作用到目前为止依然是有争议的,一些研究显示IL-4对AS的发展有保护作用[20-21],而另外一些研究则发现IL-4敲除可以抑制ApoE-/-小鼠的AS进展[22]。

Figure 3. The changes of IgE and FcεRIα in the mice (×200). Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsasthma group.
图3小鼠体内IgE和FcεRIα表达水平的改变
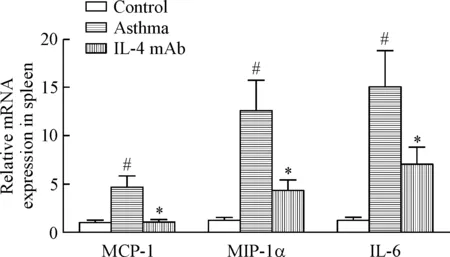
Figure 4. The changes of the macrophage activation state in the mice. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsasthma group.
图4小鼠体内巨噬细胞活化状态的改变
在本研究中,我们观察到过敏性哮喘可以加速ApoE-/-小鼠主动脉根部AS的发生发展,同时伴随着体内Th2细胞及其代表性细胞因子IL-4水平的显著增高,提示我们过敏性哮喘对小鼠AS发生发展的促进作用可能与Th2细胞的增加有关;为了进一步确定是否增高的Th2细胞和IL-4就是过敏性哮喘促进AS不断进展的原因,我们用IL-4 mAb干预过敏性哮喘ApoE-/-小鼠8周,发现主动脉根部斑块病变显著减少,提示我们过敏性哮喘对小鼠AS病变的促进作用确实是通过Th2细胞和IL-4水平增加而发挥作用的。
既往研究表明,IL-4可以诱导B细胞产生IgE[23],而IgE可以结合在巨噬细胞和肥大细胞表面的FcεR,进而促进炎症过程的进展[17-18]。而且,活化的FcεRI可以在如DCs细胞等影响IFN-γ介导的促炎反应,以及抗炎性细胞因子的产生[24]。Wang等[13]研究发现,冠心病患者的血浆IgE水平显著升高并且与斑块不稳定性相关,患者斑块局部尤其是富含巨噬细胞区域的IgE及其受体FcεRI表达水平增高,并且在ApoE-/-FcεRIα-/-小鼠发现AS病变程度减轻,炎性细胞和炎性因子显著减少;该小组的另一项研究也表明,IgE水平是糖尿病和糖尿病前期患者的一个独立危险因素[25];提示IgE和FcεR对人和小鼠AS的发生发展可能有促进作用。因此,我们推测,过敏性哮喘状态下小鼠体内增加的Th2细胞及其细胞因子IL-4可能是通过刺激B细胞合成和分泌大量的IgE,IgE进一步上调和结合于巨噬细胞表面的FcεRI,从而促进巨噬细胞的活化并导致AS炎症反应加剧。
为了验证上述假设,我们检测了IgE和FcεRIα在斑块局部的表达水平,结果显示IgE和FcεRIα的表达在过敏性哮喘ApoE-/-小鼠主动脉根部AS斑块中是显著增高的,然而在8周的IL-4 mAb干预后,其表达显著降低;为了确认巨噬细胞是否确实被活化,我们还进一步检测了巨噬细胞相关炎性因子的mRNA表达水平,发现MCP-1、 MIP1α和IL-6的mRNA表达水平在过敏性哮喘小鼠都显著增高,说明过敏性哮喘状态下巨噬细胞被激活,然而在8周的IL-4 mAb干预后上述炎症因子的表达水平被显著抑制,进一步证实了我们的假设,即过敏性哮喘状态下增高的Th2细胞和IL-4确实是通过IgE-FcεRIα交联途径激活巨噬细胞,从而导致AS病变不断进展的。
综上所述,本研究发现OVA诱导的过敏性哮喘可以促使ApoE-/-小鼠体内Th2细胞和IL-4水平显著增加,并进一步通过IgE-FcεRIα交联途径激活巨噬细胞,从而导致AS病变加速进展。本研究为过敏性哮喘加速AS的机制增添了新的证据,并为其进一步深入研究奠定了理论基础。

