类风湿关节炎患者CD4+CXCR5+Tfh细胞水平的检测及临床意义
闫天懿,徐廷双,李 萍
(吉林大学中日联谊医院 风湿免疫科,吉林 长春130033)
类风湿关节炎(RA)是以慢性多关节滑膜炎为主要临床表现的自身免疫性疾病,以关节滑囊组织炎症和关节破坏为主要特征[1,2]。RA的病因尚不清楚,可能与免疫紊乱、遗传、感染、环境等有关。已知当抗原进入人体后,激活辅助性T淋巴细胞分泌细胞因子等炎性因子,激活B淋巴细胞分化为浆细胞,进而分泌包括抗环瓜氨酸多肽抗体(CCP)在内的大量免疫球蛋白,同时诱发炎症反应[3]。Tfh细胞是一类位于淋巴滤泡的 CD4+T 细胞亚群,高表达趋化因子受体CXCR5,是淋巴滤泡趋化因子CXCL13 的受体,因此Tfh受CXCL13趋化而被募集到淋巴滤泡,从而刺激 B 细胞增殖、分化,并最终形成生发中心(GC)。Tfh细胞不但对于 GC 的形成和维持至关重要,而且还能够维持、辅助B 细胞成熟、增殖,促使免疫球蛋白发生类别转换[4,5]。已知CXCR5是Tfh细胞表面高表达标志性分子,CD4+CXCR5+Tfh可代表Tfh细胞水平[6]。目前Tfh细胞是否参与了RA关节破坏尚未见相关报道,同时Tfh是否参与了RA疾病活动也尚无定论[7-9]。本文将研究RA患者外周血CD4+CXCR5+Tfh细胞水平与实验室指标及临床症状的关系,并将首次根据关节骨侵蚀情况对RA进行分组,以探讨CD4+CXCR5+Tfh细胞在RA发病及病情进展的作用,及其与RA骨破坏的关系。
1 资料与方法
1.1研究对象
本研究收集了2017年1月至2017年5月于吉林大学中日联谊医院风湿免疫科确诊为RA并住院治疗的30例患者的病例记录及相关临床资料,年龄22-68岁,其中男性5例,女性25例,病程1个月-33年。所有患者均符合1987年美国风湿病学会的RA分类标准[10],排除感染、近期有手术外伤史者及处于妊娠、分娩或哺乳期的女性患者,或同时患有其他自身免疫性疾病及并发其他疾病者。同时选取本院同期体检中心30名年龄和性别匹配的健康志愿者作为健康对照组(HC),年龄22-65岁,平均(49.7±4.98)岁,其中男性5例,女性25例。
1.2方法
1.2.1Tfh细胞的流式检测 用淋巴细胞分离液分离出外周血单个核细胞( peripheral blood mononuclear cells,PBMC),再以磷酸盐缓冲液(PBS)洗涤3次后,将细胞浓度维持在5×105个/mL左右,每管约500 μL。向流式管中加入抗体CD4,均为5 μL,CXCR5均为1.5 μL混匀。室温孵育30 min,洗涤重悬细胞,使用BDFACSAria流式细胞仪( BD 公司,美国) 对处理好的标本进行检测,每份标本至少获取10000个细胞进行分析。用Flow Jo 7. 6 软件(San Diego 公司,美国) 对获得的数据进行分析。
1.2.2实验室检查 所有受试者采集空腹外周血,类风湿因子(RF)和C反应蛋白(CRP)采用乳胶增强免疫比浊法测定,红细胞沉降率(ESR)采用魏氏法测定,抗环瓜氨酸多肽抗体(CCP)采用酶联免疫吸附剂测定法(ELISA)测定,血清免疫球蛋白水平(IgA,IgG,IgM)、血清补体水平(C3,C4)采用速率散射免疫比浊法测定。
1.2.3临床数据的收集 通过病历回顾获得RA患者姓名、性别、年龄、身高、体重、关节X线平片、关节彩超、肿 胀 关 节 数 ( number of swollen joints,SJC) 、压痛关节数( number of tender joints,TJC)、患者健康评估问卷(HAQ)以及用药情况。根据上述临床数据,计算28个关节的疾病活动评分[the disease activity score in 28 joints,ESR-based,DAS28 (ESR)][11];根据DAS28(ESR)将RA患者分为2组,即DAS28(ESR)>3.2为高中疾病活动度组(19例),DAS28(ESR)≤3.2为低疾病活动或缓解组(11例)。根据RA患者关节X线平片,评估关节破坏情况;分为关节骨侵蚀组(15例)与无关节骨侵蚀组(15例)。
1.3统计学处理
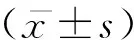
2 结果
2.1RA患者和HC组外周血Tfh细胞水平的比较
采用流式细胞术检测RA患者和HC外周血CD4+CXCR5+Tfh细胞水平结果显示,RA患者外周血CD4+CXCR5+Tfh细胞占CD4+细胞的百分比7.70%(6.10%,9.70%),明显高于HC组5.85%(5.07%,7.35%),差异具有统计学意义(P<0.05)(见表1)。

表1 RA患者和HC组外周血Tfh细胞水平的比较
2.2RA疾病活动性与Tfh细胞水平的关系
按照DAS28评分将RA患者分为高中疾病活动组和低疾病活动及缓解组,结果显示高中疾病活动组CD4+CXCR5+Tfh细胞占CD4+细胞的百分比(9.64%±3.80%),明显高于健康对照组5.85%(5.07%,7.35%)(P=0.002);高中疾病活动组CD4+CXCR5+Tfh细胞占CD4+细胞百分比(9.64%±3.80%),明显高于低疾病活动及缓解期组(6.85%±2.06%)(P=0.014) ;低疾病活动及缓解期组Tfh细胞水平与健康对照组差异无统计学意义(P=0.792)(见图1)。
2.3RA患者关节骨侵蚀与Tfh细胞水平的关系
本研究按照是否存在关节骨侵蚀对RA患者进行分组研究,结果显示有无关节骨侵蚀的RA患者组间及与健康对照组比较,CD4+CXCR5+Tfh细胞水平均无统计学差异(P>0.05)(见图2)。相关性分析结果显示,无关节骨侵蚀组中,CD4+CXCR5+Tfh细胞水平与血沉,HAQ,肿胀关节数,晨僵时间呈明显正相关(P<0.05)(见表2)。在关节骨侵蚀组中,CD4+CXCR5+Tfh细胞水平与临床及实验室指标均无明显相关性(P>0.05)(见表3)。


表2 无关节骨侵蚀RA患者外周血Tfh细胞水平与临床及实验室指标的相关性分析
注:“*”表示P<0.05

表3 关节骨侵蚀RA患者外周血Tfh细胞水平与临床及实验室指标的相关性分析
3 讨论
RA是一种发病机制尚不清楚的慢性自身免疫性疾病,普遍认为其发病可能与多种免疫细胞如抗原特异的T、B 淋巴细胞、抗原提呈细胞及自身抗体等相互作用有关[3]。Tfh细胞是近年来发现的一种CD4+T细胞亚群,其主要位于次级淋巴器官的生发中心中,高表达标志性分子CXCR5,对抗原特异性B细胞在GC中的增生和分化起主要的辅助功能[12,13]。研究表明Tfh细胞参与多种自身免疫性疾病的发病,如系统性红斑狼疮(SLE)、重症肌无力(MG)、骨髓增生异常综合征(MDS)[13]。近年来的研究报道[14,15]认为Tfh细胞可能在RA的发生和发展中也发挥一定作用,例如Tfh细胞可引起B淋巴细胞在生发中心增殖进而产生大量的抗CCP抗体等免疫球蛋白。本研究检测了RA患者外周血CD4+CXCR5+Tfh细胞水平,结果显示,RA患者Tfh细胞水平明显高于健康对照组,这一结果与安乐美[7]等人在RA领域的研究结果相似。上述结果表明Tfh细胞在RA患者中的表达失调,提示其可能参与了RA的发病机制。但Costantino AB[9]等人的研究发现,RA患者与健康对照组的Tfh细胞水平不存在差异,可能与患者样本量少,纳入RA患者存在个体差异等因素有关。
本研究进一步比较疾病活动情况不同RA患者与健康对照组Tfh细胞水平的差异,发现高中疾病活动组CD4+CXCR5+Tfh细胞水平显著高于低疾病活动及缓解组和健康对照组,而低疾病活动及缓解组与健康对照组无差异。这一结果与Zhang Y[16]等人在RA领域的研究结果相似,提示Tfh细胞主要在疾病高度活动时参与免疫反应。这可能与CXCR5/CXCL13信号传导通路相关[17]。大量的研究表明,白细胞介素-6、肿瘤坏死因子-α等炎性因子可调控血清CXCL13参与炎性反应[18,19]。 Nayak LM等人的研究表明,剔除TNF-α基因或其受体TNFRp55基因的小鼠体内CXCL13的表达出现了下降,说明TNF-α与其受体的结合对CXCL13的表达有上调的作用[17]。此外,张铭明[20]等人的研究发现,RA患者血清 CXCL13水平与细胞因子TNF-α、IL-6正相关。随着RA病情进展、病理改变恶化,巨噬细胞、成纤维细胞等多种炎症细胞释放增多,产生大量炎性因子,致使CXCL13水平升高[21],因此Tfh细胞受 CXCL13 趋化而被募集到淋巴滤泡,促进Tfh细胞向B淋巴细胞和生发中心迁移,Tfh细胞可引起B淋巴细胞在生发中心增殖进而产生大量的抗CCP抗体等免疫球蛋白,促进RA的发生和发展。安乐美[22]等人的研究发现RA患者血清CXCL13水平明显升高,且增高幅度与疾病活动度相关。结合本研究结果,RA活动期患者体内Tfh细胞水平升高,可能与患者体内活跃的免疫状态相关。因此,RA患者外周血Tfh细胞水平很可能成为评估RA患者疾病严重程度的参考指标之一。
大量的研究已证明[23]抗CCP抗体水平与RA骨侵蚀程度相关,因此本研究进一步根据关节骨侵蚀情况对RA患者进行分组,探讨Tfh细胞是否参与了RA的关节破坏情况。发现虽然关节骨侵蚀组患者Tfh细胞水平与无关节骨侵蚀组无明显差异,但是在无关节骨侵蚀组中,RA患者CD4+CXCR5+Tfh细胞水平与血沉、肿胀关节数、HAQ、晨僵时间等反应疾病活动性的指标正相关,而在关节骨侵蚀组中未发现此相关性。这可能与关节骨侵蚀发生过程中炎症细胞释放增多,产生更多的CXCL13相关[22]。提示CD4+CXCR5+Tfh细胞可能在RA疾病早期尚未发生关节骨破坏时发挥重要作用,促进了关节骨侵蚀的发生。
综上所述,本研究发现RA患者中外周血Tfh细胞水平显著升高,且Tfh细胞主要在疾病高度活动时参与免疫反应。此外,本研究发现外周血CD4+CXCR5+Tfh细胞可能在RA疾病早期尚未发生关节骨破坏时发挥重要作用。这些研究结果表明Tfh细胞可能通过多种途径参与了RA的发生和发展,可能在RA疾病早期,即尚未发生关节骨侵蚀阶段的病情进展中发挥了重要作用,及时阻断该炎症因子,有可能阻止RA骨破坏的发生。

