腐殖酸作用下酸性多孔介质中纳米TiO2的迁移与滞留机制
张瑞昌,章海波,涂 晨,骆永明
腐殖酸作用下酸性多孔介质中纳米TiO2的迁移与滞留机制
张瑞昌1,3,章海波2,涂 晨2,骆永明3*
(1.河南科技大学化工与制药学院,河南 洛阳 471023;2.中国科学院烟台海岸带研究所,中国科学院海岸带环境过程与生态修复重点实验室,山东 烟台 264003;3.中国科学院南京土壤研究所,中国科学院土壤环境与污染修复重点实验室,江苏 南京 210008)
探讨了富里酸(FA)和胡敏酸(HA)存在条件下饱和石英砂填充柱中纳米二氧化钛(nTiO2)的迁移和滞留机制.结果表明,pH 4.0条件下,不存在FA和HA时,nTiO2不发生迁移;FA和HA吸附到nTiO2表面,改变nTiO2电动性质,促进其在饱和多孔介质柱中迁移.随着FA和HA浓度由1mg/L升高至10mg/L,nTiO2的流出率(填充柱流出液与进液中nTiO2总量的比值)分别由0.01和0.88升高至0.91和0.94;相同条件下,HA在nTiO2表面的吸附量比FA大,对nTiO2迁移性的促进作用也更大.离子抑制nTiO2的迁移,且CaCl2影响大于NaCl.相同NaCl浓度,与FA相比,HA作用下nTiO2的迁移性更强,并且7%~56%的nTiO2沉降在第二极小势能区,高于FA作用下的4%~17%,更易被重新释放.nTiO2与石英砂之间的高势垒促进nTiO2的迁移,而低势垒、第二最小势能、阻塞作用、扩散和重力沉降是nTiO2滞留的主要原因.
纳米TiO2;富里酸;胡敏酸;稳定性;迁移性
环境中纳米二氧化钛(nTiO2)的暴露途径和生物可利用性很大程度上受到其稳定性及迁移性的影响.pH是影响nTiO2表面电动性质及其在介质中迁移性的重要因素.nTiO2的零电势点通常为4.4~6.2[1-3],当pH低于零电势点时,未包被的nTiO2会在带负电的介质中大量滞留[4-5].通常,土壤和水环境的pH为5.0~9.0.然而,在广阔的亚热带以及热带地区,一些环境介质常处于酸性条件[6].尽管已有大量关于nTiO2稳定性与迁移性的研究,但是系统研究酸性条件下多孔介质中nTiO2迁移行为的报道很少,且结果存在较大差异.Fang等发现,pH 2.6时nTiO2与介质颗粒的静电引力导致nTiO2在饱和以及非饱和多孔介质柱中完全滞留[7].相反,Chowdhury等研究表明,pH 5.0时,大量的nTiO2可以从多孔介质柱中迁移出[4].
天然有机质(NOM)广泛存在于水土环境中,是影响纳米颗粒环境行为的另一个重要因素[8].NOM可以吸附到nTiO2表面,改变nTiO2理化特性,进而影响nTiO2在环境中的稳定性和迁移性[1-3].其中,腐殖酸是环境中常见的带负电的聚合电解质,如富里酸(FA)、胡敏酸(HA),结构中存在大量的羧基(-COOH, -COO-)及羟基(-OH)官能团,可能会改变酸性条件下带正电的nTiO2的表面电性[1,9],从而改变nTiO2与介质之间的静电引力,促进nTiO2在介质中的迁移性,提高nTiO2在酸性条件下的环境风险.
本研究主要考察酸性条件下两种常见腐殖酸(FA和HA)对nTiO2在饱和石英砂填充柱中稳定性与迁移性的影响及机制,以期为酸性环境中nTiO2环境行为以及风险的评价提供一定的理论依据.
1 材料与方法
1.1 材料
nTiO2购自上海阿拉丁试剂,基本性质参见文献[9]:颗粒近似呈球形,粒径约30nm,晶体类型为锐钛矿,比表面积为80.8m2/g,零电势点为pH 6.2.FA购自Fluka试剂,使用时用去离子水配成质量浓度1g/L的溶液;HA购自Sigma-Aldrich试剂,使用时用去离子水配成质量浓度1g/L的溶液,用1mol/L NaOH调节pH至10.0.石英砂(40~70目)购自国药集团化学试剂,参照Litton和Olson的方法去除表面杂质[10].
1.2 nTiO2的稳定性试验
准确称取250mg nTiO2分散于1L去离子水中,超声分散4min (JY92-IIDN超声细胞粉碎机,宁波新芝,下同),制成250mg/L nTiO2母液,置于4℃保存,48小时内使用.向nTiO2母液中加入不同量的FA、HA、NaCl或CaCl2溶液,用去离子水稀释成50mg/L的nTiO2悬液,0.1mol/L HCl调节pH,超声分散4min,制成不同条件下的nTiO2悬液(表1).采用纳米粒度电位仪(Zetasizer nano ZS90,Malvern)测定nTiO2的粒径分布、zeta电位及石英砂的zeta电位.
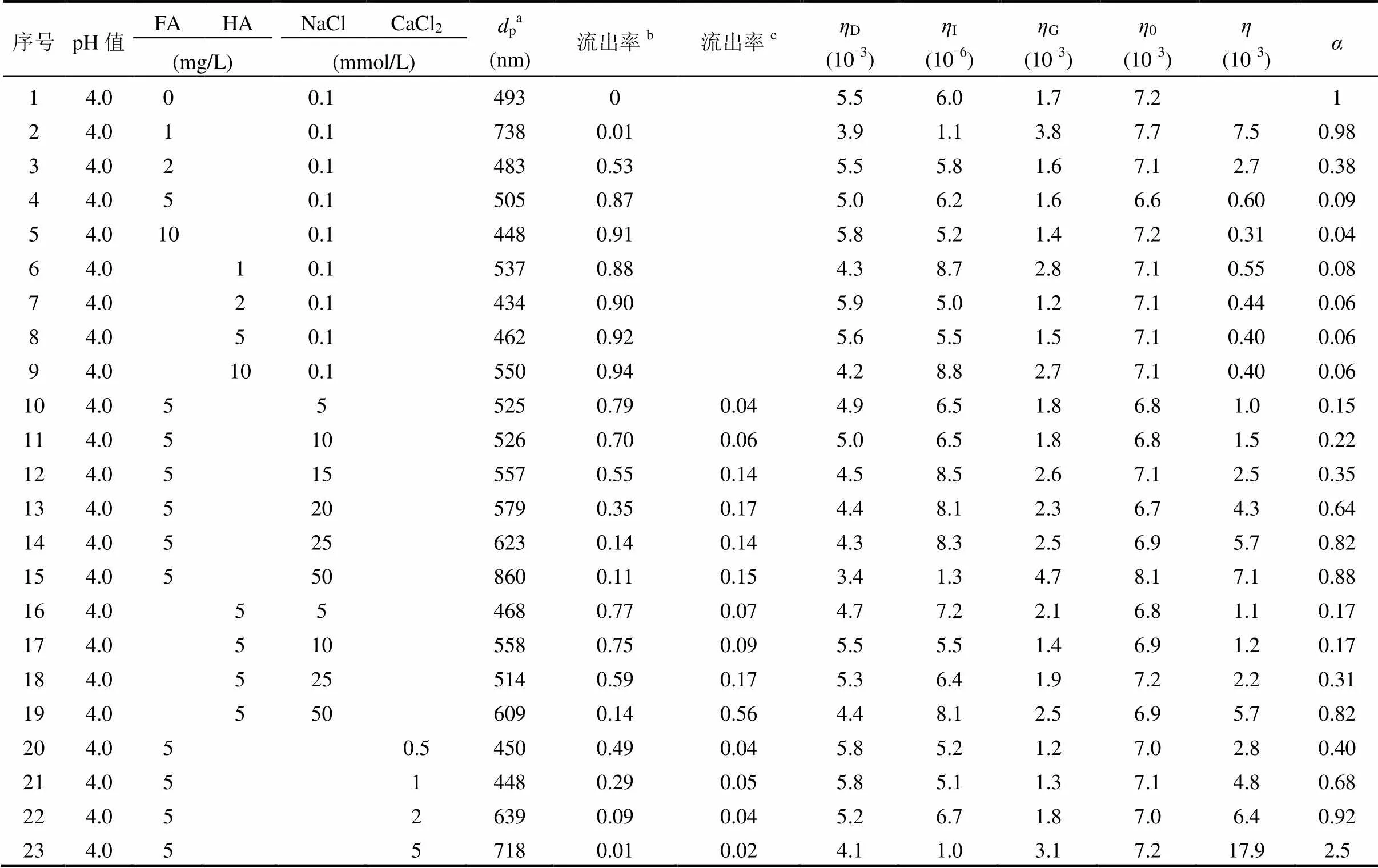
表1 实验设计和部分实验结果
注:a. nTiO2的聚集粒径;b. 计算0~7PV流出率,即0~7PV流出液中nTiO2量与进液中nTiO2总量的比值;c. 计算7~10PV流出率,即7~10PV流出液中nTiO2量与进液中nTiO2总量的比值.
1.3 nTiO2对FA和HA的吸附试验
在与1.2相同条件下测定FA与HA在nTiO2表面的吸附量.将不同条件下的nTiO2悬液置于150rpm回旋式摇床中室温震荡2h.利用多次高速离心方法(9600g, 20min)将nTiO2从悬液中分离[1],上清液过0.22μm滤膜,滤液分别在275nm与300nm比色测定FA与HA浓度,FA与HA标准曲线线性范围在0~100mg/L,相关系数0.999.吸附量通过式(1)计算:
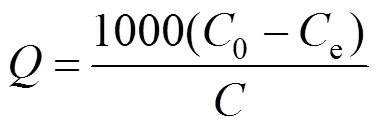
式中:为吸附量(mg/g),0为初始浓度(mg/L),e为平衡浓度(mg/L),为nTiO2浓度(mg/L).
1.4 nTiO2的迁移性试验
选用内径25mm,长100mm的玻璃层析柱,两端分别装有孔径20μm的尼龙网.每次称取一定量的石英砂缓慢倒入层析柱中,小心夯实,重复多次直至装满层析柱.重量法测定填充柱的孔隙体积(PV),孔隙率0.40~0.47.
填柱后具体流程如下:(1)用待测条件(表1)的背景溶液(不含nTiO2)平衡填充柱;(2)蠕动泵(BT100-2J,保定兰格)准确泵入3PV与背景溶液相同条件的nTiO2悬液;(3) 4PV背景溶液冲洗填充柱;(4)上述步骤结束后,再用3PV只含有FA或HA的背景溶液(不含离子及nTiO2)冲洗填充柱(表1中序号10~23).整个过程中,溶液与nTiO2以0.81~0.89cm/min速度自下而上泵入柱体,流出液用自动部分收集器(BS-100A,上海沪西)收集,流出液中nTiO2浓度用紫外分分光光度计(GENESYS 10S UV-Vis,Thermo Fisher)在波长343nm比色法测定,标准曲线线性范围在0~80mg/L,相关系数0.999.每组实验重复两次,两次之间误差<3%,选取其中一组显示实验结果.
1.5 数据分析方法
1.5.1 扩展的DLVO(XDLVO)理论 经典的DLVO理论计算的反应能包括两个表面相互靠近时存在的范德华引力能和双电层静电斥力能之和[11].纳米颗粒-纳米颗粒系统的范德华引力能(vdW-NN)和双电层静电斥力能(EDL-NN)、纳米颗粒-石英砂系统的范德华引力能(vdW-NS)和双电层静电斥力能(EDL-NS)的计算参见文献[11].
对于表面吸附腐殖酸的纳米颗粒,应该考虑另外两种空间排斥反应的作用:渗透压和螺旋压缩[12].渗透压是由于相互靠近的颗粒造成的重合区域中聚合物浓度的增加所致,渗透斥能(osm)计算参见文献[12-13];表面吸附的腐殖酸层的压缩(<)会引起熵的损失,导致弹性斥力能(elas)的产生,其计算参见文献[14].
综上,纳米颗粒-纳米颗粒系统以及纳米颗粒-石英砂系统的总的反应能为(V):
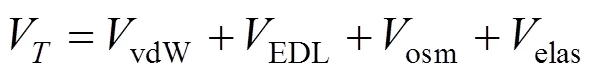
1.5.2 胶体过滤理论 胶体过滤理论中,悬浮于孔隙流体中的颗粒主要通过3种机理与多孔介质表面接触:扩散、截取与重力沉降.无量纲的接触效率0可以表达为[15]:
式中:D、I和G分别为扩散效率、截取效率和重力沉降效率.在大多数实际水体环境下,由于颗粒与收集器之间可能存在斥力,单相收集器去除效率低于接触效率0.实际的单相收集器去除效率常表示为:
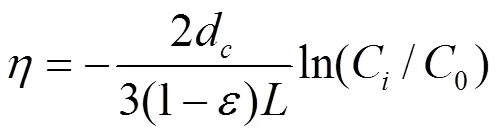
式中:为柱长,0和C分别为进液和出液中nTiO2的浓度.
吸附效率表示最终导致吸附的颗粒与收集器之间的碰撞的比率,也就是实验单相收集器去除效率与预测单相收集器接触效率0之比:
各参数的具体计算参见文献[9].
2 结果与讨论
2.1 nTiO2对FA和HA的吸附
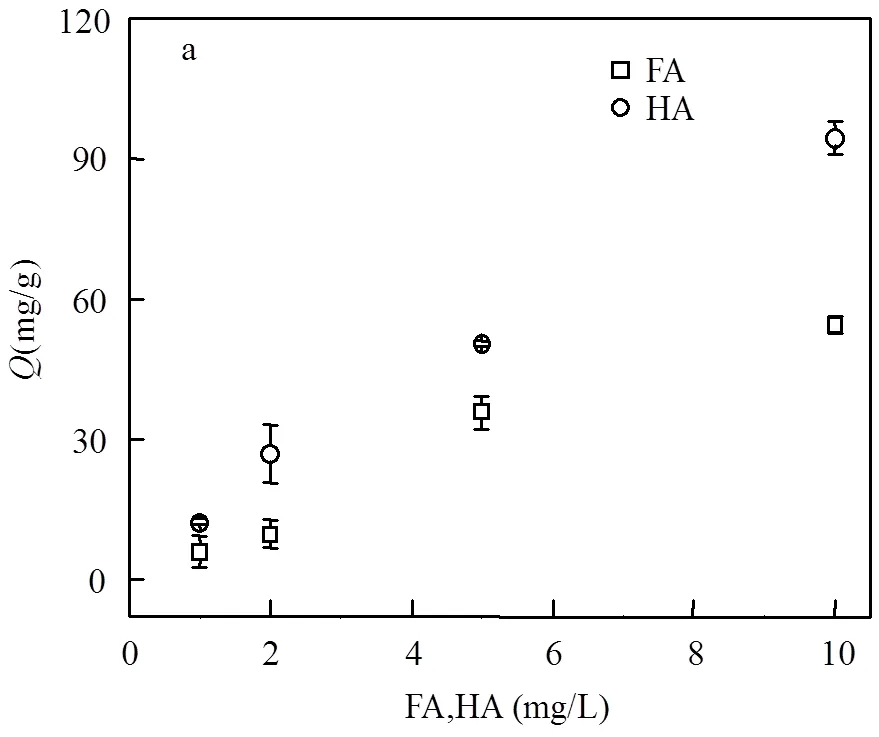
由图1可见nTiO2对FA的吸附量随着溶液中初始FA浓度的升高而增加,pH 4.0时,吸附量从1mg/L FA时的5.93mg/g增加至10mg/L时的54.3mg/g (图1a).nTiO2的零电势点为6.2,而FA在pH 2~8下zeta电位均为负值.因此,可以推断静电吸引力在吸附中起到重要作用.此外,nTiO2表面的羟基与FA的酚羟基及羧基的配体交换也是重要的吸附机理[1,8].与FA相比,HA在nTiO2表面的吸附量更大.NOM在纳米颗粒表面的亲和度与分子量与芳环度有关,分子量更大、芳环度更高的有机质更易吸附在颗粒表面[16].通常,HA比FA具有更大的分子量,另外,根据核磁共振1H谱,FA分子中芳香烃氢含量为10.3%,小于HA分子中含量28.1%.由图1b可见, pH 4.0时,NaCl与CaCl2浓度对吸附量均无明显影响,相同离子强度下HA在nTiO2表面的吸附量比FA更大.
2.2 FA和HA作用下nTiO2的电动性质和聚集特性
吸附在nTiO2表面的腐殖酸将会影响纳米颗粒的电动性质,以及纳米颗粒之间的相互作用,从而影响纳米颗粒在悬液中的稳定性.纳米颗粒稳定性是影响其迁移与沉降行为的关键因素.各条件下nTiO2的zeta电位如图2所示.由图2a可知,pH 4.0,不存在FA时,nTiO2的zeta电位为+33.0mV,存在1mg/L FA时,zeta电位降为+15.9mV;FA浓度2mg/L时,zeta电位由正值变为负值,为-13.3mV;当FA浓度10mg/L时,nTiO2的zeta电位降为-34.7mV.HA对nTiO2与石英砂zeta电位的影响与FA相似(图2b).不同的是,pH 4.0时,由于HA在nTiO2表面吸附量更大,使得nTiO2的zeta电位由正变负的HA浓度约为0.8mg/L,小于FA的浓度1.5mg/L;低浓度下(<2mg/L), HA存在时nTiO2的zeta电位小于FA存在时的电位(绝对值更大).腐殖酸影响nTiO2的zeta电位的机理主要归结为以下3个方面:(1)吸附在nTiO2表面的腐殖酸分子中的负电基团中和颗粒表面的正电荷,使zeta电位降低;(2) nTiO2表面的羟基基团与腐殖酸的配位交换减少了颗粒表面可质子化的羟基量,可能降低nTiO2表面的正电荷量[8,17];(3)腐殖酸的有机阴离子可以增加毗邻颗粒表面的负电荷密度,导致切动面位置远离颗粒表面,这也会降低nTiO2的zeta电位[8,18].
由图2c可见,5mg/L FA、pH 4.0时nTiO2的zeta电位随着溶液中NaCl浓度的升高而升高(绝对值降低),由5mmol/L NaCl时的-33.6mV升高至50mmol/L NaCl时的-22.5mV,电荷屏蔽效应以及压缩双电层效应是NaCl引起zeta电位变化的主要原因[1,19].相同pH和NaCl浓度时,与FA相比,HA存在条件下nTiO2的zeta电位绝对值更大(图2d).除了电荷屏蔽效应与压缩双电层效应,Ca2+对nTiO2表面吸附的FA分子中某些集团的桥联作用也会降低颗粒表面的负电荷量(zeta电位升高)[20-21].因此,相同浓度下CaCl2对zeta电位的影响要远大于NaCl(图2e).
与文献报道相同[1,20],带负电荷的石英砂与腐殖酸之间存在较强的静电斥力,腐殖酸在石英砂表面的吸附量可以忽略不计.因此,溶液中腐殖酸对石英砂zeta电位无显著影响(图3ab).而NaCl与CaCl2的存在降低了石英砂zeta电位的绝对值(zeta电位升高),且CaCl2的作用更强(图3def).
如表1所示,各试验条件下nTiO2均聚集成粒径大于400nm的聚集体.商品金属氧化物纳米颗粒通常以粉末的形式销售,在水中配成悬液后不是以原始纳米颗粒的状态存在,而是发生聚集生成较大聚集体[22].计算各条件下nTiO2颗粒之间的XDLVO反应能势垒在2.4~40.4kT.通常认为,势垒大于20kT时可以防止颗粒因碰撞而发生聚集[23].Zhang等研究发现,商品nTiO2分散在超纯水中后形成平粒径为1430nm的较大聚集体,超声10min后可以将大聚集体破坏生成平均粒径521nm的聚集体,但是延长超声时间或者加入Na3PO4、十二烷基磺酸钠或丙酮等分散剂不能继续分散聚集体减小聚集粒径[22].因此,本试验中较高的势垒(>20KT)也不能分散生成的聚集体,但是低势垒导致聚集体进一步聚集.例如,pH 4.0、1mg/L FA条件下,XDLVO反应能势垒仅为3.1kT,nTiO2进一步聚集生成平均粒径为948nm的更大聚集体.
pH 4.0,不存在FA时带正电的nTiO2颗粒之间存在14.8kT的势垒,聚集颗粒粒径为493nm;FA浓度为1mg/L时,纳米颗粒表面正电荷量减少,势垒降低为3.1kT,纳米颗粒聚集粒径增加至738nm;FA浓度5mg/L时,颗粒之间势垒增加至16.6kT,聚集体粒径减小为505nm.随着溶液中离子强度的增加,颗粒之间的势垒降低,nTiO2聚集体粒径增大.与zeta电位相似,CaCl2对nTiO2聚集粒径的影响远大于NaCl. pH 4.0时,虽然HA在nTiO2表面吸附量比FA更大,但是,HA对颗粒聚集体的分散效果与FA无显著差别.
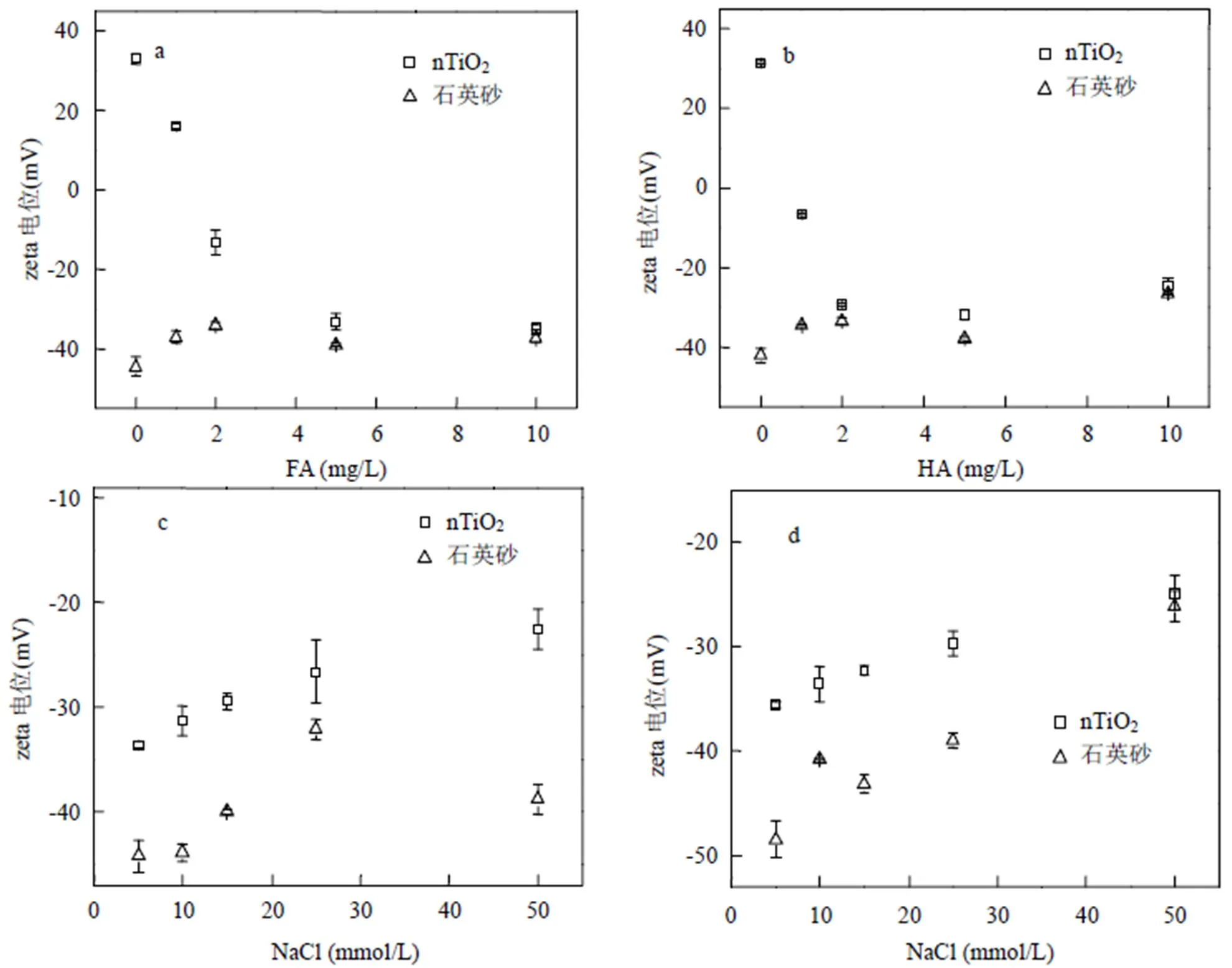
a. pH 4.0时FA浓度的影响 b. pH 4.0时HA浓度的影响 c. pH 4.0、5mg/L FA时NaCl浓度的影响 d. pH 4.0、5mg/L HA时NaCl浓度的影响 e. pH 4.0、5mg/L FA时CaCl2浓度的影响
腐殖酸浓度与类型、离子强度及电解质类型影响了nTiO2的电动性质与聚集状态,势必改变其在石英砂饱和填充柱中的迁移与滞留行为.
2.3 FA和HA作用下nTiO2的迁移性
不同腐殖酸浓度下nTiO2的穿透曲线如图3所示.不存在FA时,由于nTiO2与石英砂表面zeta电位相反,静电吸引力使nTiO2全部滞留在多孔介质柱中.pH 4.0,FA浓度为1mg/L时, nTiO2表面zeta电位仍为正值(图2),nTiO2几乎全部滞留在多孔介质柱中,流出率仅为0.01, XDLVO理论证实了这一现象,此条件下无势垒存在(图4).当FA浓度继续升高时,nTiO2表面zeta电位变为负值,它与石英砂之间的反应能出现>150kT的势垒,表现为排斥,不利于nTiO2向多孔介质沉降[4],nTiO2的流出率升高,由2mg/L FA时的0.53增加至10mg/L时的0.91.1~10mg/L HA时,nTiO2的流出率为88%~94%,高于相同浓度FA作用下nTiO2的流出率.

a. FA pH 4.0; b. HA pH 4.0
选取腐殖酸浓度为5mg/L考察离子对nTiO2迁移性的影响,穿透曲线见图5.当离子强度升高时,纳米颗粒-石英砂之间的反应能势垒降低,并出现第二极小势能区[1,24],纳米颗粒滞留增加,流出率下降.存在5mg/L FA时,当NaCl浓度由5mmol/L升高至50mmol/L时,势垒由479kT下降至187kT,第二极小势能区由-0.37kT增加至-2.9kT(图4c),nTiO2的流出率由0.79下降至0.17(表1).本研究中,0~7PV结束后增加7~10PV不含有离子的背景溶液的冲洗过程,模拟环境中离子浓度降低时滞留在多孔介质中的nTiO2的行为.大量研究发现,当孔隙水离子强度变为零时,由于双电层扩张,第二极小势能区消失,沉降在第二极小势能区与石英砂结合不牢固的纳米颗粒重新释放[24].试验发现,7~10PV的再释放过程可以释放4%~17%(占nTiO2进样总量)的nTiO2.与FA相比,HA具有更大的分子量和更复杂的空间结构,产生的空间稳定作用更大[16],所以在NaCl浓度相同时,HA作用下nTiO2的迁移性更强,沉降在第二极小势能区的颗粒量更多(7%~56%).如果将沉降在第二极小势能区的颗粒看作是具有潜在迁移性的颗粒,那么5mg/L HA存在时,NaCl浓度由5mmol/L增加至50mmol/L,nTiO2的潜在迁移性只是略有下降,流出率(0~10PV)由0.87下降至0.78,说明NaCl对nTiO2潜在迁移性影响不大.相比之下,5mg/L FA存在时,NaCl浓度由5mmol/L增加至50mmol/L,nTiO2的潜在迁移性大大降低,流出率(0~10PV)由0.83下降至0.25,说明NaCl显著降低了nTiO2的潜在迁移性.
CaCl2对迁移的影响远大于NaCl.CaCl2浓度由0.5mmol/L增加至5mmol/L时,颗粒-石英砂之间的势垒由182kT减小至40kT,nTiO2的流出率也由0.54下降至0.02(图5c),远低于相同浓度NaCl作用下nTiO2的迁移性.另外,虽然出现-0.2~ -2.6kT的第二极小势能区,但是7~10PV再释放量仅为2%~5%,说明nTiO2主要沉降在第一势能阱,并且环境中离子强度的降低不会将滞留在介质中的nTiO2再释放.
本研究中,尽管nTiO2-石英砂之间的反应能出现>150kT势垒,仍有大量nTiO2滞留在多孔介质中.例如,pH 4.0、5mg/L FA、25mmol/L NaCl存在条件下势垒为187kT,但是nTiO2流出率仅为0.17.这说明除了颗粒-介质之间的XDLVO反应能之外,还有其他的机理控制着nTiO2的迁移.XDLVO理论仅能预测颗粒之间或者颗粒与石英砂之间的反应,但是无法描述其他的物理过程:包括位阻效应、阻塞效应和过滤熟化[4].

a. pH 4.0时FA浓度的影响 b. pH 4.0时HA浓度的影响 c. pH 4.0、5mg/L FA时NaCl浓度的影响 d. pH 4.0、5mg/L HA时NaCl浓度的影响 e. pH 4.0、5mg/L FA时CaCl2浓度的影响
引起位阻效应的原因有:(1)介质表面吸附位点的减少引起的纳米颗粒沉降速率持续下降[25];(2)滞留在介质中的颗粒发生解吸而重新释放[26].位阻效应表现为随着孔隙体积的增加,流出率逐渐升高(图3、5).第一个原因主要发生在颗粒-介质之间存在吸引能,而颗粒之间存在排斥能时[4,25].本研究条件下,颗粒与介质之间的吸引和颗粒之间的排斥不能同时发生,并且穿透曲线出现拖尾现象,因此,滞留颗粒的重新释放是引起位阻效应的主要原因.阻塞是在水流方向上孔隙过小颗粒不能通过而被拦截的现象.通常认为,当胶体直径与多孔介质直径平均值之比大于0.0017时,阻塞是一个非常重要的胶体滞留机理[1,27].本研究中石英砂平均直径为350μm,所以阻塞发生的nTiO2聚集粒径的阈值为595nm.
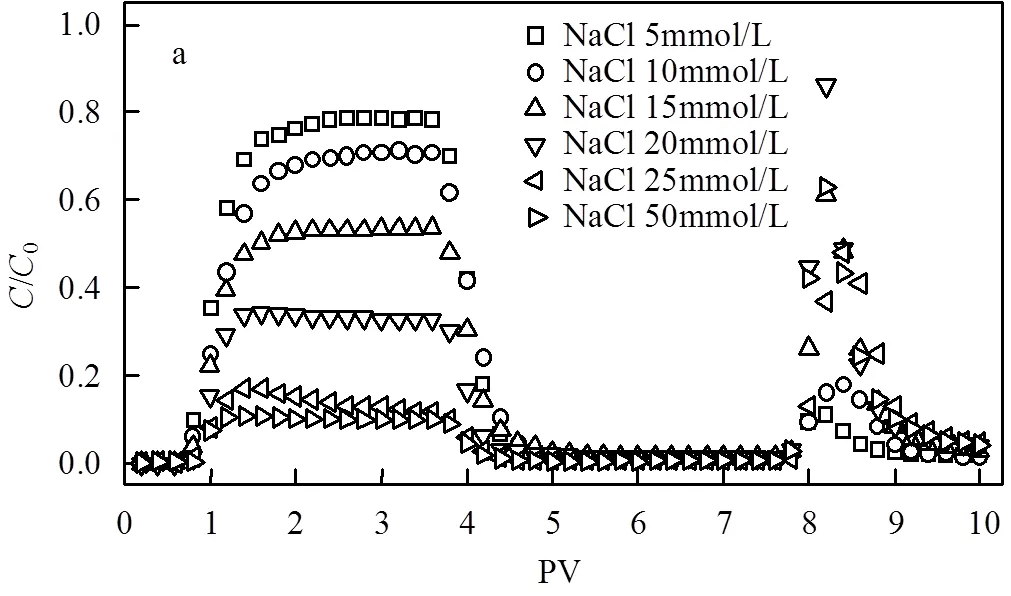
a. FA, NaCl; b. HA, NaCl; c. FA CaCl2
由表1可以看出,大部分条件下nTiO2聚集体粒径超过595nm.即使平均聚集粒径小于阈值,由于聚集粒径分布较宽,部分聚集体的粒径也已经超过阈值.如pH 4.0、5mg/L FA条件下,32.3%的nTiO2聚集体粒径大于595nm(图6).所以,本研究中阻塞作用是nTiO2在石英砂柱中滞留的一个重要机理.另外,序号19(pH 4.0、5mg/L FA、25mmol/L NaCl)与27(pH 4.0、5mg/L FA、2mmol/L CaCl2)组试验均出现过滤熟化现象,即随着孔隙体积增加,流出率呈现不断下降趋势.引起这种现象的原因有两种:(1) nTiO2团聚体粒径较大,堵塞多孔介质孔隙,造成更多颗粒被截留;(2)当纳米颗粒之间的总势能小于纳米颗粒-石英砂之间势能时,已经沉降在石英砂表面的颗粒将作为新的载体,这部分沉降的颗粒比石英砂更容易截留悬液中的纳米颗粒,因此流出率减小[1,28].
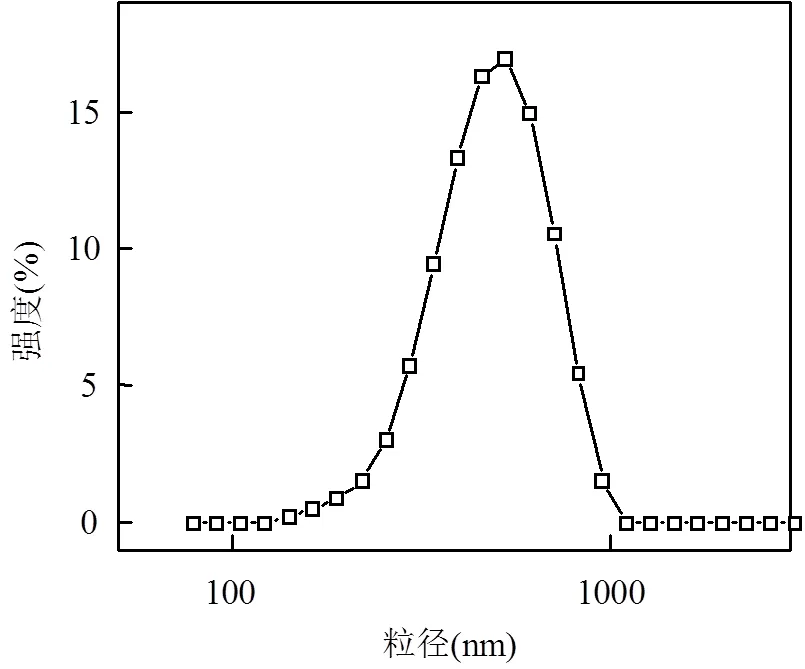
图6 pH 4.0、5mg/L FA、0.1mmol/L NaCl条件下nTiO2的粒径分布
胶体过滤理论常用于解释多孔介质中胶体颗粒的滞留机理[15,29].根据试验条件计算的D、I、G、0和等参数见表1.<1表明有一定量的nTiO2从柱中迁移出.总体上,随pH与腐殖酸浓度升高而升高,随NaCl与CaCl2浓度降低而降低,与试验中nTiO2的流出率相一致.各试验条件下,D占的42%~83%.D随着悬液中nTiO2的聚集粒径减小而增大,如nTiO2聚集粒径为860nm时,D值为3.4× 10-2,当nTiO2粒径减小至434nm时,D增大至5.9× 10-2.研究发现,扩散是粒径小于100nm的颗粒在多孔介质中最主要的沉降机理[29-30].由于本试验中nTiO2的聚集粒径较大,重力沉降同样起到很重要的作用,G占的17%~58%.D相反,G随聚集粒径增加而增大.例如,悬液中CaCl2浓度由0.5mmol/L (nTiO2聚集粒径450nm)增加至5mmol/L(nTiO2聚集粒径718nm)时,G增加了2.6倍.各环境条件下,D占的比例小于0.2%,可以忽略不计.对于多孔介质中聚集粒径较小的nTiO2,扩散是主要的沉降机理,而对于聚集粒径较大的颗粒,重力沉降是主要的沉降机理.
3 结论
3.1 酸性条件下,不存在腐殖酸时,由于与石英砂的静电吸引作用,nTiO2不发生迁移;FA和HA可以吸附到nTiO2表面,改变nTiO2电动性质和聚集特性,促进其在饱和多孔介质柱中迁移;且相同条件下,HA在nTiO2表面的吸附量比FA大,对nTiO2迁移性的促进作用也更大.
3.2 离子强度的升高抑制nTiO2的迁移,且CaCl2的作用大于NaCl.在相同NaCl浓度条件下,与FA相比,HA作用下nTiO2的迁移性更强,沉降在第二极小势能区的nTiO2更多,更易被重新释放.
3.3 XDLVO理论、阻塞作用与胶体过滤理论很好地解释了nTiO2在多孔介质填充柱中的迁移与滞留行为.nTiO2与石英砂之间的高势垒促进nTiO2的迁移,而低势垒、第二最小势能、阻塞作用、扩散和重力作用带来的沉降是nTiO2滞留的主要原因.
[1] Chen G X, Liu X Y, Su C M.nct effects of humic acid on transport and retention of TiO2rutile nanoparticles in saturated sand columns [J]. Environmental Science & Technology, 2012,46(13): 7142-7150.
[2] Loosli F, Le Coustumer P, Stoll S. TiO2nanoparticles aggregation and disaggregation in presence of alginate and Suwannee River humic acids. pH and concentration effects on nanoparticle stability [J]. Water Research, 2013,47(16):6052-6063.
[3] Petosa A R, Brennan S J, Rajput F, et al. Transport of two metal oxide nanoparticles in saturated granular porous media: role of water chemistry and particle coating [J]. Water Research, 2012,46(4):1273- 1285.
[4] Chowdhury I, Hong Y, Honda R J, et al. Mechanisms of TiO2nanoparticle transport in porous media: role of solution chemistry, nanoparticle concentration, and flowrate [J]. Journal of Colloid and Interface Science, 2011,360(2):548-555.
[5] Godinez I G, Darnault C J G. Aggregation and transport of nano-TiO2in saturated porous media: effects of pH, surfactants and flow velocity [J]. Water Research, 2011,45(2):839-851.
[6] 陈怀满.环境土壤学 [M]. 北京:科学出版社, 2005.
[7] Fang J, Xu M J, Wang D J, et al. Modeling the transport of TiO2nanoparticle aggregates in saturated and unsaturated granular media: effects of ionic strength and pH [J]. Water Research, 2013,47(3):1399- 1408.
[8] Yang K, Lin D H, Xing B S. Interactions of humic acid with nanosized inorganic oxides [J]. Langmuir, 2009,25(6):3571-3576.
[9] Zhang R C, Zhang H B, Tu C, et al. Facilitated transport of titanium dioxide nanoparticles by humic substances in saturated porous media under acidic conditions [J]. Journal of Nanoparticle Research, 2015,17:165.
[10] Litton G M, Olson T M. Colloid deposition rates on silica bed media and artifacts related to collector surface preparation methods [J]. Environmental Science & Technology, 1993,27(1):185-193.
[11] Tufenkji N, Elimelech M. Deviation from the classical colloid filtration theory in the presence of repulsive DLVO interactions [J]. Langmuir, 2004,20(25):10818-10828.
[12] El Badawy A M, Hassan A A, Scheckel K G, et al. Key factors controlling the transport of silver nanoparticles in porous media [J]. Environmental Science & Technology, 2013,47(9):4039-4045.
[13] Wang D J, Su C M, Liu C X, et al. Transport of fluorescently labeled hydroxyapatite nanoparticles in saturated granular media at environmentally relevant concentrations of surfactants [J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects, 2014, 457(5):58-66.
[14] Fritz G, Schadler V, Willenbacher N, et al. Electrosteric stabilization of colloidal dispersions [J]. Langmuir, 2002,18(16):6381-6390.
[15] Tufenkji N, Elimelech M. Correlation equation for predicting single-collector efficiency in physicochemical filtration in saturated porous media [J]. Environmental Science & Technology, 2004,38(2): 529-536.
[16] Louie S M, Tilton R D, Lowry G V. Effects of molecular weight distribution and chemical properties of natural organic matter on gold nanoparticle aggregation [J]. Environmental Science & Technology, 2013,47(9):4245-4254.
[17] Bian S W, Mudunkotuwa I A, Rupasinghe T, et al. Aggregation and dissolution of 4nm ZnO nanoparticles in aqueous environments: influence of pH, ionic strength, size, and adsorption of humic acid [J]. Langmuir, 2011,27(10):6059-6068.
[18] Zhang Y, Chen Y S, Westerhoff P, et al. Impact of natural organic matter and divalent cations on the stability of aqueous nanoparticles [J]. Water Research, 2009,43(17):4249-4257.
[19] 方 华,方若雨,于江华,等.典型碳纳米材料在水中的凝聚特性比较[J]. 中国环境科学, 2016,36(5):1476-1481.
[20] Amirbahman A, Olson T M. Deposition kinetics of humic matter- coated hematite in porous-media in the presence of Ca2+[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1995, 99(1):1-10.
[21] 方 华,孙宇心,于江华,等.腐殖酸对水中多壁碳纳米管凝聚特性的影响[J]. 中国环境科学, 2015,35(5):1410-1415.
[22] Zhang Y, Chen Y S, Westerhoff P, et al. Stability of commercial metal oxide nanoparticles in water [J]. Water Research, 2008,42(8/9):2204- 2212.
[23] Cosgrove T. Colloid science: Principles, methods and applications [M]. UK: John Wiley & Sons, 2010.
[24] Zhou D M, Wang D J, Cang L, et al. Transport and re-entrainment of soil colloids in saturated packed column: effects of pH and ionic strength [J]. Journal of Soils and Sediments, 2011,11(3):491-503.
[25] Song L, Elimelech M. Dynamics of colloid deposition in porous-media: modeling the role of retained particles [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1993,73: 49-63.
[26] Torkzaban S, Tazehkand S S, Walker S L, et al. Transport and fate of bacteria in porous media: coupled effects of chemical conditions and pore space geometry [J]. Water Resources Research, 2008,44(4): W04403.
[27] Bradford S A, Yates S R, Bettahar M, et al. Physical factors affecting the transport and fate of colloids in saturated porous media [J]. Water Resources Research, 2002,38(12):63-1-61-12.
[28] Chen G X, Liu X Y, Su C M. Transport and retention of TiO2rutile nanoparticles in saturated porous media under low-ionic-strength conditions: measurements and mechanisms [J]. Langmuir, 2011, 27(9):5393-5402.
[29] Rahman T, George J, Shipley H J. Transport of aluminum oxide nanoparticles in saturated sand: effects of ionic strength, flow rate, and nanoparticle concentration [J]. Science of the Total Environment, 2013,463-464(1):565-571.
[30] Zhuang J, Qi J, Jin Y. Retention and transport of amphiphilic colloids under unsaturated flow conditions: effect of particle size and surface property [J]. Environmental Science & Technology, 2005,39(20): 7853-7859.
Mechanisms of mobility and retention of nano-TiO2in acidic porous media in the presence of humus acids.
ZHANG Rui-chang1,3, ZHANG Hai-bo2, TU Chen2, LUO Yong-ming3*
(1.Chemical Engineering and Pharmaceutics School, Henan University of Science and Technology, Luoyang 471023, China;2.Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China;3.Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Sciences, Chinese Academy of Sciences, Nanjing 210008, China)., 2018,38(9):3542~3551
The mechanisms of mobility and retention of titanium dioxide nanoparticles (nTiO2) in well-defined porous media composed of clean quartz sand in the presence of fulvic acid (FA) and humic acid (HA) were studied under acidic conditions. nTiO2were immobile in the porous media in the absence of FA and HA at pH 4.0. FA and HA could be adsorbed onto the surface of nTiO2, change the electrokinetic properties of nTiO2, and facilitate the transport of nTiO2. The elution of nTiO2increased from 0.01 and 0.88 to 0.91 and 0.94 with the increase of FA and HA from 1mg/L to 10mg/L respectively. Compared to FA, more HA was adsorbed onto nTiO2, and thus the facilitated effect of HA on transport of nTiO2was stronger. Ions inhibited the mobility of nTiO2, and the effect of CaCl2was greater than that of NaCl in same concentration. The mobility of nTiO2was better in the presence of HA than FA. In addition, 7%~56% nTiO2was deposited in the secondary energy minimum well in the presence of HA, higher than 4%~17% in the presence of FA, which could be easily released when the environmental conditions changed. High energy barriers between nTiO2and quartz promoted the mobility of nTiO2, while a combination of the secondary minimum energy, straining, diffusion and gravitational deposition were involved in the retention of nTiO2.
titanium dioxide nanoparticles;fulvic acid;humic acid;stability;transport
X523
A
1000-6923(2018)09-3542-10
张瑞昌(1987-),男,山东日照人,讲师,博士,主要从事纳米颗粒的环境行为与效应研究.发表论文10篇.
2018-02-02
国家自然科学基金资助项目(41171248,41601520)
* 责任作者, 研究员, ymluo@issas.ac.cn

