ABR启动期运行效能及互营产甲烷菌群的分布特征
班巧英,刘 琦,张立国,李建政
ABR启动期运行效能及互营产甲烷菌群的分布特征
班巧英1*,刘 琦1,张立国1,李建政2
(1.山西大学环境与资源学院,山西 太原 030006;2.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 150090)
为探讨厌氧折流板反应器(ABR)启动期运行效能和互营产甲烷菌群的空间分布特征,考察了ABR反应器处理制糖废水启动期的运行特征,并采用聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术分析了互营产甲烷菌群在ABR各格室的分布规律.结果表明,在污泥驯化阶段,ABR的COD去除率为61.5%,出水挥发酸总量高达1808mg/L.经过2个阶段的调控运行后,ABR出水挥发酸明显降低,甲烷含量增加至55%以上,COD去除率达到了94.8%.而且ABR第2~4格室形成了沉降性能良好的颗粒污泥.PCR-DGGE检测结果表明,该ABR系统中的主要产氢产乙酸菌为和,主要分布在ABR系统第3,4格室.ABR第1,2格室的产甲烷菌主要为耐酸的氢营养型产甲烷菌(和),而乙酸营养型产甲烷菌(和)主要分布在第3,4格室.ABR系统中产甲烷菌的多样性要明显高于产氢产乙酸菌,说明当系统受到冲击时,产氢产乙酸作用比产甲烷作用更易成为限速步骤.
厌氧折流板反应器;启动运行;产氢产乙酸菌;产甲烷菌;聚合酶链式反应-变性梯度凝胶电泳
厌氧生物处理技术广泛用于处理各种有机废弃物,同时回收甲烷作为清洁能源[1-3].有机物的厌氧生物处理过程主要涉及4类微生物:产酸发酵菌群、产氢产乙酸菌群、同型产乙酸菌群和产甲烷菌群.其中,产氢产乙酸菌群将产酸发酵菌群的代谢产物(如:丙酸、丁酸、乙醇、乳酸等)转化为产甲烷菌可利用的底物(乙酸和H2/CO2).研究表明,产氢产乙酸菌群的活性对甲烷发酵过程具有显著的限制作用,主要是由于这些短链挥发酸和乙醇(乳酸除外)的厌氧降解是一个高度吸能的过程,很难自发进行[4].因此,强化产氢产乙酸菌群的功能,对提高厌氧生物处理系统的效能和稳定性发挥重要作用.
在产甲烷环境中,这些短链挥发酸和乙醇的降解是通过产氢产乙酸菌和产甲烷菌的互营协作来完成的[5].产氢产乙酸菌的这种代谢方式使其分离培养十分困难,导致只有少数产氢产乙酸菌被分离和鉴定[5].产氢产乙酸菌广泛存在于各种厌氧生境中,它们的组成和分布受到诸多因素的影响[6-8]. Ariesyady等[9]用显微放射自显影-荧光原位杂交的方法发现:在一个城市废水处理厂的厌氧反应器中,当丙酸浓度为0.5mmol/L时,是主要的食丙酸产氢产乙酸菌,而是丙酸浓度为2.5mmol/L条件下的主要食丙酸产氢产乙酸菌.实时荧光定量PCR(qPCR)分析表明,高水力停留时间(HRT)有利于的生长,而低HRT促进了的生长[10]尽管一些研究已经报道了互营产甲烷菌群(产氢产乙酸菌群和产甲烷菌群)在升流式厌氧污泥床反应器(UASB)、厌氧消化器、自然生境中的分布特征[7-8,10].然而,互营产甲烷菌群在厌氧折流板反应器(ABR)中不同格室分布特征的相关报道仍然较少.
ABR反应器是由一系列垂直的折流板组成[11].它的特殊构造有利于颗粒污泥的形成、生物相的分离、微生物的截留、以及抗冲击负荷能力的提高,适用于处理各种高浓度及难降解有机废水[2,11].ABR反应器的成功启动是其处理有机废水的先决条件.因此,本研究考察以絮状污泥为接种污泥时,ABR反应器启动期的运行特征以及互营产甲烷菌群在ABR反应器中不同格室的分布特征,为优化ABR反应器的启动过程、强化互营产甲烷作用及运行稳定性提供理论基础.
1 材料与方法
1.1 试验装置
试验装置为ABR,由有机玻璃制成,其有效容积为27.8L.ABR由4个相等的格室组成(记作C1、C2、C3、C4),每个格室用垂直的隔板将其分为下向流室和上向流室(体积比1:4).每个向上流室沿壁设置4个等间距的取样口.每个格室顶部设有集气管与水封相连,产生的气体由湿式气体流量计计量.水封和气体流量计装有pH 3.0的水以防止气体溶解.反应器外壁缠绕电热丝,通过温控仪将内部混合液的温度控制在(35±1)℃.试验废水由蠕动泵控制流量进入第1格室,最后从第4格室上部流出.
1.2 试验废水及接种污泥
试验废水为稀释的制糖废水,添加尿素和KH2PO4使COD:N:P为200~300:5:1,并补充微生物生长所必须的微量元素及维生素等[12].
接种污泥取自哈尔滨市某污水处理厂二沉池好氧污泥和哈尔滨某啤酒厂厌氧生物处理系统中二沉池厌氧污泥.其中第1格室以好氧污泥为种泥;第2格室和第3格室则以好氧污泥:厌氧污泥(VSS)分别为2.5:1和1:2.5的比例接种;第4格室以厌氧污泥为接种污泥.第1,2,3,4格室污泥生物量分别为15.23,14.92,13.74,14.31g VSS/L.
1.3 反应器运行控制
ABR启动过程分为3个阶段:污泥驯化阶段、效能提高阶段、负荷提高阶段.污泥驯化阶段采用低负荷运行方式,固定HRT为24h,进水COD分阶段从500mg/L逐步提高到6000mg/L.效能提高阶段采用延长HRT与提高进水COD浓度交替进行的方式,将HRT由24h经由36h延长至48h,而进水COD浓度由6000mg/L提高至8000mg/L.负荷提高阶段采用固定COD浓度,逐步缩短HRT的方式,将HRT由48h经由42h缩短至36h.反应器运行温度控制在(35±1)℃,进水pH值控制在8.0左右.每次改变运行条件均在前一次运行达到稳定时进行.启动结束时从4个格室污泥床采集污泥样品,保存至-20℃备用.
1.4 分析项目及方法
COD、pH值和生物量采用标准方法测定[13],气体组成和挥发酸组成采用气相色谱仪测定(SP- 6800A和SP6890,山东鲁南瑞虹化工仪器有限公司),测定方法参照以前研究[12].
1.5 扫描电子显微镜观察活性污泥形态
在污泥样品中加入戊二醛(2.5%)于4℃固定2h;用0.1mol/L磷酸缓冲液冲洗3次;用不同浓度乙醇依次脱水;用无水乙醇/叔丁醇(体积比1:1)、纯叔丁醇各置换1次;用HCP-2型(HITACHI)临界点干燥仪进行干燥;将样品观察面朝上粘贴在扫描电镜观测样品台上,用E-1010(HITACHI)型离子溅射镀膜仪在样品表面镀上一层厚度15nm金属膜,然后镜检.
1.6 DNA提取、PCR及DGGE分析
称取0.15g污泥(湿重),采用DNA提取试剂盒(MO Bio Laboratories,Inc,Carlsbad,CA,USA)提取厌氧活性污泥总DNA.DNA浓度用分光光度计测定(Thermo Fisher Scientific Inc.USA).
PCR反应体系(50μL)为:DNA 2.0μL,正、反向引物(20μmoL/L)各0.5μL,dNTPs (2.5mmoL/L)4.0μL, 10×ExTaq buffer 5.0μL,ExTaq酶(5U/μL) 0.8μL,超纯水37.2μL.反应程序:94℃预变性5min;94℃变性1min,55℃退火45s(古细菌退火温度56℃),72℃ 45s,30个循环;72℃延伸7min.所用引物为真细菌通用引物和古菌通用引物[12].
取15μL上述PCR产物进行DGGE.电泳条件:聚丙烯酰胺浓度40%~60%,电压120V、温度60℃,时间10h,然后进行银染.将DGGE凝胶中的条带用手术刀片切下来、碾碎并置于30μL 1×TE缓冲溶液中, 40℃恒温水浴3h(期间每30min颠倒混匀一次). 12000r/min离心3min.取3μL上清作为模板,用上述通用引物进行PCR扩增.然后用胶回收试剂盒(赛百盛)纯化PCR产物,将纯化的PCR产物连接到pMD18-T 载体上并转化到大肠杆菌DH5α中,随机挑选3个白色克隆进行PCR检测,将阳性克隆送至上海生工生物技术有限公司测序,测序结果与NCBI的GenBank数据库中的16S rRNA基因序列对比分析.
1.7 qPCR分析
定量分析采用绝对定量方式.所用引物为真细菌和古菌通用引物[12].标准样品为含目的基因序列的重组pMD18-T质粒.将标准样品进行10倍梯度稀释(101~107).标准样品和待测样品同时进行实时qPCR检测.qPCR在荧光定量分析系统(Model 7500, ABI,Foster,CA,USA)中完成,所用荧光染料为SYBR green.反应体系:引物1μmol/L,SYBR Green Mix 10μL(Toyobo Co.,LTD.,Japan),H2O 5.96μL,ROX 0.04μL,DNA模板3μL.反应程序:94℃预变性1min,94℃15s,58℃ 30s,72℃35s数据采集,40个循环.每个qPCR反应设置3个重复.以达到对数增长时的循环数(Ct值)为横坐标,标准质粒数目的对数值为纵坐标绘制标准曲线,得到关于真细菌和古菌的一元线性回归方程分别为=-0.3031+11.626 (2=0.9929),=-0.2769+10.455 (2=0.9982).
2 结果与分析
2.1 ABR启动期运行特征
ABR是一种符合分阶段多相厌氧工艺思想的高效厌氧反应器[11].在流态上,ABR具有良好的生物相分离的特征,使参与甲烷发酵的主要功能微生物菌群能够生长于各自最佳的环境中,促使厌氧生物处理过程的效率与稳定性大大提高.ABR反应器启动成功的标志就是颗粒污泥的形成和微生物相分离功能的实现[2,11].本研究中,ABR采用低负荷、分阶段运行方式进行启动,经过228d调控运行达到稳定,完成了启动过程.如表1所示,污泥驯化阶段历时120d达到稳定状态,且稳定期的COD去除率仅为61.5%.从出水挥发酸的组成可以看出,造成COD去除率较低的主要原因是乙酸和丙酸不能被有效的降解,它们的浓度分别为1072,554mg/L.说明乙酸营养型产甲烷菌和食丙酸产氢产乙酸菌的代谢活性在此阶段受到显著的抑制.该阶段第3,4格室pH£6.2,而大多数产甲烷菌和食丙酸产氢产乙酸菌适宜的pH范围是6.8~7.2[4,14].因此,乙酸和丙酸在这个阶段发生了明显的积累,进而导致COD去除率较低.在最后一个格室仍然含有一定量的氢气,表明氢营养型产甲烷菌的活性也受到一定程度的抑制.而氢分压也是影响产氢产乙酸菌活性的主要原因之一[4].
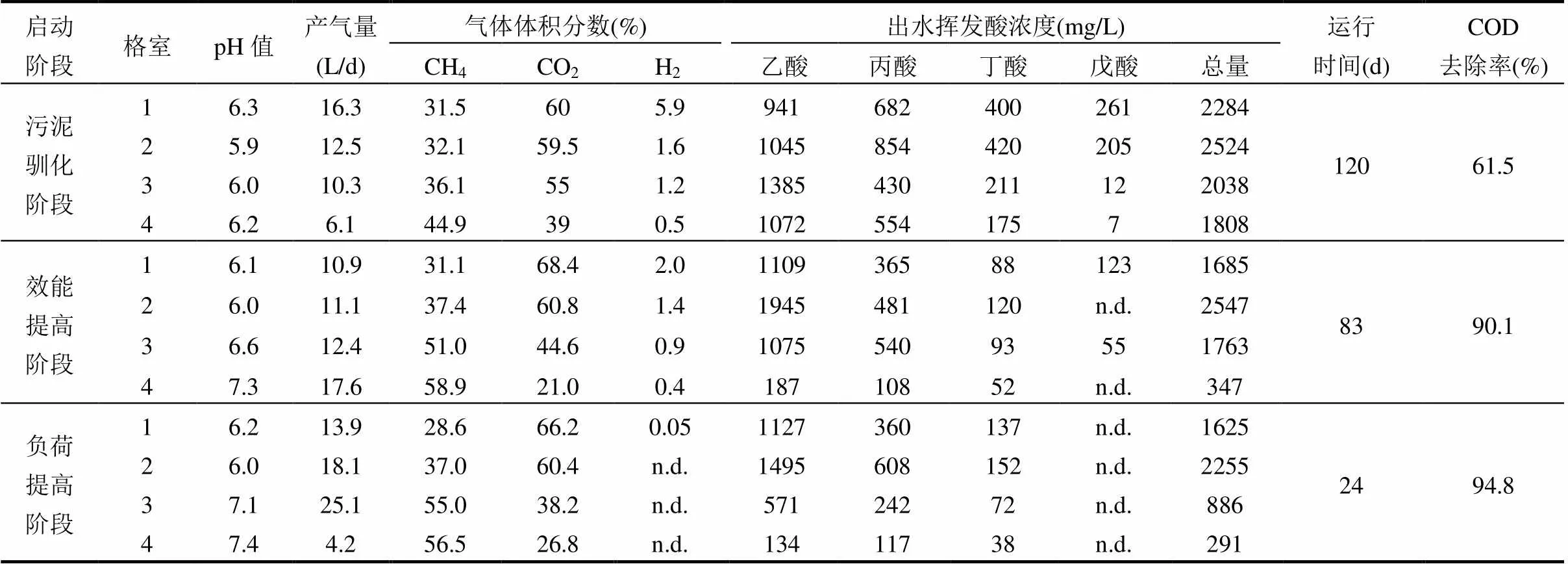
表1 ABR启动期各阶段稳定期运行特征
注:“n.d.”表示含量低于检测限.

图1 ABR启动期各格室生物量
在效能提高阶段,随着HRT逐步由24h延长至48h,产氢产乙酸菌群和产甲烷菌群的代谢活性逐步提升,尤其是ABR的第3,4格室,发酵气体中甲烷含量分别达到了51.0%和58.9%,出水挥发酸总量降低至347mg/L,使得COD去除率也随之增加并最终稳定在了90.1%(表1).在负荷提高阶段,逐步缩短HRT至36h,COD去除率保持了稳步上升的趋势,仅运行了24d就达到了稳定状态.分析认为,HRT的逐步缩短促使ABR系统中颗粒污泥大量形成,提高了反应器的生物量以及抗负荷冲击能力,导致ABR反应器可在短时间内达到高效稳定的运行状态.其出水挥发酸残留仅为291mg/L,COD去除率高达94.8% (表1).然而,当ABR处理疫病动物尸骸废水时,在有机负荷率为4.6kgCOD/(m3·d)条件下,其COD去除率只有88.0%[11].第1,2格室产生了大量挥发酸,而第3,4格室的挥发酸显著减少,甲烷含量却明显增加,说明该ABR系统的1,2格室为产酸相,3,4格室为产甲烷相.

图2 ABR不同格室的污泥形态
如图1所示,在ABR启动的污泥驯化阶段(HRT 24h、进水COD 6000mg/L) 达到稳定运行时,第1~4格室的MLVSS分别为8.3,8.5,10.1,9.2g/L.在效能提高阶段,随着HRT延长至48h,进水COD增加至8000mg/L,ABR 4个格室的生物量增加了18.1%~ 75.0%.这一结果表明,较长的HRT促进了厌氧污泥中微生物的增殖.在负荷提高阶段,HRT从48h 逐步缩短到36h,有机负荷率由4.0kgCOD/(m3·d)提高到了5.4kgCOD/(m3·d).ABR系统第1~4格室的生物量持续增加,分别达到了11.2,13.4,18.4,16.7g/L.分析认为,生物量的增加与ABR系统中污泥的颗粒化有关.在ABR系统第2~4格室已经形成厌氧颗粒污泥(图2),提高了系统的抗负荷冲击能力[2].较高的生物持有量,为ABR系统的高效稳定运行奠定了基础.
2.2 生物相变化特征.
ABR相分离功能将具有不同生理生态特征的微生物分布在不同格室,使其各自在适宜环境条件下发挥着较强的代谢活性.为了探讨ABR 的相分离特征,本研究通过qPCR分析了负荷提高阶段真细菌和古菌在ABR不同格室的分布特征.如图3所示,第1、2格室以真细菌为主,其含量分别为3.6´106个和1.2´106个16S rRNA基因拷贝数/ng DNA.相反,古菌在第1,2格室的含量比真细菌少2个数量级.主要是由于前2个格室主要功能为产酸发酵(表1),而参与产酸发酵的微生物属于真细菌.与第1,2格室相比,第3格室的古菌含量显著增加,达到了1.6´106个16S rRNA基因拷贝数/ng DNA.尽管第4格室的古菌含量显著减少,但仍然占细菌总数的50%左右.类似地,刘然等的研究也表明,ABR的前端格室以真细菌为主,而后端格室中古菌的相对丰度明显增加[15].

图3 ABR系统中真细菌和古菌分布特征
2.3 产氢产乙酸菌群的分布特征
为了解产氢产乙酸菌群在ABR各格室的分布规律,在ABR启动结束时,对每个格室的污泥进行了真细菌PCR-DGGE分析.结果表明(图4),有3个条带的16S rRNA基因序列与已鉴定产氢产乙酸菌高度相似,且均为食丙酸产氢产乙酸菌.其中,条带B1和B2分别与变形菌门的和高度相似(95%)(表2).当与产甲烷菌共存时,这两种菌可以氧化丙酸生成乙酸和CO2/H2,同时也可以在一些特殊的底物上纯培养[4].条带B3与厚壁菌门低GC 含量的革兰氏阳性菌的相似性为96%.是一个专性互营菌,只有与产甲烷菌共培养时才能生长.它们通过甲基丙二酰-辅酶A途径(MMC)降解丙酸[4].

表2 产氢产乙酸菌和产甲烷菌16S rRNA部分序列的BLAST比对结果
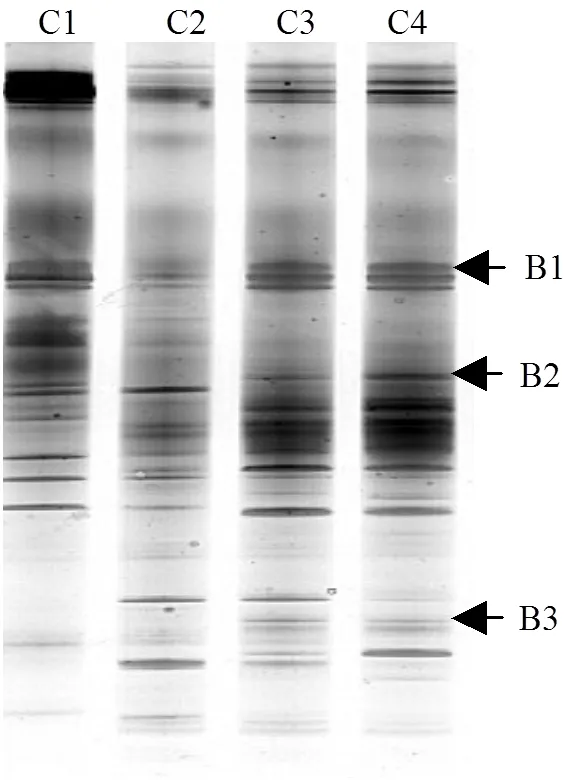
图4 ABR启动结束时真细菌DGGE图谱
从图4可以看出,所有的产氢产乙酸菌分布在第3,4格室.由表1可知,第3,4格室的pH为7.0~7.4,适合产氢产乙酸菌的生长.图4表明,条带B1和B2的信号明显高于条带B3,说明可能是ABR系统中主要的产氢产乙酸菌.从表1可以看出,ABR第2格室出水丙酸浓度高达608mg/L,经过第3,4格室的降解之后,80.8%的丙酸被去除,可见,这些食丙酸产氢产乙酸菌在ABR系统的丙酸降解中起着重要作用.类似地,陈重军等[16]发现是ABR厌氧氨氧化反应器中的主要产氢产乙酸菌.然而,在一个以葡萄糖为唯一碳源的ABR中,是主要的产氢产乙酸菌[17].此外,从表1还可以看出,经过第3,4格室的降解后,丁酸浓度从152mg/L降低至38mg/L,说明少量的食丁酸产氢产乙酸菌可能存在于第3,4格室.然而, PCR-DGGE并没有检测到与已知食丁酸产氢产乙酸菌高度相似的条带.这可能是由于食丁酸产氢产乙酸菌的含量低于PCR-DGGE的检测限或一些未知的食丁酸产氢产乙酸菌存在于系统中造成的.
2.4 产甲烷菌群的分布特征
在甲烷发酵系统中,产氢产乙酸菌的生长代谢离不开产甲烷菌的协同作用,因此本研究也对古菌进行了PCR-DGGE指纹分析.从古细菌DGGE图谱(图5)中获得9条16S rRNA基因部分序列.条带A1和A4与未知的古菌高度相似(97%以上).条带A2, A3,A6,A8,A9与氢营养型产甲烷菌(,,,,)的相似性为98%~100%(表2).这些氢营养型产甲烷菌可利用H2/CO2和甲酸进行生长代谢[14].条带A5,A7分别与产甲烷丝状菌和高度相似(99%).产甲烷丝状菌属可以利用浓度低至5~ 20µmol/L的乙酸[14].从DGGE图谱上可以看出,在ABR系统中,产甲烷菌群在各个格室中的分布存在着明显的演替过程.从前端格室到后端格室,产甲烷菌的多样性逐渐提高.
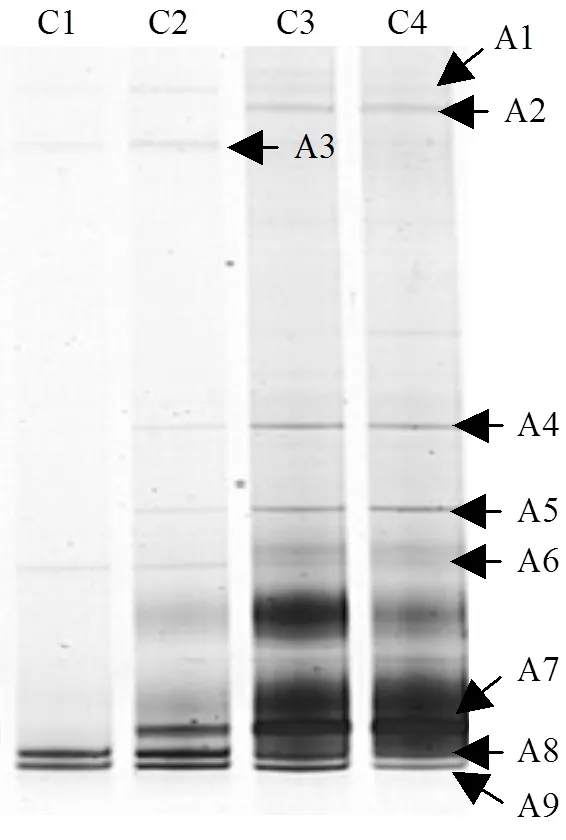
图5 ABR启动结束时古菌DGGE图谱
由图5可知,ABR第1,2格室的优势产甲烷菌为(条带A8),(条带A9),已有研究结果表明,这两个属的产甲烷菌为耐酸产甲烷菌[18-19].除此之外,条带A3 ()和A6 ()也存在于在第1,2格室.一些研究表明,氢营养型产甲烷菌比乙酸营养型产甲烷菌更耐酸[9,20-21].耐酸产甲烷菌的存在降低了ABR系统产酸格室的氢分压 (表1),为产酸发酵菌群解除了产物的反馈抑制作用.这些耐酸氢营养型产甲烷菌使得ABR系统的产酸格室(第1,2格室)的甲烷产量分别达到了4.0,6.7L/d.第3,4格室的主要产甲烷菌是(条带A2),Uncultured ArcI archaeon (条带A4),(条带A5)、(条带A7),(条带A8)、(条带A9).结合图5和表2可以发现,乙酸营养型产甲烷菌(和)存在于ABR系统的第2~4格室.产甲烷丝状菌(和)不仅是产甲烷系统中常见的乙酸营养型产甲烷菌,而且能促进颗粒污泥的形成[22].图2也证实了第2~4格室的微生物是以颗粒污泥的形式存在的.以前的研究也发现,产甲烷丝状菌是颗粒污泥反应器中主要的乙酸营养型产甲烷菌[23-24].这些产甲烷菌使得ABR系统第3,4格室的甲烷含量达到了55%以上.本研究还发现,产甲烷菌的多样性要明显高于产氢产乙酸菌,说明与产甲烷作用相比,在系统遭受冲击时,产氢产乙酸作用可能会成为第一限速步骤.
3 结论
3.1 在中温条件下,ABR系统经过3个阶段的调控运行完成了启动过程,在有机负荷率为5.4kgCOD/ (m3·d)条件下,COD去除率达到了94.8%,且在第2~4格室形成了性能良好的颗粒污泥.
3.2 ABR系统的前2格室以真细菌为主,而后2格室中的古菌数量显著增加,其中,为优势产氢产乙酸菌,主要分布在第3,4格室.
3.3 在ABR系统的第1,2格室主要为耐酸的氢营养型产甲烷菌(,),而乙酸营养型产甲烷菌(,)主要分布在第3,4格室.
[1] 吴 鹏,陆爽君,徐乐中,等.ABR耦合间歇曝气MBR工艺处理生活污水研究[J]. 中国环境科学, 2015,35(9):2658-2663.
[2] 赵 丽,陈 晴,王毅力,等.ABR 处理模拟畜禽养殖废水中有机物的快速启动与运行优化研究[J]. 环境工程学报, 2017,11(7):3943- 3949.
[3] 杨 敏,陈德珍,戴晓虎.污泥热解液与牛粪混合厌氧消化特性研究[J]. 中国环境科学, 2018,38(2):634-642.
[4] Li J, Ban Q, Zhang L, et al. Syntrophic propionate degradation in anaerobic digestion: A review [J]. International Journal of Agriculture and Biology, 2012,5:843–850.
[5] Mcinerney M J, Struchtemeyer C G, Sieber J, et al. Physiology, ecology, phylogeny and genomics of microorganisms capable of syntrophic metabolism [J]. Annals of the New York Academy of sciences, 2008,1125:58-72.
[6] Sekiguchi Y, Kamagata Y, Nakamura K, et al. Fluorescence in situ hybridization using 16S rRNA- targeted oligonucleotides reveals localization of methanogens and selected uncultured bacteria in mesophilic and thermophilic sludge granules [J]. Applied and Environmental Microbiology, 1999,65:1280–1288.
[7] Antwi P, Li J, Boadi P O, et al. Functional bacterial and archaeal diversity revealed by 16S rRNA gene pyrosequencing during potato starch processing wastewater treatment in an UASB [J]. Bioresource Technology, 2017,235:348-357.
[8] Zhang Y, Wang X, Hu M, et al. Effect of hydraulic retention time (HRT) on the biodegradation of trichloroethylene wastewater and anaerobic bacterial community in the UASB reactor [J]. Applied Microbiology and Biotechnology, 2015,99:1977-1987.
[9] Ariesyady H D, Ito T, Okabe S. Functional bacterial and archaeal community structures of major trophic groups in a full-scale anaerobic sludge [J]. Water Research, 2007,41:1554–1568.
[10] 班巧英,张 瑞,张立国,等.荧光定量PCR解析酸性条件下丙酸氧化菌的演替 [J]. 中国环境科学, 2017,37(10):3861-3866.
[11] 刘梦林,李 平,于可可,等.有机负荷对ABR处理疫病动物尸骸废水的产酸及产甲烷特性影响 [J]. 环境工程学报, 2016,10(6):3051- 3056.
[12] Ban Q, Li J, Zhang L, et al. Syntrophic propionate degradation response to temperature decrease and microbial community shift in an UASB Reactor [J]. Journal of Microbiology and Biotechnology, 2013,23:382-389.
[13] 国家环保局.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002.
[14] Liu Y, Whitman W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea [J]. Annals of New York of Academy Science, 2008,1125:171-189.
[15] 刘 然,彭剑锋,宋永会,等.厌氧折流板反应器(ABR)中微生物种群演替特征[J]. 环境科学研究, 2010,23(6):741-747.
[16] 陈重军,张海芹,汪瑶琪,等.基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析 [J]. 环境科学, 2016,37(7):2652-2658.
[17]刘 然,彭剑锋,宋永会,等.厌氧折流板反应器酸化及对其对为生物种群分布的影响 [J]. 环境科学, 2010,31(7):1554-1560.
[18] Bräuer S L, Cadillo-Quiroz H, Yashiro E, et al. Isolation of a novel acidiphilic methanogen from an acidic peat bog [J]. Nature, 2006, 442:192-194.
[19] Cadillo-Quiroz H, Yavitt J B, Zinder S H.gen.nov.,sp.nov.,a hydrogenotrophic methanogen isolated from a minerotrophic fen peatland [J]. Internatinal Journal of System and Evolutionary Microbiology, 2009,59:928-935.
[20] Horn M A, Matthies C, Kϋsel K, et al. Hydrogenotrophic methanogenesis by moderately acid-tolerant methanogens of methane-emitting acidic peat [J]. Applied and Environmental Microbiology, 2003,69:74-83.
[21] Zhang L, Ban Q, Li J, et al. Response of syntrophic propionate degradation to pH decrease and microbial community shifts in an UASB reactor [J]. Journal of Microbiology and Biotechnology, 2016,26:1409-1419.
[22] Keyser M, Witthuhn R C, Lamprecht C, et al. PCR-based DGGE fingerprinting and identification of methanogens detected in three different types of UASB granules [J]. Systematic and Applied Microbiology, 2006,29:77-84.
[23] Kim T G, Yun J, Cho K S. The close relation betweenandis a keystone for stable methane production from molasses wastewater in a UASB reactor [J]. Applied Microbiology and Biotechnology, 2015,99(19):8271-8283.
[24] Pillay S, Foxon K, Rodda N, et al. Microbiological studies of an anaerobic baffled reactor (ABR) [J]. Materials Science and Engineering Applications, 2010,15(2):750-754
The performance of ABR at startup and the distribution of syntrophic methanogens.
BAN Qiao-ying1*, LIU Qi1, ZHANG Li-guo1, LI Jian-zheng2
(1.College of Environment and Resource, Shanxi University, Taiyuan 030006, China;2.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China)., 2018,38(9):3351~3357
An anaerobic baffled reactor (ABR) was employed to investigate the operational performance and the distribution of syntrophic methanogens during the treatment of sugar refinery wastewater. The distribution of syntrophic methanogens was analyzed by polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE). COD removal was 61.5% and volatile fatty acids (VFAs) in effluent were 1808mg/L at sludge acclimation stage. After the regulation operation of two stages, the VFAs were dramatically reduced and methane content was increased to above 55%. The COD removal was achieved 94.8% at the stable state. The granular sludge with good settling performance was formed in the last 3compartments. PCR-DGGE explored that the dominant hydrogen-producing acetogens were related to the generaand, which were distributed in the third and fourth compartments of ABR. The acid-tolerant hydrogenotrophic methanogens (and) were mainly distributed in the first and second compartments, while acetotrophic methanogens (and) mainly existed in the third and fourth compartments. The present study found the diversity of methanogens was higher than that of hydrogen-producing acetogens, indicating hydrogen-producing acetogenesis is more likely to be a rate-limiting step when the system is shocked.
anaerobic baffled reactor;operation at startup;hydrogen-producing acetogens;methanogens;PCR-DGGE
X703.5
A
1000-6923(2018)09-3351-07
班巧英(1982-),女,山西忻州人,讲师,博士,主要从事废水厌氧生物处理研究.发表论文30余篇.
2018-02-08
国家自然科学基金(51708341);哈尔滨工业大学城市水资源与水环境国家重点实验室开放课题(QA201523);山西省“青年三晋学者”支持计划,山西省高等学校优秀创新团队支持计划
* 责任作者, 讲师, banqiaoying@163.com

