屎肠球菌B21对高脂饮食Wistar 大鼠体重、空腹血糖和粪便菌群的影响
王严严,杨 静,邵则淮,蒋惠男,张 江,陈兰明,*
(1.农业部水产品贮藏保鲜质量安全风险评估重点实验室(上海),上海海洋大学食品学院,上海 201306; 2.上海市农林职业技术学院动物科学技术系,上海 201699)
乳酸菌是公认的益生菌,具有降低宿主血糖、免疫调节、维持肠道菌群平衡等健康促进作用[1-3]。屎肠球菌(E.faecium)是隶属于肠球菌属(Enterococcus)的益生乳酸菌,具有一定的益生功效[4]。
目前,国内外有关屎肠球菌促进实验动物(仔猪或鼠类)生长、提高免疫力和改善肠道菌群的研究已取得一定进展。例如,黄怡[5]研究发现,E.faeciumEF1菌株的摄入能够促进仔猪生长,并提高宿主的免疫力;丁爽等[6]研究发现,E.faeciumB13能够维持仔猪肠道中的菌群稳态,遏制致病微生物的生长;Annette Zeyner等[7]研究发现,口服E.faeciumDSM 10663 NCIMB 10415可促进未断奶仔猪每日体重的增长并减少腹泻的发生。王永[8]研究发现,仔猪饲料中添加E.faeciumB-1微胶囊制剂可以改善仔猪生长性能,维持肠道微生态平衡,增强免疫力。然而,屎肠球菌对宿主血糖调节作用的研究鲜有报道。
在前期研究中,本实验室从中国传统发酵食品中分离、鉴定、保存了E.faeciumB21菌株[9]。体外益生菌功能评价结果显示,该菌株对人工肠液和人工胃液具有较好的耐受性[10],说明E.faeciumB21可以在宿主胃肠极端环境中生存,从而在肠道中定殖,发挥益生功能。在前期研究基础上,本实验主要分析E.faeciumB21菌株的摄入对高脂饮食Wistar大鼠体重、空腹血糖和肠道菌群多样性的影响,评价其在宿主体内的益生作用,为屎肠球菌应用于动物养殖业以及开发降血糖与改善肠道的功能性食品提供科学依据。
1 材料与方法
1.1 材料与仪器
脱脂乳、海藻糖、TAE(50×Tris-乙酸)缓冲液(pH8.4)和无水乙醇 上海生工生物工程技术有限公司;MRS(De Man Rogosa and Sharp)培养基 北京陆桥技术有限责任公司;TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0试剂盒 大连宝生物工程有限公司;3周龄SPF(Specific pathogen free)级雄性Wistar大鼠(动物生产许可证号SCXK(沪)2017-0005) 上海斯莱克实验动物有限公司;基础饲料和高脂饲料 上海普路腾生物科技有限公司。
MilliQ Advantage型纯水仪 密理博中国有限公司;5417R型台式高速低温冷冻离心机 艾本德中国有限公司;ACB-4A1型超净台 新加坡艺思高科技有限公司;PL2002型精密天平 梅特勒-托利多国际有限公司;Synergy 2型多功能酶标仪 美国伯腾仪器有限公司;JY300C型核酸电泳仪 北京君意东方电泳设备有限公司;安准型血糖仪 三诺生物传感股份有限公司。
1.2 实验方法
1.2.1 菌株和培养条件E.faeciumB21菌株由本实验室从中国传统发酵食品中分离、鉴定并保存[9]。参考Xu等[9]的方法,经37 ℃活化后,以1%的接种量接种该菌株于MRS液体培养基中,37 ℃厌氧培养18 h,连续传代培养2次,得到新鲜培养物,以4000 r/min离心10 min,收集菌体,用无菌水洗涤2次,重悬菌体于6%脱脂乳液中,使菌体浓度达到108CFU/mL。
1.2.2 动物实验 36只Wistar大鼠饲养于上海农林职业技术学院实验动物驯养中心标准化动物实验室,室温(20±2) ℃,湿度40%~60%,自然光照,自由摄食和饮水。适应性饲养2周后随机分为3组:正常对照组(NCD组)、高脂饮食组(HFD组)、E.faeciumB21干预组(HFD+B21),每组12只(每笼4只,每组3笼)。NCD组喂普通饲料,每天每只大鼠灌胃0.2 mL的生理盐水(0.86% NaCl);HFD组饲喂高脂饲料,每天每只大鼠灌胃0.2 mL的6%脱脂乳液,脱脂乳液制备方法为:6 g脱脂乳+6 g海藻糖溶于100 mL去离子水中;HFD+B21组饲喂高脂饲料,每天每只大鼠灌胃0.2 mL含108CFU/mLE.faeciumB21的6%脱脂乳液。各组大鼠均连续灌胃7周。
1.2.3 体重及血糖的测定 实验期间观察大鼠的食欲、毛发、大便和整体精神状态等情况,每周一次定期称量每只大鼠的体重[11]。实验第7周对所有大鼠进行尾部采血,使用血糖仪测定空腹血糖[12]。
1.2.4 高通量测序分析 最后一次灌胃24 h后,分别收集每组6只(每组3笼,每笼2只)大鼠的粪便置于同一个无菌的均质袋内,加入50 mL的0.86%的生理盐水充分均质后,于4 ℃ 600 r/min离心5 min去除粪便中的固体物质,取其上清液采用TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0试剂盒提取粪便总菌DNA。提取的DNA样品置于干冰中,送至上海美吉生物医药科技有限公司进行16S rRNA基因V3-V4区的PCR扩增(上游引物:5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物:5′-GGACTACHVGGGTWTCTAAT-3′),并利用Illumina MiSeq平台上机测序。采用UCHIME软件[13]对获得的序列进行质量控制,运用Mothur Ver.1.32.0软件[14]进行物种丰富度指数(Chao1/ACE 指数)、物种覆盖率、多样性指数(Simpson/Shannon指数)等的分析[5]。
1.3 数据分析
实验数据处理采用软件SPSS 17.0(IBM SPSS公司)进行统计学分析,组间比较采用配对t检验。数据结果用均值±标准误(Mean±SEM)表示,p<0.05为显著性差异。采用Fisher’ exact test方法和0.05的显著性水平检验组间细菌差异;基于Bray-curtis算法构建聚类树[15];采用Origin 8.0软件绘制物种门/属水平的柱形图。
2 结果与分析
2.1 E. faecium B21对大鼠体重的影响
实验期间观察发现,各组Wistar大鼠毛色光滑,精神活跃。由图1可知,实验开始前(0周)时,各组大鼠的体重无显著性差异(p>0.05);在实验的第1~7周,HFD+B21组大鼠的体重均显著高于NCD组大鼠的体重(p<0.05),且在第4~7周,也显著高于HFD组大鼠的体重(p<0.05)。值得注意的是,HFD组大鼠的体重在第3~7周才显著高于NCD组(p<0.05)。结果表明,高脂饮食能够使Wistar大鼠的体重增加,而E.faeciumB21的摄入进一步促进了高脂饮食Wistar大鼠体重的增长。与本研究结果一致,丁爽等[6]也研究发现,E.faeciumB13菌株的摄入能显著提高仔猪的体重。但有研究表明,E.faeciumDM891129对高脂喂食Wistar大鼠体重[16]和E.faeciumSF68菌株对育肥猪的体重均无显著影响[17],这可能与实验时间、动物种类或菌株的饲喂量有关。
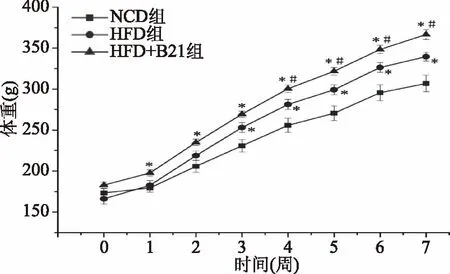
图1 屎肠球菌B21的摄入 对Wistar大鼠体重的影响(n=12)Fig.1 Effect of E. faecium B21 on body weights of the Wistar rats(n=12)注:其中*代表与NCD组相比差异显著(p<0.05); #代表与HFD组相比差异显著(p<0.05)。图2同。
屎肠球菌在动物养殖业,尤其是养猪业中的应用研究较为普遍,可以起到提高动物的生长速度,改善动物健康水平的作用[8]。本研究结果显示,连续7周摄入E.faeciumB21菌株(108CFU/mL)后,显著增加了高脂饮食Wistar大鼠的体重(p<0.05)。目前,屎肠球菌促进宿主生长的机制假设主要包括:其一屎肠球菌能在肠道中迅速形成优势菌群,增加有益菌数量,抑制有害微生物的繁殖,促进宿主健康生长[18]。其二屎肠球菌能有效提高营养物质的利用率,促进宿主对营养物质的消化吸收[8]。其三屎肠球菌在宿主肠道内定殖后,能增强宿主机体抗氧化能力,可以有效地帮助宿主清除机体自由基,保证宿主健康成长[8];体外益生菌功能评价结果显示,E.faeciumB21具有体外抗氧化活性[9],因此E.faeciumB21促进高脂饮食Wistar大鼠体重也可能与其抗氧化活性有关。
2.2 E. faecium B21对大鼠空腹血糖的影响
由图2可知,在实验的第7周,HFD组大鼠的空腹血糖显著高于NCD组(p<0.05),表明高脂饮食显著提高了Wistar大鼠的空腹血糖;而HFD+B21组大鼠的空腹血糖显著低于HFD组(p<0.05),并且与NCD组无显著性差异(p>0.05),表明摄入E.faeciumB21能够有效抑制由高脂饮食引起的Wistar大鼠空腹血糖升高。饲喂LactobacillusacidophilusATTC5220菌株(109CFU/mL)显著降低了高血糖小鼠的空腹血糖水平[19],同样LactobacillusgasseriBNR17菌株(107CFU/mL)也能降低糖尿病小鼠的空腹血糖[20],上述研究结论与本研究结果相符合。目前,普遍认为乳酸菌降低血糖的机制主要是:其一乳酸菌在分子水平上通过激活胰岛素信号通道,抑制葡萄糖升高[21];其二乳酸菌的抗氧化能力,研究表明机体氧化损伤和抗氧化能力在糖尿病的发病机制中起着非常重要的作用[22]。因此E.faeciumB21降低高脂饮食大鼠空腹血糖可能与其抗氧化活性有关。

图2 屎肠球菌B21摄入7周 对Wistar大鼠空腹血糖的影响(n=12)Fig.2 Effect of E. faecium B21on fasting blood glucose levels of the Wistar rats treated for seven weeks(n=12)
2.3 菌群丰度和多样性分析
为比较三组大鼠粪便样本的菌群差异,利用Illumina MiSeq测序平台分析了样本菌群组成,共获得114071条高质量序列,平均序列长度为432 bp。三组样本的物种覆盖度值均大于0.99,表明本研究的测序深度覆盖了样本中菌群的绝大多数(表1)。由图3A可知,三组样品的稀释曲线趋向平坦,说明测序数据量合理;由Shannon-Wiener曲线(图3B)可知,NCD组样品的群落多样性最高,HFD组次之,HFD+B21组最低,说明高脂饮食和E.faeciumB21均降低了Wistar大鼠粪便中菌群多样性;NCD组的Rank-Abundance曲线(图3C)在水平方向上最宽,且曲线最平缓,说明NCD组样品物种丰度最高,且物种分布最均匀,HFD组次之,HFD+B21组物种丰度最低,且分布最不均匀,说明高脂饮食和E.faeciumB21的摄入降低了Wistar大鼠粪便中菌群丰度。另外,序列分析鉴定到的OTU(Operational Taxonomic Units)数量也是NCD组最多(648),HFD组次之(395),HFD+B21组最少(350),这与Rank-Abundance曲线得出的结果相符,且喂食高脂饲料的HFD组和HFD+B21组之间菌群丰度差异较小。且ACE值和Chao1值在NCD组最高(ACE值为700.57,Chao1值为698.07),HFD+B21组最低(ACE值为398.12,Chao1值为398.49),说明NCD组菌群丰度最高,HFD+B21组最低。此外,HFD+B21组的Shannon值最小(3.83),而NCD组的Shannon值最大(5.06),也表明NCD组的菌群多样性最高(表1)。综上所述,Wistar大鼠粪便菌群丰度和多样性由高到低依次为NCD组>HFD组>HFD+B21组,表明高脂饮食降低了大鼠粪便菌群的丰度和多样性,这与马宁等[23]的研究结果一致。

表1 三组样品的OTU数量及菌群多样性Table 1 OTU numbers and diversity of bacterial population in three groups

图3 三组样本的稀疏曲线(A)、香农威纳曲线(B) 和等级丰度曲线(C)Fig.3 Rare faction curve(A),Shannon-Wiener curve(B) and rank-abundance curve(C)of the 3 experimental groups
2.4 门水平上的菌群组成及差异分析
由图4可知,三组大鼠样本肠道粪便菌群隶属于10个门:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、酸杆菌门(Actinobacteria)、螺旋菌门(Spirochaetae)、蓝菌门(Cyanobacteria)、Saccharibacteria、迷踪菌门(Elusimicrobia)和疣微菌门(Verrucomicrobia)。其中Saccharibacteria和Elusimicrobia仅存在于NCD组。在各样本的菌群组成中,Firmicutes丰度最高,其次是Bacteroidetes。Firmicutes在NCD组中占比最低(69.42%),在HFD组和HFD+B21组占比分别为88.20%和93.10%。相反,Bacteroidetes在NCD组中丰度最高(27.20%),而在高脂饲料喂食的HFD和HFD+B21组中丰度下降,分别为10.73%和5.59%。通过费舍尔检验(Fisher’exact test)样本间物种差异,结果显示,NCD组与HFD组共有的9个菌门(Firmicutes、Bacteroidetes、Protepbacteria、Tenericutes、Actinobacteria、Verrucomicrobia、Spirochaetae、Cyanobacteria、Saccharibacteria)均为差异性菌门(图5),表明高脂饲料明显改变了门水平上的菌群组成;而HFD组与HFD+B21组间有6个菌门(Firmicutes、Bacteroidetes、Protepbacteria、Actinobacteria、Verrucomicrobia和Spirochaetae)为差异性菌门。值得注意的是,NCD组、HFD组和HFD+B21组样本中的Firmicutes/Bacteroidetes(F/B)的比值分别为2.55、8.03和16.66,表明高脂饲料明显提高了HFD组和HFD+B21组的F/B比值,且HFD+B21组(6.53倍)增加幅度明显高于HFD组(3.15倍)。据文献报道,人类和鼠科动物肠道菌群中F/B的比值变化与肥胖相关[24],高脂饮食和肥胖能增大F/B的比值[25]。本研究结果表明,高脂饲料导致Wistar大鼠肠道菌群中Firmicutes增加,Bacteroidetes降低,即F/B比值增大,这与已有研究报道一致[26]。HFD+B21组的F/B比值大于HFD组,说明E.faeciumB21的长期摄入促进了高脂饮食大鼠的肥胖,这与本实验中HFD+B21组大鼠的体重高于HFD组的结果相符。Firmicutes在肠道中能够促进多糖发酵,该菌门的增多可能导致机体肥胖[26],所以Firmicutes可能介导了HFD+B21组大鼠体重的增加。此外,隶属于Proteobacteria的大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonella)、霍乱弧菌(Vibriocholerae)、幽门螺旋杆菌(Helicobacterrodentium)等菌是人类致病菌[26]。尽管E.faeciumB21的摄入降低了高脂饲料喂食大鼠肠道菌群的多样性,但是Bacteroidetes和Proteobacteria的占比随之下降,说明E.faeciumB21的摄入能够改善由高脂饮食引起的肠道菌群失调,这与黄怡[5]关于E.faeciumEF1以及Wang等[27]关于L.plantarumP8的摄入对仔猪和人体肠道菌群的研究报道一致。

图4 三组样本菌群在门水平上的相对丰度Fig.4 Relative abundance of the 3 experimental groups at the phylum level注:丰度小于1%的门归为其他。图6同。

图5 NCD组与HFD组(A)、HFD组与HFD+B21组(B)的菌群在门水平上的费舍尔检验Fig.5 Fisher’exact test bar plot of NCD vs HFD(A)and HFD vs HFD+B21(B)at thephylum level注:右侧图表示所设定的置信度区间内物种丰度的差异。*表示差异显著p<0.05, **差异极显著p<0.01,***差异极其显著p<0.001。
2.5 属水平上的菌群组成及差异分析
三组样本在属水平上的菌群组成如下:NCD组主要包括未分类属_拟杆菌_S24-7_组(Bacteroidales_S24-7_group_norank)、瘤胃球菌科_UCG-005_组(Ruminococcaceae_UCG-005)、毛螺旋菌科未分类属(Lachnospiraceae_unclassified)、乳酸杆菌属(Lactobacillus)和罗斯伯里氏菌属(Roseburia),这5个属占菌群总量的50.46%(图6)。而HFD组和HFD+B21组的优势菌属为Ruminococcaceae_UCG-005、Lachnospiraceae_unclassified和布劳特氏菌属(Blautia)等。如表2所示,益生菌菌属Blautia、乳酸杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)[26-27]的变化如下:Blautia在NCD、HFD和HFD+B21组菌群总量中的丰度分别0.98%、8.52%和17.38%,Lactobacillus在NCD、HFD和HFD+B21组菌群总量中的丰度分别为5.84%、4.45%和1.87%,而Bifidobacterium在三组样本中菌群总量中分别占比0.08%、0.23%和0.19%。这表明饲喂高脂饲料减少了大鼠肠道中的Lactobacillus,但促进了Blautia和Bifidobacterium的增殖,这与曹宏芳等[25]的研究结果不同,可能与Blautia和Bifidobacterium在肠道中代谢的物质有关,因为不同的高脂饲料含有的脂肪类型可能不同,高脂饲料和普通饲料中膳食纤维类型也可能不同[28];而E.faeciumB21的摄入进一步促进了大鼠肠道中Blautia的生长,这与曲巍等[29]对于复合益生菌提高了小鼠肠道中Blautia的研究结果相一致;但E.faeciumB21的摄入抑制了Lactobacillus和Bifidobacterium的增殖,这与L.plantarumP8增加了健康人群粪便菌群中的Bifidobacterium[27],以及LactobacillusparacaseiLC01活菌可以显著提高小鼠肠道内Lactobacillus[30]的研究报道不同,这可能与菌种及其来源、实验动物、饲料含脂量、实验周期等因素有关。而对于机会致病菌假单胞菌属(Pseudomonas)和脱硫弧菌属(Desulfovibrio)[23]的变化为:与NCD组(0.015%)相比,高脂饲料明显促进了Pseudomonas的生长:HFD组(0.15%),HFD+B21组(0.12%)(表2);Desulfovibrio在HFD组中丰度最高(1.41%),NCD组次之(0.38%),HFD+B21组最低(0.11%),表明高脂饲料同样刺激了Desulfovibrio在大鼠肠道中的增殖,而E.faeciumB21的摄入则抑制了机会致病菌属Pseudomonas和Desulfovibrio的生长。此外,Enterococcus在三组样本中的丰度分别为0.022%、0.019%和1.31%,说明高脂饲料抑制了Enterococcus的生长,这与刘雪姬等[31]关于高脂饮食小鼠肠道中Enterococcus减少的结果一致;然而,E.faeciumB21的摄入极大提高了高脂饲料喂食大鼠肠道中Enterococcus的丰度(68.95倍),说明E.faeciumB21的摄入很有可能在肠道中成功定殖。

图6 三组样本菌群在属水平上的相对丰度Fig.6 Relative abundance of the 3 experimental groups at the genus level

表2 三组样本中鉴定到的益生菌属和机会致病菌属Table 2 Probiotics and potential pathogenic bacteria identified in the three experimental groups at the genus level
肠道菌群与宿主相互依存、相互制约[32],肠道菌群平衡失调会引起机体急慢性疾病的发生[26,30]。本研究结果表明E.faeciumB21的摄入很有可能在肠道中成功定殖,进而发挥益生作用。从屎肠球菌促进机体生长的机制可以看出,益生菌调节肠道菌群的作用和宿主的体重息息相关;其中,屎肠球菌促进机体生长的部分机制也是益生菌调节肠道菌群的作用机制[33]。
2.6 OTU水平上的菌群组成及差异分析
此外,在OTU水平上,序列分析揭示了三组样本菌群中648(NCD组)、395(HFD组)、350(HFD+B21组)个OTU。其中238个OTU为三组样本所共有。而NCD、HFD和HFD+B21组特有的OTU占比分别为47.69%、9.11%、9.71%(图7)。组间聚类分析结果显示,HFD组和HFD+B21组聚为一簇,且与NCD分离,表明与NCD相比,HFD组和HFD+B21组菌群较为相似(图8)。
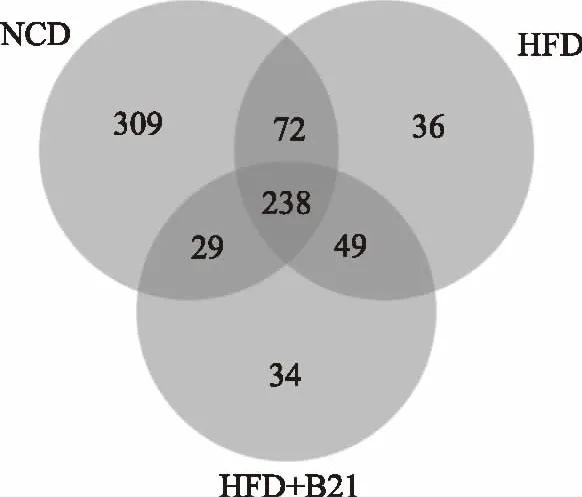
图7 三组样本在OTU水平上的韦恩图Fig.7 Venn diagram of the three experimental groups at the OTU level

图8 三组样本在OTU水平上的聚类树Fig.8 Hierarchical clustering tree of the three experimental groups at the OTU level
3 结论
本研究结果表明,高脂饲料的摄入明显提高了Wistar大鼠的体重和空腹血糖,改变了Wistar大鼠肠道粪便菌群的结构,导致肠道微生态失衡;而连续7周的E.faeciumB21菌株的摄入增加了高脂饮食Wistar大鼠的体重,同时降低了高脂饮食大鼠的空腹血糖,并且提高了大鼠肠道中益生菌属Blautia的丰度,抑制了致病菌属Pseudomonas、Desulfovibrio的生长。表明E.faeciumB21在动物养殖业有一定的应用价值,在降低高脂饮食Wistar大鼠血糖和改善其肠道菌群失调方面具有一定的益生作用。

